普通培养基与优化培养基对防城港海域真菌分离效果的影响*
刘思远,王巧贞,吴鸿仙,黄庶识,冯 洁**
(1.广西医科大学药学院,广西南宁 530021;2.广西科学院,广西生物物理与环境科学研究中心,广西南宁 530007)
0 引言
海洋真菌是海洋微生物的一个重要分支[1],它们常以寄生或腐生的方式,在海洋或港湾生态环境中生长[2,3],并且参与有机物的分解和无机营养物的再生过程,是维持海洋生态系统二氧化碳产生与固定之间动态平衡的关键[4]。同时,由海浪与河流黏土沉积形成的港湾泥滩,是一种与沙滩不同的独特环境[5],海洋微生物为了适应其特殊环境,往往发展出独特的生命代谢途径,由此能够产生结构特异、生物活性特殊的次生代谢产物[6,7]。因此,分离、纯化和鉴定海洋微生物,对于揭示当地海域微生物种类,保存菌种,建立样品库,提供研究海洋微生物药物和农药的有效菌种[8],以及进一步研究其次生代谢产物及其生理活性等均有重要意义。目前,已有文献报道常见真菌培养基的配方[9],北部湾海域也发现多种具有生物活性的海洋真菌[10-12],然而针对不同分离培养基及加入不同抑制剂的优化培养基对海洋真菌分离效果及分离多样性的系统研究报道较为少见。本文采用不同培养基对采自广西防城港的海泥样品进行研究,运用相对多度(Relative Abundance)、Simpson指数、Jaccard系数考察不同培养基在提取、分离、纯化菌种时的效果,在达到高效分离纯化菌种目标的同时,又可以自主选择分离样品的多样性与特异性,供同仁们参考;此外,分离得到的菌种还可以为后续海洋微生物的应用研究及次生代谢产物研究提供物质基础。
1 材料与方法
1.1 海泥样品
2017年12月23日,于防城港市(21°36′57″N,108°13′47″E)采集海泥样品,采样深度为海滩地面下15 cm处,将海泥样品置于采样袋中,用冰盒转运至广西科学院生物物理与环境科学研究中心,于4℃冰箱中暂存备用。
1.2 普通培养基与优化培养基
6种普通培养基(定容1 L)分别是MD普通培养基(葡萄糖10 g,蛋白胨5 g,磷酸二氢钾1 g,七水合硫酸镁0.5 g,琼脂20 g,无菌海水50%)、PDA普通培养基(煮沸去除滤液的马铃薯200 g,葡萄糖20 g,琼脂14 g,无菌海水50%)、YPDA普通培养基(蛋白胨20 g,酵母提取物10 g,葡萄糖2 g,0.2%腺嘌呤溶液15 mL,琼脂20 g,无菌海水50%)、CA普通培养基(硝酸钠3 g,磷酸二氢钾1 g,七水合硫酸镁0.5 g,氯化钾0.5 g,硫酸铁0.01 g,蔗糖30 g,琼脂20 g,无菌海水50%)、SA普通培养基(麦芽糖40 g,蛋白胨10 g,琼脂20 g,无菌海水50%)及PA普通培养基(蛋白胨2 g,七水合硫酸镁0.5 g,琼脂20 g,无菌海水50%)。各培养基使用去离子水配制,封口后在120℃下高温灭菌30 min,冷却至50℃时加入庆大霉素,使之浓度为50 μg/mL,以抑制细菌生长。
优化培养基以MD和PDA作为基础培养基。8种抑制剂如下:青霉素20 μg/mL、链霉素50 μg/mL、氯霉素0.1 mg/mL、孟加拉红1 mg/3 mL、青霉素20 μg/mL+庆大霉素50 μg/mL、链霉素50 μg/mL+庆大霉素50 μg/mL、青霉素20 μg/mL+氯霉素0.1 mg/mL、链霉素50 μg/mL+氯霉素0.1 mg/mL;后4种复合抑制剂以下简称为青+庆、链+庆、青+氯、链+氯。
1.3 仪器与设备
灭菌的离心管及移液器枪头,各量程的移液器。
SW-CJ-1F洁净工作台(苏州安泰空气技术有限公司)、LHS-250SC恒温恒湿箱(上海天呈实验仪器制造有限公司)、1-1SP小型台式离心机(德国SIGMA公司)、070-851型热循环仪(德国Biometra公司)、美国伯乐电泳仪系统、Omega Fluor凝胶成像仪(美国Aplegen公司)。
10%的chelex-100树脂(购自上海伯乐生命医学产品有限公司);胶红(购自BIOTIUM公司);引物ITS1、引物ITS4、5×loading buffer(购自上海捷瑞生物工程有限公司);Taq PCR Master Mix酶、ddH2O(购自生工生物工程上海股份有限公司);Trans 15K DNA Marker(购自北京全式金生物技术有限公司)。
1.4 真菌分离
称取2 g海泥置于装有8 mL无菌水溶液的灭菌离心管中,震荡后取上层悬浊液,用无菌水将其梯度稀释1 000倍,分别取100 μL涂布于各培养基上,每种培养基重复3次,每天观察并记录真菌生长情况,通过菌落形态、颜色、大小来确定真菌种类,并编号留样。
1.5 真菌纯化
将所得各菌种接种于相同的培养基上反复纯化,直至得到外观、形态、颜色上一致的无杂菌污染的纯种菌种。采用50%甘油水溶液置于-80℃冰箱中长期保存,采用内装有斜面固体培养基的试管置于4℃冰箱短期保存。
1.6 真菌DNA提取
在超净工作台上,挑取纯化得到的真菌菌落,按试剂盒操作指南或按传统提取DNA的方法进行操作。试剂盒为Ezup 柱式真菌基因组 DNA 抽提试剂盒,购自生工生物工程(上海)股份有限公司。传统方法即将菌落挑取至1.5 mL离心管中,倒入液氮研磨成粉末状;再加入10%的chelex-100树脂50 μL,水浴100℃加热10 min,冷却至室温(25℃以下)后,12 000 r/min离心10 min,保留上清液,即含真菌DNA。
1.7 PCR扩增
取1 μL 1.6节的上清液与12 μL Taq酶、0.5 μL ITS4引物、0.5 μL ITS1引物、11 μL ddH2O混合进行PCR扩增。PCR反应程序:94℃ 5 min;94℃ 1 min,53℃ 1 min,72℃ 1.5 min,34个循环后72℃充分延伸10 min。正向ITS1引物序列为5′-TCCGTAGGTGAACCTGCGG-3′,反向ITS4引物序列为5′-TCCTCCGCTTATTGATATGC-3′。
1.8 琼脂糖凝胶电泳检测
取1 μL扩增产物与DNA Marker进行凝胶电泳,条件为电压110 V,电流400 mA,电泳时间30 min。随后在Omega Fluor 凝胶成像仪下观察荧光条带以辨别DNA是否提取成功,后将提取成功的DNA样品送至生工生物工程上海股份有限公司进行DNA测序。
1.9 种属鉴定
将测得的DNA序列用Contig Express软件拼接并在NCBI网站(www.ncbi.nlm.nih.gov)进行BLAST比对,以序列相似度大于或等于97%确定其属(Genus)的分类学依据。
1.10 数据分析
本研究采用SPSS 17.0软件(Chicago,IL,USA)进行统计学分析,统计检验为卡方检验(X2),以α=0.05作为检验水准。
本研究采用Simpson 指数和Jaccard系数分析菌种多样性。Simpson指数是描述生境内物种多样性的指标之一,数值越大说明生境内真菌的均衡性和丰富程度越高;Jaccard系数是比较两个集合间相似性与差异性的指标,数值越小说明两集合的差异越大[13]。
2 结果与分析
2.1 防城港海域海泥真菌组成
选取序列相似度≥97%的菌株,并将其中相似度等于100%的菌株去除,最终共得111株不同的菌株。其中有1株葫芦霉科Cucurbitariaceae真菌、3株子囊菌门Ascomycota真菌因未确定种属均不纳入本次分析比较。以属作为分析的基本单位共分析107株真菌,不同属的真菌在防城港海域海泥中的构成差异明显,其中优势菌种依次为青霉属Penicillium39株,相对丰度36.45%;其次为枝孢属Cladosporium21株,相对丰度19.63%;然后是曲霉属Aspergillus11株,相对丰度10.28%。掷孢酵母属Sporobolomyces、篮状菌属Talaromyces、Papiliotrema属各4株,相对丰度均为3.74%;棒孢酵母属Clavispora和囊担菌属Cystobasidium各3株,相对丰度均为2.80%;柄锈菌属Puccinia、红酵母属Rhodotorula和Krasilnikovozyma属各2株,相对丰度均为1.87%;附球菌属Epicoccum、拟盘多毛孢属Pestalotiopsis、假丝酵母属Candida、茎点霉属Phoma、拟青霉属Purpureocillium、球腔菌属Mycosphaerella、镰刀菌属Fusarium、孔韧菌属Porostereum、Acrodontium属、Geosmithia属、Pezizomycotina属和Roussoella属各1株,相对丰度均为0.93%。
2.2 普通培养基的分离结果
6种普通培养基的分离结果如表1所示,PA普通培养基分离种类最少,为4属;SA普通培养基中分离出的真菌种类最多,为10属;其余4种普通培养基分离效果之间没有显著差异(P>0.05)。对比酵母菌和霉菌的分离效果,6种普通培养基分离得到的酵母菌最少为3属,最多为4属,分离效果相近;而在霉菌的分离效果上,SA普通培养基分离出霉菌最多为7属,PA、CA普通培养基只分离出1属,其余3种普通培养基分离的霉菌属数相近,无显著差异(P>0.05)。
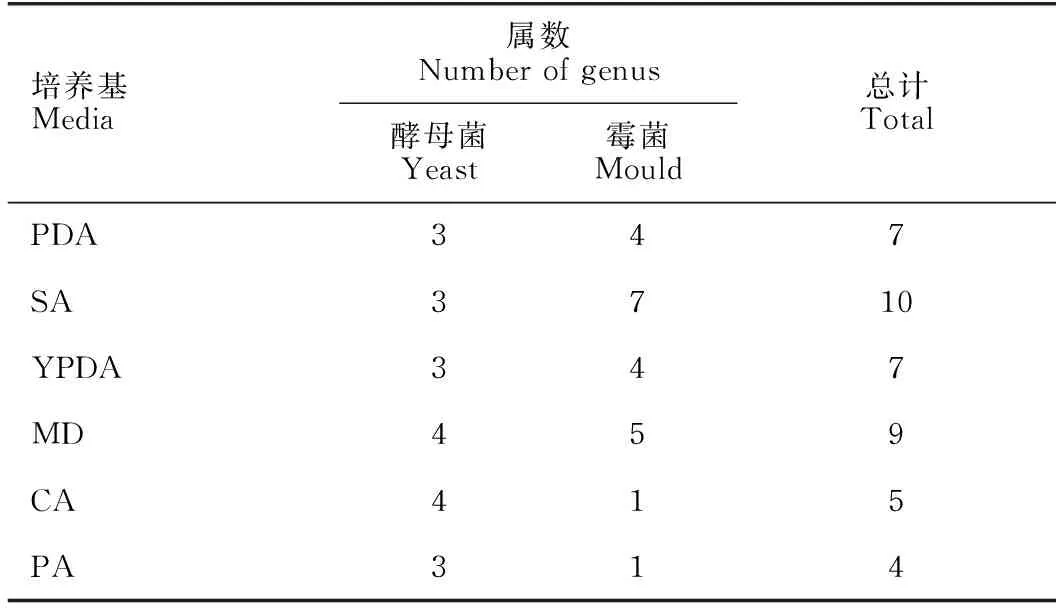
表1 从6种普通培养基中分离得到的真菌属数Table 1 Number of fungal genera isolated from six common media
6种普通培养基所分离出的真菌种数如表2所示。虽然PA普通培养基分离出的真菌属数较少,但是从中分离得到的囊担菌属Cystobasidium真菌为41株,相比于其他的普通培养基具有显著优势(P<0.05)。YPDA普通培养基对枝孢属Cladosporium真菌的分离效果较其他普通培养基具有显著优势(P<0.05)。此外,柄锈菌属Puccinia真菌只在PA、CA普通培养基分离得到,拟盘多毛孢属Pestalotiopsis真菌也只在SA、PDA普通培养基中分离得到。篮状菌属Talaromyces、球腔菌属Mycosphaerella及Geosmithia属真菌只在SA培养基中分离得到,Porostereum属真菌只在YPDA普通培养基分离得到,茎点霉属Phoma、Papiliotrema属真菌只在PDA普通培养基中分离得到,假丝酵母属Candida、Acrodontium属及Roussoella属真菌只在MD普通培养基中分离得到。说明普通培养基对这些属真菌分离的选择性较高。综上,PDA、MD和YPDA得到的酵母数和霉菌数比较均衡,结合实际应用考虑,采用PDA、MD培养基进行下一步实验。
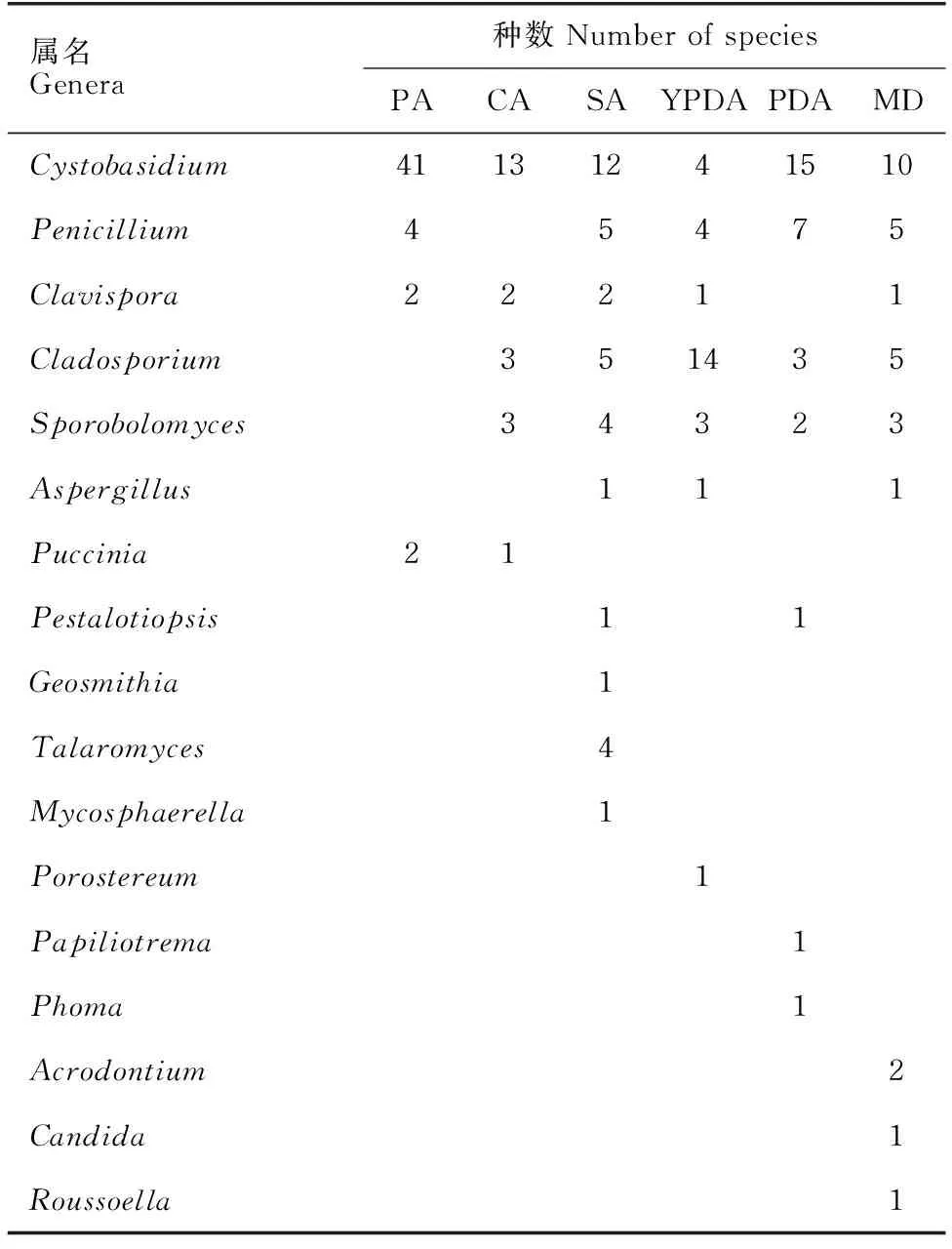
表2 从6种普通培养基分离得到的真菌种数Table 2 Number of fungi species isolated from the six common media
2.3 含不同抑制剂的优化培养基的分离结果
为了进一步探讨不同抑制剂对海洋真菌生长的影响,本研究利用含有不同抑制剂的PDA、MD优化培养基进行分离实验。从分离结果可以看出(表3),PDA优化培养基共分离得到244株霉菌,MD优化培养基共分离得到141株,株数上PDA优化培养基的分离效果明显优于MD优化培养基(P<0.05);从属数来看,PDA优化培养基共分离得到4属霉菌,而MD优化培养基共分离得到8属霉菌。在PDA优化培养基中,分离霉菌株数最多的前4位依次为含链霉素的优化培养基(63株)>含链+庆的优化培养基(57株)>含链+氯的优化培养基(46株)>含氯霉素的优化培养基(41株)。在MD优化培养基中,分离菌株数量最多的前3位依次为含链+庆的优化培养基(44株)>含链+氯的优化培养基(38株)>含氯霉素的优化培养基(21株)。含链霉素、氯霉素的PDA优化培养基分离效果显著优于分别含这两种抑制剂的MD优化培养基(P<0.05)。PDA、MD优化培养基均分离得到3属酵母菌,与2.2节的结果基本一致。
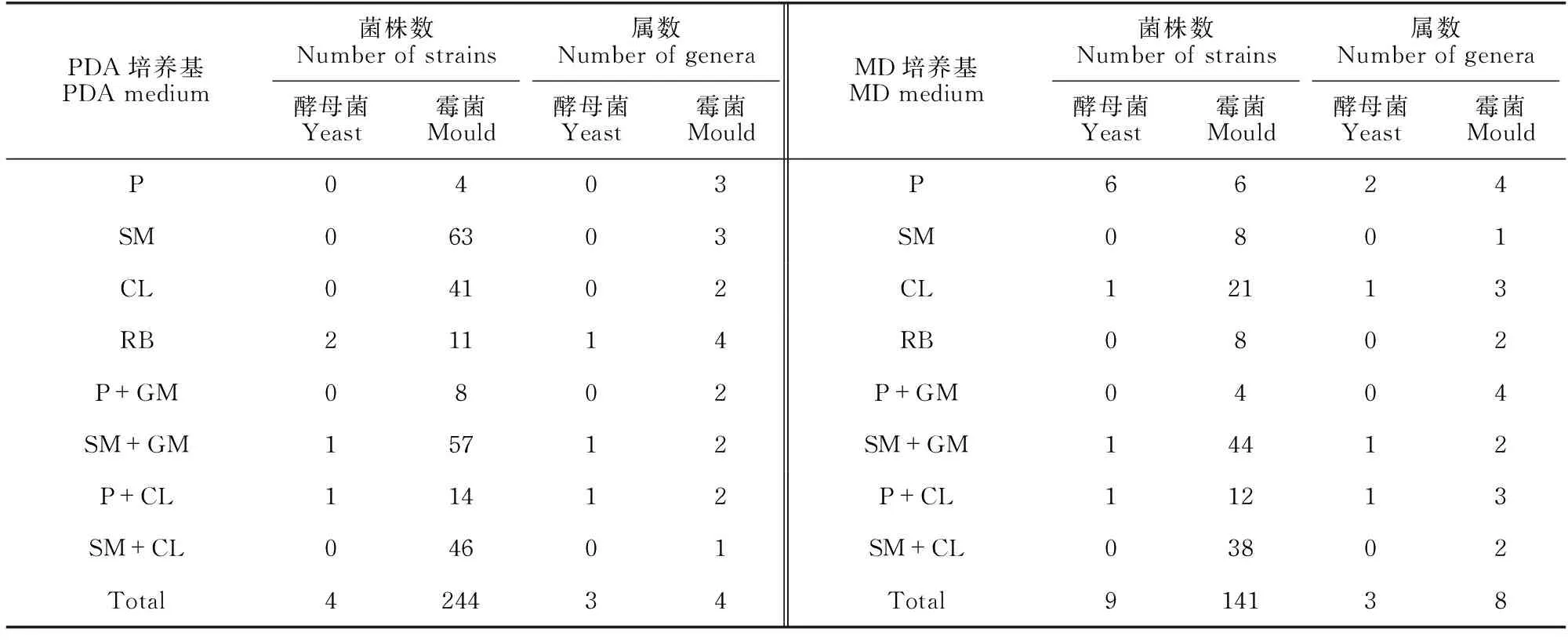
表3 优化培养基的分离结果Table 3 Separation results of optimized medium
含不同抑制剂的优化培养基分离得到的真菌种类如表4所示。其中分别含链霉素、氯霉素、链+庆、链+氯的PDA优化培养基及分别含链+庆、链+氯的MD优化培养基分离得到的真菌株数较多,这6种优化培养基的分离效果明显优于其他10种优化培养基(P<0.05)。青霉属Penicillium因为适应力较强,所有优化培养基均可分离得到;其次为枝孢菌属Cladosporium及曲霉属Aspergillus,含孟加拉红的MD优化培养基对分离枝孢菌属稍有优势,含孟加拉红的PDA优化培养基对分离曲霉属稍有优势。另外,含青+氯的MD优化培养基对分离篮状菌属Talaromyces具有显著优势(P<0.05);囊担菌属Cystobasidium、拟青霉属Purpureocillium、柄锈菌属Puccinia以及Krasilnikovozyma属只在含青霉素的MD优化培养基中分离得到;镰刀菌属Fusarium真菌只在含青+庆的MD优化培养基中分离得到;棒孢酵母属Clavispora仅在含链+庆的PDA优化培养基中分离得到;掷孢酵母属Sporobolomyces仅在含青+氯的PDA优化培养基中分离得到。
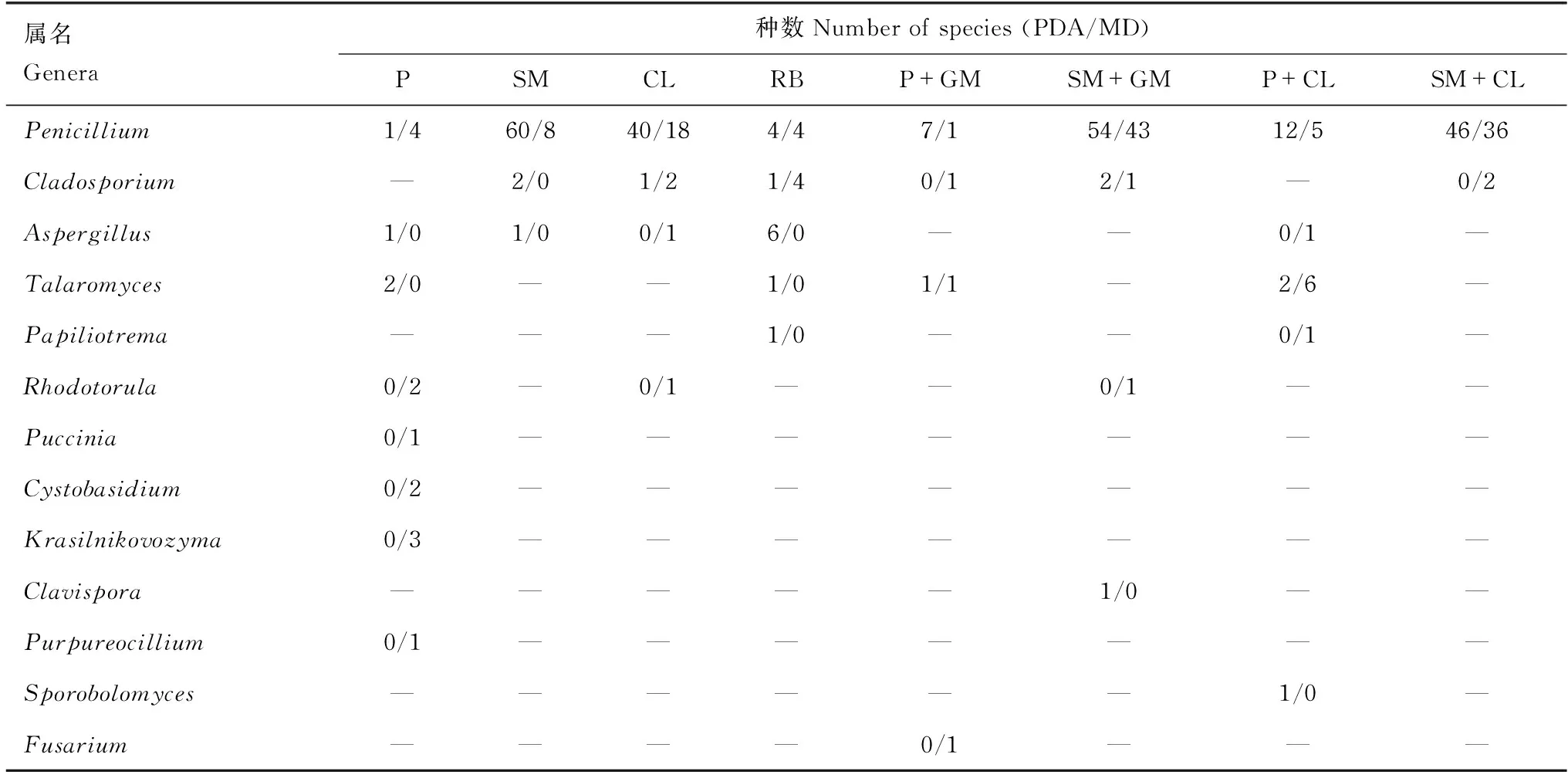
表4 优化培养基所分离得到的真菌属及种数Table 4 The genera and species number of fungi isolated from optimized medium
2.4 多样性分析
从表5中可以看出,SA、MD普通培养基具有良好的均衡性与多样性(Simpson指数>0.8),PA普通培养基的Simpson指数明显低于其他5种普通培养基,原因是PA普通培养基对真菌的选择性较高。在含不同抑制剂的优化培养基中,含青霉素、孟加拉红的PDA优化培养基以及含青霉素、青+庆、青+氯的MD优化培养基均衡性较好(Simpson指数70.6),多样性与丰富性也较高;含氯霉素、链霉素、链+庆、链+氯的PDA优化培养基与含链霉素、链+庆、链+氯的MD优化培养基Simpson 指数偏低(<0.2),说明这些优化培养基具有明显的选择性,适用于培养与分离特定种属的真菌。

表5 普通培养基及优化培养基的Simpson指数Table 5 Simpson index of common medium and optimized medium
另外,虽然MD、PDA普通培养基具有良好的均衡性和多样性,但是在加入抑制剂后,其Simpson指数均有不同程度的降低。其中,分别含青霉素、孟加拉红的PDA优化培养基及分别含青霉素、青+庆、青+氯的MD优化培养基,Simpson指数与其普通培养基相近,但分别含链霉素、氯霉素、链+庆、链+氯的PDA优化培养基,及分别含链霉素、链+庆、链+氯的MD优化培养基Simpson指数降幅较大,显示出与普通培养基截然不同的选择性。
从表6-表8可以看出,普通培养基的Jaccard系数为0.222-0.600,说明它们的分离效果相似度较低,集合内异质性较高。而优化培养基的Jaccard系数为0.111-1.000,范围跨度较大。其中,含孟加拉红的MD优化培养基与含链+氯的MD优化培养基之间Jaccard系数为1.000,说明这两种培养基的分离差异性极小。但对比表5可知,二者Simpson指数差异较大,含链+氯的MD优化培养基对青霉属真菌的选择性远高于含孟加拉的MD优化培养基。
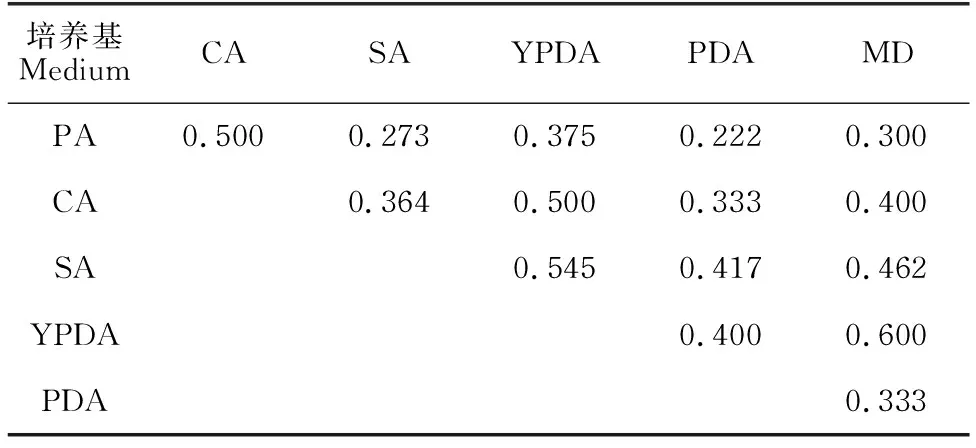
表6 普通培养基的JaccardTable 6 Jaccard index of common medium
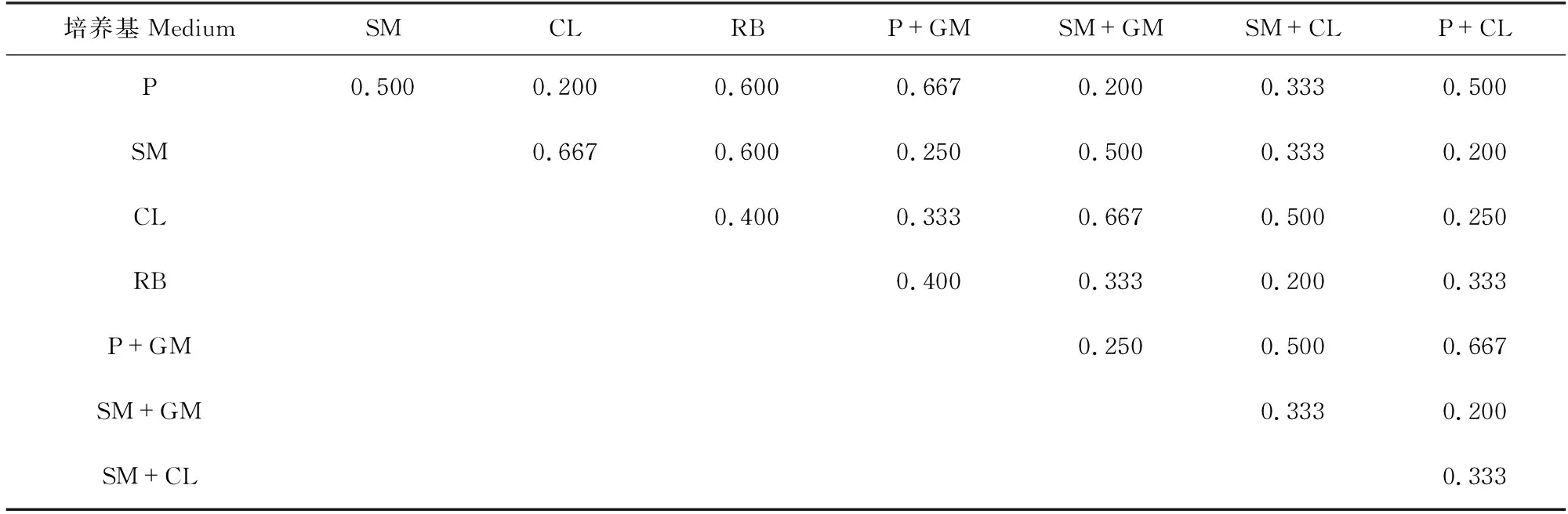
表7 PDA优化培养基的Jaccard系数Table 7 Jaccard index of optimized PDA medium
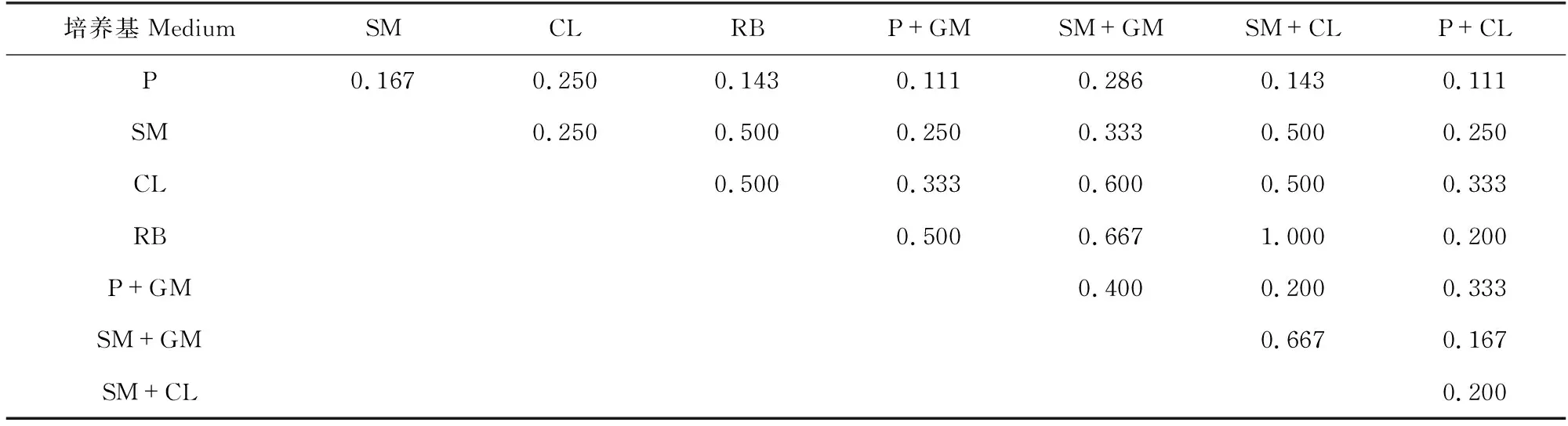
表8 MD优化培养基的Jaccard系数Table 8 Jaccard index of optimized MD medium
3 讨论
目前国内关于不同培养基和不同抑制剂对海洋微生物分离效果的研究报道尚少,不同培养基由于成分不同,对真菌分离效果的均衡性与选择性具有一定差异。目前学界普遍认为,抗生素作为抑制剂可抑制细菌生长,对真菌生长及分离一般没有显著影响。但是本研究发现,加入不同抑制剂的培养基之间及其与原培养基之间,对同一份样品的真菌分离效果相差甚远,说明选择合理的抑制剂有助于快速分离目标海洋真菌。
本研究所得优势菌属与多地已有报道的海洋真菌构成相似[14]。6种普通培养基中,SA培养基分离得到的菌株种数最多,PA普通培养基所得菌株最少,Simpson指数分析结果与这一情况相符。PA普通培养基和YPDA普通培养基对菌株的分离效果表现出明显的选择性,其余4种普通培养基的Simpson指数较为接近;其中,MD普通培养基多样性与均衡性较高,与文献[12]结果相似。但在优化培养基的实验中发现,含抑制剂的MD优化培养基Simpson指数均有所下降且程度不一,说明抑制剂在抑制细菌生长的同时可能也会对真菌的生长产生一定的抑制作用,但目前并没有明确研究表明其影响机制、程度及范围。其中,分别含青霉素、青+庆的MD优化培养基的均衡性相对较高,与MD普通培养基的Simpson指数较为接近。其余优化培养基的Simpson指数均小于0.7,而且分别含链霉素、氯霉素、链+氯的PDA优化培养基与分别含链霉素、链+庆、链+氯的MD优化培养基的Simpson指数小于0.1,结合表4可知这5种优化培养基在分离海洋真菌时对青霉属Penicillium具有较高的选择性。
6种普通培养基之间的Jaccard系数均不超过0.6,说明任意两种普通培养基分离所得的菌种组成相似度都较低。在优化培养基中,MD优化培养基分离的菌属数稍多于PDA优化培养基,但从PDA优化培养基中分离得到的菌株数量明显多于MD优化培养基,产生该数量差异的主要原因是PDA培养基对青霉属真菌具有较高的选择性,这与文献[9]的报道一致。但是PDA培养基的这种选择性在6种普通培养基的实验中并没有充分表现,而是表现出对囊担菌属Cystobasidium的高选择性,故推测优化培养基中的8种抑制剂均可能对青霉属真菌有抑制作用。优化培养基之间的Jaccard系数数值跨度均较大。其中值得注意的是,含孟加拉红的MD优化培养基与链+氯的优化MD培养基之间的Jaccard系数为1.000,是由于这两种培养基所得真菌都为青霉属Penicillium和枝孢菌属Cladosporium真菌。结合Simpson指数可以看出,含孟加拉红的MD优化培养基对这两种真菌的分离具有较好的均衡性,而含链+氯的MD优化培养基对青霉属Penicillium真菌具有较高的选择性。
本研究中除分离得到111株基因序列相似度≥97%的真菌外,还发现了9个基因序列相似度小于97%的真菌菌株,其中5个菌株相似度小于94%。通常相似度94%被认为是区分一个新种的最低界限,而相似度96.4%被认为是值得区分一个新属的界限[15],因此小于97%则无法确定这些真菌的种属,未被列入本文研究对象。这9个相似度小于97%的菌株将会在后续研究中根据形态特征和系统发育树确定其归类。
本研究分离得到青霉属真菌7种,包括托姆青霉Penicilliumthomii、橘青霉P.citrinum、草酸青霉P.oxalicum、爪哇青霉P.javanicum、产紫青霉P.purpurogenum、简青霉P.simplicissimum、菌核青霉P.sclerotiorum;枝孢菌属真菌7种,包括黄色枝孢菌Cladosporiumxanthochromaticum、狭枝孢菌C.tenuissimum、芽枝状枝孢菌C.cladosporioides、澳洲枝孢菌C.australiense、尖孢枝孢菌C.oxysporum、C.Perangustum、C.anthropophilum等,这两属真菌具有广泛的药用前景,包括抗癌[16,17]、抗菌[18]、抗氧化[19]以及合成药用活性化合物的关键前体[20,21]。本研究结果有助于建立北部湾海域真菌样品库,为后续海洋真菌代谢产物分离、结构鉴定及生物活性提供基础资料,同时也为高效地提取分离海洋真菌提供有价值的参考。

