熊去氧胆酸应答不佳的原发性胆汁性胆管炎的治疗进展
江婷婷,杨晴
(暨南大学附属珠海医院感染肝病科,广东 珠海 519000)
1 PBC 的概况
原发性胆汁性胆管炎(PBC)既往又称原发性胆汁性肝硬化,是一种针对胆管上皮细胞的自身免疫介导、以小叶间胆管非化脓性破坏性胆管炎为特征的慢性自身免疫性肝病。约50%的PBC 患者因体检发现肝生化指标异常而无明显临床症状,但多数患者会于5 年内相继出现乏力、皮肤瘙痒等症状,随着疾病进展,可能出现胆汁淤积症相关表现、肝硬化相关表现及其他自身免疫性疾病的相关表现[1]。
PBC 的诊断需要结合其临床表现、生化检查、免疫学检查、影像学检查及肝活组织病理学检查综合诊断[2],目前主要依据1998 年巴黎标准对PBC 的诊断标准[3]:①ALP>2×ULN或GGT>5×ULN;②血清AMA 或AMA M2 阳性且AMA 滴度>1:40;③肝脏组织病理学符合PBC。由于PBC 的血清学标志物特异性较强,尤其是血清抗线立体抗体(antimitochondrial antibody,AMA),超过90%的PBC 患者血清呈AMA 阳性,因此有学者建议血清AMA 阳性并且具有典型临床表现和生物化学异常的患者,可诊断为PBC 而不必行肝活组织检查。然而,仍有5%-10%AMA 的PBC 患者血清AMA 呈阴性。因此,具有PBC 典型临床表现和生物化学异常而血清AMA 阴性者,或AMA 阴性或怀疑合并有其他自身免疫性疾病或其他原因所致胆汁淤积者如自身免疫性肝炎、非酒精性脂肪性肝炎、结节病或药物诱发的胆汁淤积等。,建议行肝活组织病理学检查明确诊断。
2 PBC 的治疗现状
熊去氧胆酸(UDCA)是目前FDA 推荐的治疗PBC 的唯一一线药物。UDCA 的化学结构为3ɑ、7β-二羟基、5β 胆烷酸,是疏水性鹅去氧胆酸经肠道细菌作用后产生的7β 羟基差向异构体。正常人胆汁酸池中主要为胆酸、脱氧胆酸、鹅去氧胆酸等疏水性胆汁酸,具有肝细胞毒性。而亲水性胆汁酸熊去氧胆酸含量极少,不足胆汁酸池总量的4%。口服UDCA 在回肠吸收后经门脉系统进入肝脏,与甘氨酸、牛磺酸结合后形成甘氨酸熊去氧胆酸和可溶性牛磺熊去氧胆酸,同时,可降低胆汁酸池中含量高的疏水性鹅去氧胆酸,并促进内源性胆汁酸的排泄并抑制其吸收,达到改变胆汁酸池中亲水性/疏水性胆汁酸的比例,减少疏水性胆汁酸对肝细胞的毒性。此外,UDCA 还有抑制细胞凋亡、抑制炎症、抗氧化和免疫调节等作用[4]。指南推荐剂量为13~15 mg/kg/d,长期应用可改善肝生化指标、延缓PBC的进展、降低肝纤维化及肝硬化等并发症发生率以及延长无肝移植生存时间[5]。但仍有约1/3的PBC患者对UDCA应答欠佳[6]。
3 对UDCA 治疗后的生化应答评价标准
因存在部分患者对UDCA 治疗应答欠佳,因此在使用UDCA 治疗一定时间后,需对患者进行生化指标评价以确定疗效,研究发现,经UDCA 治疗且生化应答良好的PBC 患者与健康人的预后相似[7]。而对UDCA 应答欠佳的PBC 患者则病程进展快速,其肝移植和死亡的风险较UDCA 应答良好的患者明显增加[8]。
目前有多种用于UDCA 治疗后的生化应答的评价标准,具体见表1。其中巴黎I 标准适用于PBC 患者的风险分层,多伦多标准适用于预测PBC 患者的肝组织学进展,巴黎II 标准适用于早期PBC患者(病理学分期为I~II期)。但除了多伦多标准外,其他标准多数都是中小型单中心纵向队列回顾性研究,因此,基于多中心、大样本数据而获得的连续积分系统定性评估(UKPBC 风险评分、GLOBE 评分)更显优势,可预测未来特定时间点发生肝移植或肝脏相关死亡的风险。
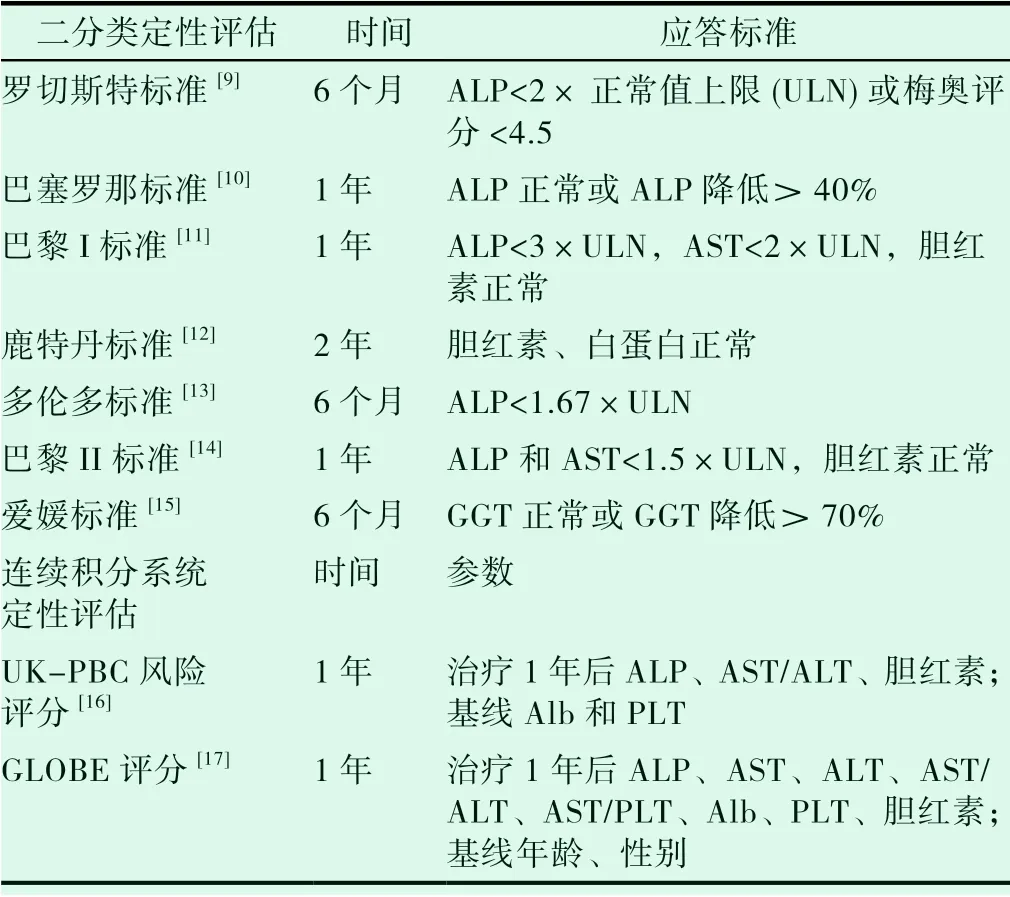
表1 PBC 对UDCA 应答的生化标准
4 UDCA 应答不佳的PBC 患者的治疗
4.1 奥贝胆酸
奥贝胆酸(obeticholic acid,OCA)又名6-乙基鹅去氧胆酸,是人初级胆汁酸鹅去氧胆酸的一种衍生物,可作为法尼醇X 受体 (farnesoid X receptor, FXR)的配体,OCA 通过激活FXR 来减少胆汁酸的合成并促进胆汁酸的转化、代谢,从而减轻PBC 胆汁淤积、改善肝生化指标和炎症指标[18],此外,OCA 还可通过调节胆汁酸的动态平衡来抑制肝星状细胞(HSC)的激活从而起到预防肝纤维化的作用,但不能抑制肝细胞凋亡。有研究发现,当OCA 与凋亡抑制剂IDN-6556 并用时,可观察到抗纤维化作用增强。因此,联合较低剂量的凋亡抑制剂和OCA 可能是一种新的肝纤维化治疗策略[19]。
OCA 作为唯一被批准的二线药物,目前已经进行了3 期临床试验,I 期试验结果未公布,Ⅱ、Ⅲ期均采用了随机双盲安慰剂对照试验的形式对UDCA 应答不佳或不能耐受UDCA 的患者使用不同剂量的OCA 治疗一定时间后的肝生化指标的下降进行对比。Ⅱ期临床试验[10]将患者随机分配到安慰剂组和OCA(10mg/d、25mg/d、50mg/d)组中,同时患者在整个研究中维持其现有剂量的UDCA,试验时间为3 个月,结果显示:OCA 各组ALP、GGT、ALT 水平均较安慰剂组显著降低。Ⅲ期临床试验[20]将患者随机分配到安慰剂组和OCA(10mg/d,5~10mg/d)组中,其中约93%的患者仍维持其现有剂量的UDCA 作为基本治疗。试验时间为12 个月,试验终点目标为:ALP<1.67×ULN 或ALP 降低至少15%,同时TBil 在正常范围内。结果显示:OCA组达到终点的患者百分比均显著高于安慰剂组,分别为10 mg组(47%)、5~10 mg 组(46%)和 安 慰 剂 组(10%)。OCA 作 为 对UDCA 应答不佳或对UDCA 不耐受的PBC 患者的治疗已经纳入指南[21]中,OCA 联合UDCA 可用于对UDCA 应答不佳或对UDCA 不耐受的PBC 患者,其初始剂量为5mg,根据患者耐受性在6 个月内剂量滴定至10mg。
综上,OCA 为对UDCA 应答不佳的PBC 患者提供了新的治疗方案。但OCA 治疗过程中出现的呈剂量依赖性瘙痒限制了部分患者的使用。此外,一项在可模仿人类血脂异常的金叙利亚仓鼠的研究中发现,OCA 可使仓鼠的高密度脂蛋白下降、胆固醇总量上升和低密度脂蛋白胆固醇上升[22]。但OCA 治疗的患者是否也可能出现相似的血脂异常并产生长期心血管风险尚未可知。同时,OCA 的长期疗效及安全性尚需更多长期随机、双盲、多中心对照试验和前瞻性随访试验加以验证。
4.2 贝特类药物
贝特类药物属于苯氧芳酸类衍生物,是一类人工合成的过氧化物酶体增殖物激活受体(PPAR)的配体,包括吉非贝齐、苯扎贝特、非诺贝特、环丙贝特等,其中治疗PBC 的主要药物为苯扎贝特和非诺贝特。
贝特类药物可通过激活PPAR 对胆汁酸的合成、摄取及代谢过程进行调控,从而减少胆汁淤积。贝特类药物激活PPAR、孕烷X 受体(PXR)还可通过抗氧化应激、调节肝星状细胞(HSC)及血管张力,而发挥抗肝纤维化作用。同时,PPARα 和PPARγ配体是重要的免疫调节介质,可通过抑制单核/巨噬细胞、CD4+T 淋巴细胞,调节炎症基因来抑制炎症反应。此外,贝特类药物可能通过介导NF-κB 信号通路及上调C 末端调节蛋白来阻断AKT 信号通路,进而对肿瘤细胞具有抗增殖、促凋作用[23]。国内外多项研究均表明在UDCA 应答不佳的PBC 患者中UDCA 联合贝特类药物可明显改善患者ALT、ALP、GGT、TG、IgM 和胆固醇,且不良事件发生率与UDCA 单药治疗无明显增加[24]。Weijia D[25]等进行的一项回顾性队列研究中,将患者分为肝硬化组与非肝硬化组,结果显示非诺贝特联合治疗对两组患者的ALT、ALP、GGT、TG、IgM 和胆固醇均明显改善,且两组间的不良事件总发生率无明显差异,但有发生潜在肝损伤和肾毒性的可能。而在Christophe C[26]的一项双盲、安慰剂对照试验中发现:苯扎贝特组的肌痛发生率(20%)和血清肌酐水平均较安慰剂组升高。
综上,贝特类药物与UDCA 联合治疗在改善肝生化指标方面更具优势。近年来许多研究报道了贝特类药物还具有提高患者生存率,降低患者的GLOBE 评分、肝脏相关事件发生率及病死率的作用[27]。但需警惕治疗过程中发生肌痛、潜在肝毒性及肾毒性等可能。此外,目前相关试验的研究人群多为非肝硬化的PBC 患者,非肝硬化人群较少,贝特类药物在肝硬化患者中应用的安全性及长期疗效还需更对的长期的大样本随机对照试验进行验证。
4.3 免疫调节及免疫抑制剂
PBC 是一种自身免疫性疾病,但具体病因和发病机制至今尚不完全清楚。但PBC 患者中常见多种自身抗体、免疫球蛋白M(IgM)呈高滴度表达,患者的肝脏组织中可见B 细胞浸润、大量自然杀伤(NK)细胞,同时,受损胆管周围存在CD56+NK 细胞及单核浸润,以及大量致病性CD4+T 细胞和CD8+T 细胞。因此,目前认为免疫失衡可能是其发病机制之一[28]。
既往有研究曾使用免疫抑制剂如硫唑嘌呤、甲氨蝶呤、环孢素、利度胺,秋水仙碱、沙霉酚酸酯等与UDCA 联合治疗PBC,但效果欠佳,患者的生化指标、组织学进展及总体生存率并未得到明显改善,甚至有发生严重不良事件的风险[29]。
布地奈德是一种强效的合成糖皮质激素,同时是糖皮质激素受体/孕烷X 受体(PXR)激动剂,参与胆汁酸的合成、转运和代谢。有研究表明布地奈德与UDCA 联合使用能够改善肝组织学和生化,是潜在的PBC 二线治疗药物之一。因布地奈德在健康人肝脏中有90%的首过效应,因此全身副作用较泼尼松明显减少[30],但长期使用仍有发生糖皮质激素相关副作用的风险,尤其是骨质疏松风险。同时由于其药效动力学特点,晚期PBC 患者中布地奈德的血浆药物浓度水平增加会导致不良反应加重,因此不推荐组织学分期IV 期PBC 患者使用布地奈德联合治疗[21],其安全性仍有待验证。
4.4 生物治疗
目前抗CD-20(利妥昔单抗)等新型的生物制剂已广泛应用于多种自身免疫性疾病的治疗中,如类风湿性关节炎、系统性红斑狼疮及自身免疫溶血性贫血等。利妥昔单抗是一种与CD20 抗原结合的单克隆抗体,能依赖补体和抗体介导的细胞毒作用,消耗B 淋巴细胞,减少自身抗体分泌,从而抑制免疫反应。多项研究发现,利妥昔单抗对抑制PBC 患者免疫反应,降低血清IgG、AMA 等自身抗体及ALP 水平,但对改善PBC 患者乏力症状无显著效果[31]。关于生物制剂是否可广泛用于治疗PBC 患者,目前相关研究有限,仍需大样本随机双盲对照研究验证其疗效级安全性。
4.5 间充质干细胞移植
间充质干细胞(MSC)移植亦被认为是自身免疫性肝病的潜在治疗手段,国内已针对其开展相关临床研究。王立等[32]对10 例UDCA 应答不佳的PBC 患者进行BM-MSC 移植治疗,结果发现,异基因BM-MSC 移植的安全性好,可降低转氨酶等生化指标,改善患者生活质量,但对肝脏病理无明显改善。其机制可能通过下调PBC 患者外周血CD8~+T 细胞,上调CD4~+CD25~+Foxp3~+T 细胞和升高外周血IL-10 浓度来实现对PBC 患者的体内免疫调节作用。
5 小结
近年来大量关于UDCA 应答不佳PBC 的药物研究不断涌现。奥贝胆酸已被指南推荐作为二线药物治疗对UDCA 应答不佳的PBC 患者。而贝特类药物或布地奈德联合UDCA 治疗的相关研究证实对降低患者血清IgG、AMA 等自身抗体及ALT、ALP 水平等有明显作用,并且能在一定程度上改善患者的预后,可能成为UDCA 应答欠佳PBC 长期治疗的选择之一,但其长期疗效及安全性仍需更多的大样本随机对照试验来验证。同时,关于生物制剂、抗逆转录病毒药物、改变胆汁酸生成或重吸收药物如TGR5 激动剂、FGF-19 及间充质干细胞移植等治疗的研究亦显示出对UDCA 应答欠佳PBC 治疗的有效性,有望成为UDCA 应答欠佳PBC 治疗的新方法。肝移植仍然是延长终末期 PBC 患者寿命的唯一治疗方法。

