功能型助手在腹腔镜胃癌根治术中的作用
姜华基,党胜春,崔 磊,冯 乐,杜玉玉,瞿建国
(江苏大学附属医院胃肠外科,江苏 镇江,212001)
自1994年Kitano等[1]报道首例腹腔镜胃癌切除术以来,腹腔镜技术经过二十余年的发展,因其具有微创、术后疼痛轻、肠道功能恢复快、住院时间短及对免疫功能影响小等特点[2-4],在胃癌根治术中起到了举足轻重的作用。腹腔镜胃癌根治术解剖层次复杂多变,淋巴结清扫范围广,除经验丰富的主刀外,一位合格的助手也十分关键[5]。支架型助手仅进行术野的暴露工作,而功能型助手还需协助主刀完成胃周的组织分离、寻找正确的解剖层次,积极参与甚至引导整个手术进程[6]。本研究回顾分析2017年1月至2019年12月我科收治的122例原发性胃癌患者的临床资料,探究功能型助手在腹腔镜胃癌根治术中的作用。
1 资料与方法
1.1 临床资料 2017年1月至2019年12月我科为122例胃癌患者施行了腹腔镜辅助胃癌根治术(全胃切除,食管-空肠Roux-en-Y吻合术),其中男78例,女44例,35~85岁。原发灶位于贲门及胃底58例,胃体43例,胃窦21例。均按日本《胃癌治疗指南》进行标准胃癌D2根治术[7]。手术主刀均为同一位经验丰富的主任医师,根据助手类型进行分组,分为功能型助手组(研究组)与支架型助手组(对照组)。纳入标准:(1)术前胃镜病理证实为原发性胃癌,术前CT评估无局部组织器官侵犯或远处转移;(2)行腹腔镜辅助D2全胃切除术,术后病理证实R0切除;(3)术前准备完善。排除标准:(1)术前行放、化疗;(2)胃癌侵及邻近组织行扩大根治或联合脏器切除;(3)术后病理证实非R0切除;(4)术前心、肺、肝、肾等重要器官或系统功能不全;(5)一般情况差,不能耐受手术。两组患者一般资料差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料的比较
1.2 术前准备及Trocar位置 采用全身麻醉气管插管,患者取平卧位,两腿自然分开。术者立于患者左侧,扶镜手立于患者两腿之间,助手立于患者右侧。采用常规弧形五孔Trocar布局[9],建立气腹,压力维持在12~15 mmHg。经观察孔置入腹腔镜,常规探查肝脏、腹腔及网膜有无明显转移,初步明确肿瘤位置及临床分期。
1.3 手术方法 功能型助手组:手术按区域化进行。(1)胃体大弯区:助手左手持肠钳将分离好的大网膜呈“扇形”向头侧掀起,右手持无损抓钳钳夹胃结肠韧带向上牵引。主刀左手持肠钳向下牵拉横结肠,右手持超声刀自横结肠无血管区进入小网膜囊,游离横结肠上缘至结肠脾区,进一步离断胃网膜左动静脉、脾胃韧带及胃短血管,清扫第4组淋巴结(图1)。(2)胃窦幽门区:将大网膜向头侧掀起,助手左手持肠钳钳夹胃窦部组织向上提起,右手持无损抓钳以协助细腻操作。主刀左手持肠钳向下牵拉横结肠,右手持超声刀分离胃结肠韧带,沿结肠中动脉及其分支走向,寻找肠系膜上静脉,清扫第14v组淋巴结。于根部夹闭离断胃网膜右动静脉,清扫第6组淋巴结(图2)。(3)胰体上缘区:将大网膜转移至头侧,助手左手持肠钳钳夹胃胰皱襞,逆时针旋转肠钳将胃大弯向头侧翻转,右手持无损抓钳顶起胃窦。主刀左手持肠钳压迫胰腺隆起,右手持超声刀沿胰腺上缘进入胃胰皱襞,依次显露腹腔动脉干、胃左动静脉、脾动脉、肝总动脉,清扫第11p、7、8a、9组淋巴结(图3)。(4)胰头上缘区:助手左手持肠钳钳夹胃体翻转至头侧,右手持无损抓钳顶起胃窦部。主刀左手持肠钳压迫胰腺凸起,右手持超声刀沿胰前间隙向头侧分离,游离胃十二指肠动脉,裸化肝总动脉及其分支,解剖肝十二指肠韧带,清扫第5、8a、12a组淋巴结(图4)。(5)肝胃之间区:助手左手持肠钳挑起肝左叶,右手持无损抓钳协助维持组织局部张力。主刀左手持胃钳钳夹胃壁向下拉,右手持超声刀裸化胃小弯,清扫第1、3组淋巴结(图5)。(6)脾门区:具体参照“黄氏三步法”[10]保脾脾门淋巴结清扫术。充分游离食管下段,清扫第2组淋巴结,切断迷走神经干(图6)。取上腹正中切口用保护套保护,将游离的标本提出腹腔,完成全胃切除及消化道重建(食管-空肠Roux-en-Y吻合)。支架型助手组:手术步骤基本同上,但术中助手以术者思路为导向,以支架暴露为核心工作。
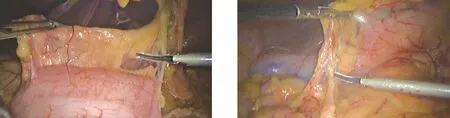
图1 助手暴露胃体大弯区 图2 助手暴露胃窦幽门区
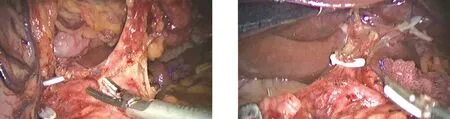
图3 助手暴露胰体上缘区 图4 助手暴露胰头上缘区

图5 助手暴露肝胃之间区 图6 助手暴露脾门区
1.4 观察指标 (1)术中指标:手术时间、淋巴结清扫数量、术中出血量、切口长度。(2)术后指标:首次排气时间、进食流质时间、引流管拔除时间、术后住院时间,同时观察吻合口相关并发症及其他并发症发生情况。

2 结 果
2.1 两组患者术中情况的比较 122例手术均获成功,无中转开腹及手术相关死亡病例。研究组较对照组手术时间短(P<0.001),淋巴结清扫数量多(P=0.001),术中出血量少(P<0.001),切口长度短(P<0.001),见表2。
2.2 两组患者术后情况的比较 研究组术后进食流质时间早于对照组(P<0.05);两组首次排气时间、引流管拔除时间、术后住院时间差异无统计学意义(P>0.05),见表2。两组术后吻合口并发症(吻合口漏、吻合口狭窄、吻合口出血)及其他并发症发生率差异无统计学意义(P>0.05),见表3。其中对照组术后1例发生吻合口狭窄,1例发生淋巴瘘,1例发生不完全性小肠梗阻;研究组术后发生1例切口感染。吻合口狭窄经消炎、消肿对症治疗后好转出院。淋巴瘘经肠外营养、限制脂肪摄入对症处理后好转出院。不完全性小肠梗阻经用生长抑素、抗炎、营养支持等保守治疗后治愈出院。切口感染经积极对症处理后好转出院。围手术期均无死亡病例。

表2 两组患者术中相关指标的比较
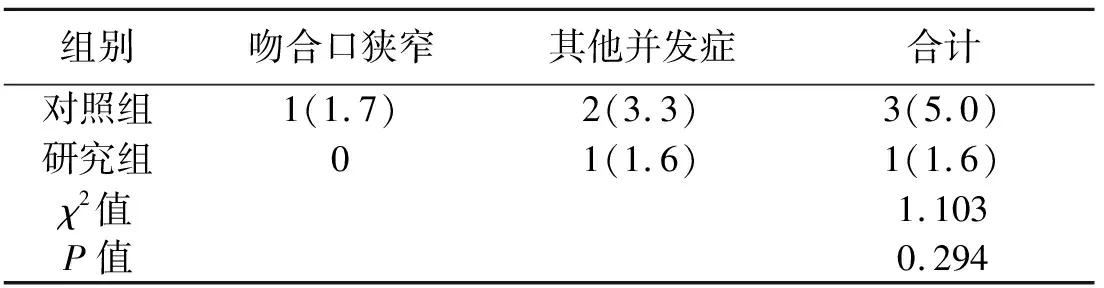
表3 两组患者术后并发症的比较[n(%)]
3 讨 论
胃癌在我国恶性肿瘤中发病率与病死率均高居前三位,目前根治性手术仍是最有效的治疗手段[11-12]。手术尤其腹腔镜手术的成功离不开一个优秀团队的配合,主刀是团队的灵魂,但功能型助手可使主刀操作事半功倍。一名优秀的助手应熟练掌握胃周血管及筋膜解剖,熟知主刀的手术思路及习惯,与主刀配合默契形成良好的化学反应。
保证胃癌原发灶完整切除,彻底清扫胃周淋巴结是胃癌根治术的基本要求[13]。相关Meta分析显示,术中淋巴结清扫数量与胃癌预后成正相关[14]。孙益红等[15]认为,胃癌根治术清扫质量控制应以25枚为标准,16枚淋巴结仅适于早期胃癌D1手术。在胃周组织的游离及淋巴结清扫过程中,操作空间相对狭小,视野较为局限,导致手术暴露的困难较大。因此,第一助手熟练掌握腹腔镜操作技巧,熟悉手术的每一个步骤,并且与术者密切配合十分重要。本研究结果显示,功能型助手组淋巴结清扫更为彻底(P=0.001),并且送检标本淋巴结检出均不少于25枚。此外,功能型助手参与手术可加快手术进程(P<0.001),减少术中出血量(P<0.001),即使有出血也能高效而精准地止血。功能型助手还能更好地配合主刀完成腹腔镜下胃周组织的游离,全胃离断及消化道重建所需的切口长度短于支架型助手组(P<0.001)。功能型助手组首次进食流质时间早于支架型助手组(P<0.05),术后患者胃肠道功能恢复快,与手术轻柔的操作及效率的提高密不可分[16-17]。
对于功能型助手的配合技巧,我们体会:(1)合理布置Trocar位置:Trocar位置与牵拉暴露的位置、角度密切相关,助手应随患者情况改变布局。对于胸廓较宽或腹型肥胖患者,助手右手Trocar位置应稍向左上调整,以便更好地协助主刀完成脾门区的操作。(2)形成较好的局部张力:助手可手持短系膜钳采用拉、挑、顶等手法与术者所持器械牵拉组织产生对抗,从而形成操作部位的局部张力。助手在手术暴露过程中将相应的组织形成完整的“平面”而不是孤立的“点”,这有助于术者进入正确的手术层面。当然,在形成张力的过程中应张弛有度,以免因牵拉过度致使组织、血管表面撕裂出血或损伤周围淋巴结导致潜在的肿瘤播散。(3)减少暴露过程中器械的移动:助手在暴露途中充分利用钳夹一处部位能提高手术效率,而反复移动器械钳夹、暴露则会中断术者的手术思路及操作流畅性,从而导致手术时间延长。如在暴露过程中牵引张力不够,可逆时针旋转肠钳,以提高组织张力,这样便可钳夹一个部位完成尽可能多的手术操作。(4)灵活使用吸引器:术中助手应熟练、高效地使用吸引器,及时吸走术中产生的气雾,以保持手术视野的清晰。此外吸引器亦可采用挑、拨等方式实现牵拉暴露、钝性分离,以协助术者进行游离、清扫。(5)主动参与术中止血:手术过程难免遇到出血,此时常规操作是左手继续完成术野暴露,右手持吸引器采取小流量、间断吸引以暴露出血部位,以免吸力过大导致气腹压力降低。必要时右手持分离钳钳夹纱条清洁创面,以协助主刀精准有效止血[18]。当然,因患者存在个体差异,为使手术流畅、高效地进行,助手的工作不是“墨守成规”而是“因地制宜”。既往研究及Meta分析结果提示,培养一个成熟腹腔镜胃癌手术团队,主刀及手术团队需独立完成40~60例完整腹腔镜辅助远端胃癌手术才能度过学习曲线,使手术思路及操作趋于成熟[19]。在克服学习曲线的过程中,助手是这个团队至关重要的一环。学习曲线便是一个支架型助手向功能型助手转变的过程,这个艰难的历程需要整个团队去实践-总结-再实践-再总结,使团队整体水平更上一层楼。
综上所述,腹腔镜辅助胃癌根治术(全胃切除,食管-空肠Roux-en-Y吻合术)中功能型助手参与手术的效果明显优于支架型助手,术中相关指标的对比尤为突出。虽然助手的成长需要一定的学习过程,但只要采取流程化的手术配合、与主刀保持一致的手术思维,假以时日定能成为一名优秀的功能型助手,为日后成长为一名出色的主刀奠定基础。

