植物天然产物抑制细菌脲酶活性的研究进展
张震宇 赵圣国 郑 楠 王加启*
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.中国农业科学院北京畜牧兽医研究所,农业部奶及奶制品质量安全控制重点实验室,北京100193)
近年来,动物饲粮中抗生素的滥用引起的生物耐药性问题及人工合成化合物在动物及动物产品中应用所引起的生物毒性与安全问题已引起人们的广泛关注。植物提取物中获得的天然产物化合物在动物生产中的应用越来越受重视。随着分离提纯技术的高速发展,从植物提取物中分离的天然产物化合物越来越多,应用潜力巨大。
在反刍动物饲粮中添加尿素等非蛋白氮可替代约30%的蛋白质饲料,为其提供生长和生产所必须的氮源。按照豆粕氮含量6.7%、尿素氮含量46.7%计算,每年反刍动物生产中利用尿素100万t,可替代700万t豆粕所提供的氮源[1]。但是,瘤胃中产脲酶菌产生的脲酶催化尿素水解生成氨的速率过快,以致尿素氮不能被有效利用。因此,需应用尿素缓释技术以提高反刍动物对非蛋白氮的利用效率[2]。
细菌脲酶(EC 3.5.1.5)由结构蛋白UreABC构成,而辅助蛋白UreD/UreH、UreE、UreF以及UreG等主要参与细菌脲酶结构蛋白的组装和活化过程。细菌脲酶活性中心通常位于结构蛋白UreC[3-4]。脲酶抑制剂通过与细菌脲酶活性中心结合,能同时降低反刍动物内源尿素与外源尿素的分解速度。此外,脲酶抑制剂还具有高效、易添加、易制备的特点。目前,在反刍动物生产中应用较广的脲酶抑制剂为乙酰氧肟酸,但其在瘤胃内易被微生物降解,限制了乙酰氧肟酸作为脲酶抑制剂在尿素缓释方面的应用。特别是大剂量使用乙酰氧肟酸对动物还有着严重的副作用,能够引起皮肤病、神经及血液学方面的疾病[5],进一步限制了乙酰氧肟酸作为脲酶抑制剂的使用。因此,亟需开发生物毒性低、稳定性强的脲酶抑制剂,而天然产物化合物具有结构多样性大、生物毒性低以及安全性高等特点,近年来已大量应用于脲酶抑制剂的开发及研究中。从这些研究中获得的大量具有脲酶抑制生物活性的化合物骨架结构,对于开发新型脲酶抑制剂具有重要意义。本文分类综述了具有脲酶抑制活性的植物天然产物,探讨了不同类型的天然产物脲酶抑制剂的构效关系与抑制模式,旨在为开发新型脲酶抑制剂提供参考。
1 近年来公开报道的植物天然产物化合物
近年来公开报道的对研发新型脲酶抑制剂具有参考作用的植物天然产物化合物见表1。表1对具有脲酶抑制作用的植物天然产物化合物进行了分类,并列举了不同研究中植物天然产物化合物对脲酶的抑制活性——半抑制浓度(IC50)值、抑制类型、构效关系以及植物来源。表1中构效关系一栏中所列举的化学结构,为含有这些化学结构的一类化合物中对于其脲酶抑制活性至关重要的化学结构,通过化学修饰取代该结构能改变此类化合物的脲酶抑制活性。
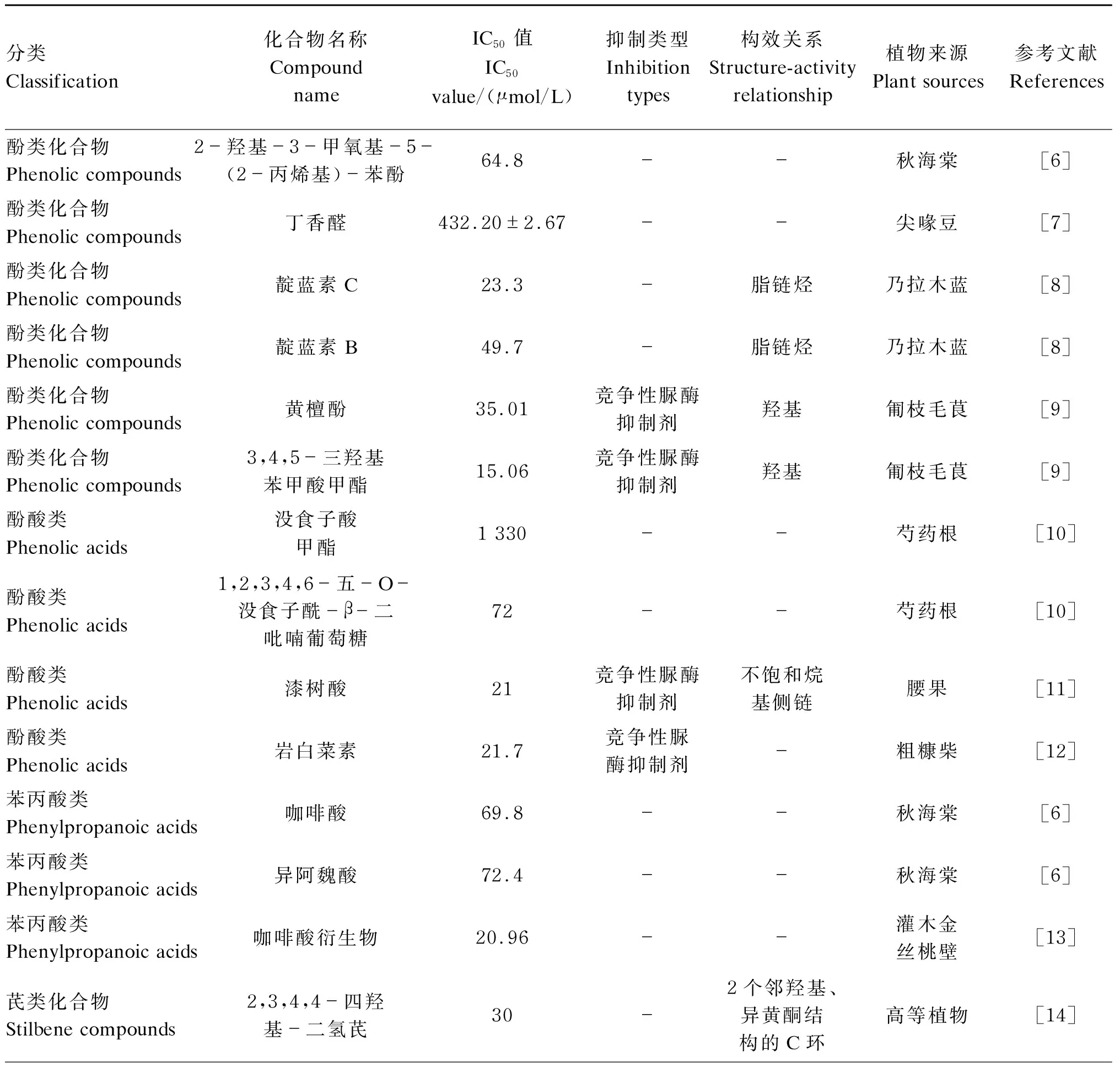
表1 植物天然产物中脲酶抑制剂的分类

续表1分类Classification化合物名称Compound nameIC50值IC50value/(μmol/L)抑制类型Inhibition types构效关系Structure-activity relationship植物来源Plant sources参考文献References芪类化合物Stilbene compounds白藜芦醇-非竞争性脲酶抑制剂-葡萄[15]儿茶素Catechins没食子酸酯2.2 竞争性脲酶抑制剂B环的5'位羟基绿茶[16]儿茶素Catechins没食子儿茶素没食子酸酯9.8 竞争性脲酶抑制剂B环的5'位羟基绿茶[16]儿茶素Catechins没食子儿茶素8.7 竞争性脲酶抑制剂B环的5'位羟基绿茶[16]儿茶素Catechins表没食子儿茶素19.6 竞争性脲酶抑制剂B环的5'位羟基绿茶[16]黄酮类化合物Flavonoids槲皮素80 -3'-羟基、4'-羟基以及3',4'-二羟基番石榴[17-18]黄酮类化合物Flavonoids3'-甲基槲皮素76 --秋海棠[6]黄酮类化合物Flavonoids杨梅素77.2 --金银花[18]黄酮类化合物Flavonoids木犀草素35.5 --金银花[18]黄酮类化合物Flavonoids鹰嘴豆素A320 ---[19]黄酮O-糖苷类化合物Flavones O-glycosides槲皮素-4-O-0-β-D-吡喃葡萄糖苷190 -3-羟基洋葱[17]黄酮O-糖苷类化合物Flavones O-glycosides黄酮类葡萄糖醛酸苷270 非竞争性脲酶抑制剂-黄芩[20]黄酮O-糖苷类化合物Flavones O-glycosides黄芩素1 350 非竞争性抑制剂-灯盏花[21]黄酮O-糖苷类化合物Flavones O-glycosides黄芩苷820 非竞争性抑制剂-黄芩[22]黄酮C-糖苷Flavones C-glycosides牡荆素35 -糖基非洲菊[23]黄酮C-糖苷Flavones C-glycosides荭草素28 -糖基非洲菊[23]黄酮C-糖苷Flavones C-glycosides异日本獐牙菜素38 -糖基非洲菊[23]黄酮C-糖苷Flavones C-glycosides异当药黄素43 -糖基非洲菊[23]黄酮C-糖苷Flavones C-glycosides5,7-二羟基-40-甲氧基黄烷酮15.8 非竞争性抑制剂-三叶枳[24]单萜类化合物Terpenoids维能酮227.6 --秋海棠[25]二萜类化合物Diterpenoid compounds3,7,15-三-O-乙酰基-5-O-烟酰胺基-13,14-二羟基肉豆蔻素81.9 --大戟属[26]

续表1分类Classification化合物名称Compound nameIC50值IC50value/(μmol/L)抑制类型Inhibition types构效关系Structure-activity relationship植物来源Plant sources参考文献References三萜类化合物Triterpenoids芦丁醇24.2 --鸡蛋花[27]三萜类化合物Triterpenoids红杨酸58.9 --鸡蛋花[27]三萜类化合物Triterpenoids山梨素A85.2 --花楸属植物[28]三萜类化合物Triterpenoids山梨素B17.8 --花楸属植物[28]三萜类化合物Triterpenoids人参皂甙A500(抑制87%)-硫酸酯驼蹄瓣[29]生物碱类化合物Alkaloids3-羟乙基葡萄球菌素25.6 -羟基/羰基板蓝根[30]生物碱类化合物Alkaloids表红葡萄球菌素37.0 -羟基/羰基板蓝根[30]生物碱类化合物Alkaloids小檗碱7.135×103 --黄连[31]生物碱类化合物Alkaloids表小檗碱3.00±0.01 反竞争性抑制剂-黄连[32]醌类Quinones2-(β-D-二吡喃葡萄糖氧基)-1,4-萘醌62 散沫花[33]醌类Quinones3-甲氧基黄檀酮169 竞争性抑制剂-紫罗兰[34]鞘脂类化合物Sphingolipids红藻糖苷45.7 --红杨[27]鞘脂类化合物Sphingolipids邻苯二甲酰胺A23.1 -糖基(葡萄糖)结构蛇床子[35]鞘脂类化合物Sphingolipids邻苯二甲酰胺12.6 -糖基(葡萄糖)结构蛇床子[35]含硫化合物Sulfur compounds伊贝林178.8 --西兰花[36]含硫化合物Sulfur compounds萝卜硫素190.5 --西兰花[36]含硫化合物Sulfur compounds大蒜素21.8 --大蒜[37]
2 酚类化合物
酚类化合物是植物的莽草酸、戊糖磷酸和苯丙醇代谢通路中重要的代谢产物,其化学结构中苯环上的氢原子被羟基取代,为芳烃的含羟基衍生物,具有广泛的生理活性,是脲酶抑制剂的重要来源之一。Ahmad等[6]从草药植物秋海棠(Vernoniacinerascens)中分离出2-羟基-3-甲氧基-5-(2-丙烯基)-苯酚,该化合物对刀豆脲酶的IC50值为64.8 μmol/L。Ramsay等[7]报道了从尖喙豆(Stereospermumacuminatissimum)茎皮中分离得到丁香醛。该化合物对脲酶抑制IC50值为(432.20±2.67) μmol/L。丁香醛类化合物已广泛应用于肠道损伤防护药物的开发,且其同时具备微摩尔级的脲酶抑制作用,具有一定的作为脲酶抑制剂的开发潜力。
Tariq等[8]从乃拉木蓝(Indigoferagerardiana)中分离得到了间苯三酚类化合物靛蓝素C及其他2个衍生化合物,分别为靛蓝素A、靛蓝素B。靛蓝素B和靛蓝素C均具有较好的刀豆脲酶抑制活性,IC50值分别为23.3和49.7 μmol/L,均为竞争性脲酶抑制剂。而靛蓝素A虽然与其他2个化合物结构相似,但却不具备脲酶抑制活性。构效关系(SAR)研究表明,脂链烃对该类化合物的脲酶抑制活性起关键作用。靛蓝素A与靛蓝素C相比,其化学结构中的脂链烃多了1个碳原子,导致其不具备脲酶抑制活性。
Khan等[9]从匍枝毛茛(Ranunculusrepens)根的氯仿和乙酰乙酸提取物中纯化分离了3,4,5-三羟基苯甲酸甲酯及黄檀酚。二者均具有很强的刀豆脲酶和巴氏杆菌脲酶抑制活性,其中黄檀酚对于这2种脲酶的IC50值分别为35.01和25.63 μmol/L,而3,4,5-三羟基苯甲酸甲酯对这2种脲酶的IC50值分别为31.75和22.51 μmol/L(参比脲酶抑制剂硫脲对这2种脲酶的抑制IC50值分别为15.06和21.00 μmol/L),2种化合物为竞争性脲酶抑制剂。SAR研究表明,羟基能与脲酶活性位点中的镍结合而抑制脲酶活性,黄檀酚化学结构中羟基的数量只有1个,3,4,5-三羟基苯甲酸甲酯化学结构中含有3个游离的羟基,而该报道中另一化学结构相似的化合物R(+)-4-甲氧基黄檀酮因不含羟基而脲酶抑制活性最低(对刀豆脲酶和巴氏杆菌脲酶的IC50值分别为67.33和59.72 μmol/L),3个化合物对脲酶的抑制效果与羟基的数量相关,表明羟基对该类化合物脲酶抑制活性非常重要。
2.1 酚酸类
酚酸类化合物的苯环结构上有多个酚羟基取代,是一种芳香羧酸类化合物。酚酸类化合物很少以游离形式存在,主要在中草药中以糖、酯及有机酸的形式存在。在抗氧化、抗菌消炎、降血脂等方面有很强的生物活性,但由于分子中存在大量的酚酸基取代,结构不稳定。高温、光照、酶、环境酸碱程度均能影响该类化合物的结构,使其失去生物活性。今后,开发此类化合物用作脲酶抑制剂的研究重点为:在提取和纯化的过程中保证化合物的活性,并在保留生物活性的基础上改善化合物的稳定性。
Ngan等[10]从芍药根(P.lactifloraroot)中纯化出没食子酸甲酯(MG)和1,2,3,4,6-五-O-没食子酰-β-二吡喃葡萄糖(PGG),二者对幽门螺杆菌脲酶的抑制IC50值分别为1 330和72 μmol/L。而参比脲酶抑制剂乙酰氧肟酸与硫脲的IC50值分别为49与568 μmol/L。与参比抑制剂乙酰氧肟酸相比,PGG不仅脲酶抑制活性高,而且还具有抗幽门螺旋杆菌的活性,其机制为改变细菌膜通透性,从而破坏质子动力和膜相关功能,同时促进细胞内酸化,破坏微生物ATP合成酶。因此,在应用PGG时还应注意评估其对某些细菌的抗菌活性。Kubo等[11]从腰果(Anacardiumoccidentale)中分离出的漆树酸。漆树酸对幽门螺杆菌脲酶的抑制IC50值为21 μmol/L,是一种竞争性脲酶抑制剂。同时该化合物还具有抗幽门螺旋杆菌活性。SAR研究表明,该化合物的不饱和C15∶3结构中烷基侧链在烃侧链中具有约30°的弯曲,通过顺式构型与分子上双键相互作用,使得侧链中顺式构型的2个双键产生更多的弯曲,并显著缩短了侧链的长度。该结构对于该类化合物的抗菌活性具有重要作用。
Arfan等[12]从粗糠柴(Mallotusphilippensis)树皮的丙酮提取物中分离出岩白菜素(bergenin),该化合物是一种有效的抗氧化化合物,生物毒性低且具有肠道保护作用。对巴氏杆菌脲酶的IC50值为21.7 μmol/L(硫脲IC50值=25 μmol/L),为竞争性脲酶抑制剂。岩白菜素与巴氏杆菌脲酶活性中心的结合模式(图1)。该化合物能够与镍离子及活性中心中重要的氨基酸残基相互作用。岩白菜素与脲酶活性中心的Lys 169、Ala 266、Arg 339、Gly 280、Asp 363形成氢键,与His 323、Lys 169、His 249、Met 367、His 222和Ala 366形成疏水相互作用,从而抑制脲酶活性。
2.2 苯丙酸类
苯丙酸类化合物含C6-C3结构,是一种含有酚羟基取代基的芳香羧酸。该类化合物与酚酸类化合物的化学特性类似。Ahmad等[6]从秋海棠中分离出咖啡酸和异阿魏酸,这2个化合物对刀豆脲酶IC50值分别为69.8和72.4 μmol/L。而Arfan等[13]从灌木金丝桃壁(Hypericumoblongifolium)中提取的咖啡酸衍生物对刀豆脲酶的IC50值为20.96 μmol/L,优于参比脲酶抑制剂硫脲(IC50值=21.0 μmol/L)。

图1 岩白菜素与巴氏杆菌脲酶的结合模式图
2.3 芪类(stilbene)化合物
芪类化合物以均二苯乙烯为基本单位,在植物正常组织中含量低。天然芪类化合物是植物的应激产物。Xiao等[14]从高等植物中分离出了2,3,4,4-四羟基-二氢芪,其对幽门螺杆菌脲酶的IC50值为30 μmol/L,为竞争性、时间依赖性抑制剂。此外,SAR研究表明,化学结构中2个邻羟基对该化合物的脲酶抑制活性至关重要。当该化合物的异黄酮结构的C环断裂时,其脲酶抑制活性明显降低。Paulo等[15]从葡萄(Vitisvinifera)中分离出白藜芦醇,当浓度为1.75 μmol/L时,可抑制幽门螺旋杆菌脲酶90%的活性。动力学研究表明,白藜芦醇是幽门螺杆菌脲酶的非竞争性和可逆性抑制剂。此外,白藜芦醇还具有多种其他生理活性,如抗氧化、抗炎、调节脂代谢等。已广泛应用于反刍动物瘤胃气体减排、畜禽肉胴体脂肪品质的提升[38]。
3 类黄酮类化合物
类黄酮化合物是以黄酮(2-苯基色原酮)为母核而衍生出的一系列天然化合物,可分成不同亚类,如黄酮、黄酮醇、儿茶素等。类黄酮类物质具有广泛的生物活性,是脲酶抑制剂的重要来源之一。
3.1 儿茶素
儿茶素是从茶叶等天然植物中提取出来的一类酚类活性物质,具有抗肿瘤、抗氧化、抗病菌等多种生物活性,此类活性物质的特点是含有多羟基结构。多羟基结构使得儿茶素在中性和碱性条件下结构不稳定,易在生物酶作用下发生甲基化或糖苷化。在儿茶素结构中引入其他基团可有效提高其稳定性和生物利用率,并能增强儿茶素特定的生物活性。例如,糖苷儿茶素水溶性显著提高,酰化儿茶素脂溶性增强,其抗氧化活性亦随之增强。因此,对于儿茶素类脲酶抑制剂的化学结构进行修饰,有望开发出抑制效果好、稳定性强的新型脲酶抑制剂。
Matsubara等[16]从绿茶中分离得到4个儿茶素类化合物:表没食子儿茶素没食子酸酯、没食子儿茶素没食子酸酯、没食子儿茶素和表没食子儿茶素。这些化合物对幽门螺杆菌脲酶抑制的IC50值分别为2.2、9.8、8.7和19.6 μmol/L,均为竞争性脲酶抑制剂。SAR研究表明,在这4个儿茶素化合物的化学结构中,B环的5′位有羟基,与5′位没有羟基的其他儿茶素类化合物相比,这4个化合物的脲酶的抑制作用增强了35~104倍。因此,5′位是否有羟基对于儿茶素类化合物是否具有较强的脲酶抑制作用至关重要。Macomber等[39]以产气克雷伯氏菌脲酶为对象,通过基因定点突变技术,研究了表没食子儿茶素与脲酶的结合位点。结果表明,表没食子儿茶素通过与脲酶活性中心外柔性片状区域的Cys319位点结合以固定脲酶构象,阻止底物尿素进入脲酶活性中心,从而抑制脲酶的活性。
3.2 黄酮类化合物
黄酮类化合物分子中具有2-苯基色原酮(flavone)结构,含有酮式羰基,分子第1位上的氧原子具有碱性,能与强酸成盐。由于该类化合物羟基衍生物为黄色,故称黄酮。Shabana等[17]从植物番石榴(Psidiumguajava)提取物中发现,槲皮素是一种有效的抗氧化剂黄酮醇,其对刀豆脲酶的IC50值为80 μmol/L,但对发酵乳杆菌脲酶(L.fermentum)几乎无抑制活性。将槲皮素化合物结构中的3′-羟基和4′-羟基糖基化,可降低该化合物对刀豆脲酶的抑制活性,从而提高该化合物对发酵乳杆菌脲酶的抑制活性。因此,糖基化位点的位置对于槲皮素及其衍生物的脲酶抑制作用十分重要。Ahmad等[6]从秋海棠提取物中纯化获得了3′-甲基槲皮素,其对刀豆脲酶的IC50值为76 μmol/L。
Xiao等[18]从金银花(LonicerajaponicaThunb)中提取的杨梅素和木犀草素2种化合物,对幽门螺旋杆菌的IC50值分别为77.2和35.5 μmol/L。Xiao等[18]进一步研究了槲皮素的作用模式(图2),结果表明,槲皮素对幽门螺旋杆菌脲酶的IC50值为11.2 μmol/L,其脲酶抑制活性优于参比脲酶抑制剂乙酰氧肟酸[IC50值=(19.4±2.0) μmol/L]。酶动力学研究表明,槲皮素是幽门螺旋杆菌脲酶的非竞争性脲酶抑制剂。SAR研究表明,3-OH、5-OH和3′,4′-二羟基对于该化合物的脲酶抑制活性非常重要,与Shabana等[17]报道结果相符。Liu等[19]报道了鹰嘴豆素A对脲酶的IC50值为320 μmol/L,该研究还通过16S rRNA基因测序揭示了该天然产物化合物能够减少瘤胃细菌体外发酵体系中蛋白降解菌中普雷沃氏菌属和链球菌属的丰度并降低谷氨酸、赖氨酸、蛋氨酸、亮氨酸和总氨基酸的降解量。

图2 槲皮素与幽门螺旋杆菌脲酶的结合模式图
3.3 黄酮O-糖苷类化合物
黄酮类糖苷是以黄酮为基本骨架,根据糖基与糖基骨架链接的位置及基团,分为黄酮O-糖苷类化合物及黄酮C-糖苷,糖基部分主要包括葡萄糖、半乳糖、鼠李糖、木糖、阿拉伯糖等,且部分糖基存在着乙酰化、丙二酰化等现象,使得该类化合物具有多种生物活性。
黄酮O-糖苷类化合物为糖取代基以氢氧化形式与黄酮碳骨架相连,形成黄酮O-糖苷。Shabana等[17]从洋葱(Alliumcepa)中纯化的槲皮素-4-O-0-β-D-吡喃葡萄糖苷,对刀豆脲酶的抑制IC50值为190 μmol/L。当该槲皮素苷中的3-羟基被芦丁糖取代后,脲酶抑制活性降低了4倍以上,说明过高的亲水性会降低该类化合物与酶的结合能。SAR研究表明,化合物骨架中含有羟基是该化合物脲酶抑制作用的关键结构特征。去除槲皮素中的羟基会导致该化合物的脲酶抑制活性急剧下降。将该类化合物中的羟基甲基化,会进一步降低其脲酶抑制活性,最终导致该化合物因疏水性显著增加而完全丧失其脲酶抑制活性[18]。Tan等[20]从干燥的黄芩(Scutellariabaicalensis)根中提纯的黄芩苷,是一种黄酮类葡萄糖醛酸苷,随后研究了其与刀豆脲酶的作用模式(图3),发现该化合物以刀豆脲酶活性中心的硫醇结构为靶点,其IC50值为270 μmol/L,为非竞争性脲酶抑制剂。

图3 黄芩苷与刀豆脲酶的结合模式图
Wu等[21]从中草药植物灯盏花(Erigeronbreviscapus)中提取了黄芩素,是一种黄酮类葡萄糖醛酸苷,对刀豆脲酶的IC50值为1 350 μmol/L,而槲皮素作为参比脲酶抑制剂,在相同体系下其对刀豆脲酶的IC50值为617 μmol/L。分子对接结果表明,黄芩素可与脲酶活性中心巯基结合而抑制该脲酶的活性。Yu等[22]验证了黄芩苷和黄芩素对脲酶的抑制作用,发现这2个化合物对幽门螺旋杆菌脲酶的IC50值分别为820和470 μmol/L,而参比脲酶抑制剂乙酰氧肟酸的IC50值为140 μmol/L。黄芩苷和黄芩素均为幽门螺旋杆菌脲酶的非竞争性抑制剂。该研究同时揭示了黄芩苷和黄芩素不仅能与脲酶活性中心巯基结合,还能与Cys321位点结合,从而抑制脲酶活性。
3.4 黄酮C-糖苷
黄酮C-糖苷为糖取代基与黄酮A环上的C原子直接相连所形成的一类化合物。Perveen等[23]从非洲菊(Celtisafricana)的正丁醇可溶性部分中纯化出4种C-糖基类黄酮化合物,牡荆素(vitexin)、荭草素(orientin)、异日本獐牙菜素(isoswertiajaponin)和异当药黄素(isoswertisin)。这些化合物对刀豆脲酶的抑制IC50值分别为35、28、38和43 μmol/L,而参比脲酶抑制剂硫脲的IC50值为21.5 μmol/L。SAR研究表明,化合物中糖基部分的存在增加了这些化合物的抗脲酶活性。
3.5 黃烷酮类
Kim等[24]从三叶枳(Poncirustrifoliate)的提取物中纯化得到5,7-二羟基-40-甲氧基黄烷酮,该化合物为枸橘甙(poncirin)的主要代谢产物,能被人的肠道微生物代谢。该化合物具很强的幽门螺旋杆菌脲酶抑制活性,IC50值为15.8 μmol/L。此外,该化合物为脲酶的非竞争性抑制剂,对幽门螺杆菌具有直接抑菌活性。
4 萜类化合物
萜类化合物是植物中的一类大而多样的有机化合物,广泛存在于植物的香精、树脂、色素中。萜类化合物的基本化学骨架由异戊二烯单元构成,是甲戊二羟酸的衍生物。其化学结构中C1、C3、C4、环戊烷部位为活性部位,其中C1位易与羟基、甲氧基或酮基结合,与羟基结合时易与糖结合形成苷;C3、C4位易氧化形成双键,C4位易形成羰基、羧基、酯基等;环戊烷部位依氧化程度不同形成不同的环。这些活性部位对萜类化合物的生物活性至关重要。根据萜类化合物中异戊二烯单元的数量,可将该类化合物进一步分为单萜类化合物(monoterpenoids)、二萜类化合物(diterpene)以及三萜类化合物(triterpenoids)。
4.1 单萜类化合物
单萜由2个异戊二烯单元构成,分为无环单萜、单环单萜、双环单萜及三环单萜4类,前3类多见于天然化合物。Ahmed等[25]从秋海棠根的甲醇提取物中纯化出维诺酮(vernonione)。维诺酮对刀豆脲酶具有明显的抑制作用,IC50值为227.6 μmol/L。
4.2 二萜类化合物
二萜的分子式为(C5H8)4,由4个异戊二烯单元构成。Ahmad等[40]从大戟属(Euphorbiadecipiens)植物中分离出的具有曼西醇型骨架的二萜类酯类化合物—3,7,15-三-O-乙酰基-5-O-烟酰胺基-13,14-二羟基肉豆蔻素,该化合物对刀豆脲酶的IC50值为81.9 μmol/L,而在另一篇报道中,该化合物对巴氏杆菌脲酶的抑制效果较好,抑制常数(Ki)为117.4 μmol/L,是巴氏杆菌脲酶的反竞争性抑制剂[26]。
4.3 三萜类化合物
三萜类化合物由6个异戊二烯单位聚合而成,以游离形式或以与糖结合成苷或酯的形式存在于植物体内。
Akhtar等[27]从鸡蛋花(Plumeriarubra)甲醇提取物的乙酸乙酯溶解物中分离出芦丁醇(rrubrajaleelol)和红杨酸(rubrajaleelic acid)。它们对幽门螺旋杆菌脲酶的IC50值分别为24.2和58.9 μmol/L。
Kazmi等[28]从花楸属植物(Sorbuscashmiriana)的甲醇提取物的氯仿可溶部分中分离出的2种新的羽扇烷型三萜类化合物山梨素A(sorbicins A)和山梨素B(sorbicins B)。山梨素A对刀豆脲酶的IC50值为85.2 μmol/L,山梨素B对刀豆脲酶的IC50值为17.8 μmol/L,可见山梨素B的脲酶抑制活性要强于参比脲酶抑制剂硫脲(IC50值为21.6 μmol/L)。
Khan等[29]从驼蹄瓣(ZygophyllumfabagoLinn)分离出5种乌苏烷型硫酸皂苷。其中3β,23-双-O-磺酰-23-羟基脲-20(21)-烯-28-乌苏酸28-O-[β-D-吡喃葡萄糖基]-酯(人参皂甙A)在浓度为500 μmol/L时,对巴氏杆菌脲酶抑制率达87%。在该浓度下参比脲酶抑制剂硫脲的抑制率为98%。SAR研究表明,该类化合物结构中硫酸酯部分,有助于将分子固定在脲酶的活性中心的口袋状结构中,对这些化合物的脲酶抑制活性起着重要作用。
5 其他植物有效成分提纯物
5.1 生物碱类
生物碱是一类天然存在的有机含氮碱。生物碱对人类和动物具有各种重要的生理作用。它们由包括植物在内的多种生物产生。Ahmed等[30]自板蓝根(Isatistinctoria)中分离出的3-羟乙基葡萄球菌素和表红葡萄球菌素,对巴氏杆菌脲酶的IC50值分别为25.6和37.0 μmol/L,对刀豆脲酶IC50值分别为31.7和47.3 μmol/L。SAR分析表明,该化合物的羟基/羰基与脲酶的活性位点的螯合有关,随着羟基/羰基数量的增加,该类化合物的脲酶抑制活性增加。如3-羟乙基葡萄球菌素化学结构中的羟基比表红葡萄球菌素多,因其脲酶抑制活性更强。
小檗碱是植物中分离得到的一种生物碱,具有广泛的生理功能,其潜在的生物活性具有较大的开发和应用价值。近年来,有关小檗碱及其衍生物的脲酶抑制活性报道较多。Li等[31]报道了小檗碱的幽门螺旋杆菌脲酶及刀豆脲酶抑制活性,其IC50值分别为7.135×103和9.097×103μmol/L,而相同条件下参比脲酶抑制剂乙酰氧肟酸的IC50值分别为41.294和25.310 μmol/L。Bae等[41]还报道了小檗碱对幽门螺旋杆菌的抗菌活性,其最低抑菌浓度(MIC)值为40 μg/mL。Tan等[32]从黄连(Rhizomacoptidis)中分离出盐酸小檗碱,其对幽门螺旋杆菌脲酶的IC50值为(3.00±0.01) μmol/L,对刀豆脲酶的IC50值为(2.30±0.01) μmol/L,而参比脲酶抑制剂乙酰氧肟酸对幽门螺旋杆菌的IC50值为(83.00±0.01) μmol/L,对刀豆脲酶的IC50值为(22.00±0.01) μmol/L。表小檗碱与脲酶蛋白的巯基结合而抑制其活性。酶动力学研究表明,表小檗碱是幽门螺旋杆菌的反竞争性抑制剂,相应的Ki值为(10.60±0.01) μmol/L,为刀豆脲酶的竞争性抑制剂,相应的Ki值为(4.60±0.01) μmol/L。分子对接表明,表小檗碱通过N—H……O相互作用与幽门螺旋杆菌脲酶上的氨基酸残基Asn-168和Met-366相互作用(图4-A),与刀豆脲酶上的Gly-641相互作用(图4-B)。

图4 表小檗碱与幽门螺旋杆菌脲酶(A)及刀豆脲酶(B)的结合模式图
5.2 醌类
Zaborska等[42]报道了1,4-萘醌对刀豆脲酶的抑制活性,其IC50值为30 μmol/L。Kot等[43]评价植物来源的5-羟基-1,4-萘醌和1,4-萘醌对刀豆脲酶的抑制活性,IC50值分别为13.5和20.0 μmol/L。
Uddin等[33]从散沫花(L.albaLam)的茎中分离获得了2-(β-D-二吡喃葡萄糖氧基)-1,4-萘醌。该化合物对刀豆脲酶的IC50值为62 μmol/L。研究表明醌类化合物的脲酶抑制活性与它们在桥接脲酶中巯基的能力有关。Muhammad等[34]从草药紫罗兰(ViolaBetonicifolia)中提纯出3-甲氧基黄檀酮。该化合物对巴氏杆菌脲酶的IC50值为169 μmol/L。该化合物是脲酶的竞争性抑制剂,相应的Ki值为138.2 μmol/L。
5.3 鞘脂类化合物
Akhtar等[27]从红杨(P.rubra)中提取了红藻糖苷。该化合物对幽门螺旋杆菌脲酶的IC50值为45.7 μmol/L。Firdous等[35]从蛇床子(Heliotropiumophioglossum)中纯化出2种新型鞘脂的邻苯二甲酰胺A(ophiamide A)和邻苯二甲酰胺(ophiamide B),对刀豆脲酶的IC50值分别为23.1和12.6 μmol/L。SAR研究表明,该类化合物结构中糖基(葡萄糖)结构对于其脲酶抑制活性至关重要。
5.4 含硫化合物
Fahey等[36]从西兰花(broccoli)中分离出伊贝林(iberin)和萝卜硫素(sulforaphane)。2种化合物对刀豆脲酶的IC50值分别为178.8和190.5 μmol/L,对幽门螺杆菌脲酶的IC50值分别为216.8和225.7 μmol/L,Juszkiewicz等[37]从大蒜中分离出大蒜素(allicin),对刀豆脲酶的IC50值为21.8 μmol/L。SAR研究表明,大蒜素的脲酶抑制活性与其同活性中心中Cys592位点的SH-基团之间的结合有关。
6 小 结
植物天然产物化合物的结构丰富,是低生物毒性、副作用小的脲酶抑制剂的理想来源之一。而目前开发植物天然产物化合物作为脲酶抑制剂主要的发展方向为:1)在未来研究中,应尽量获取植物提取物中单一成分的植物天然产物化合物,并研究不同配比植物天然产物化合物的脲酶抑制效果及其中各单一成分化合物的化学结构与其脲酶抑制作用的构效关系,丰富具有脲酶抑制作用的化学骨架库。2)进一步研究羟基、羧基、脂链烃及类黄酮结构等报道较多的具有脲酶抑制作用的化学骨架之间的互作关系,为脲酶抑制先导化合物及天然化合物的修饰与优化提供理论依据。3)目前对于植物提取物中天然化合物的评价还停留在简单的脲酶活性和酶动力学评价水平,对产品开发参考作用有限,应进一步以体外微生物培养及动物模型评价这些化合物,探讨它们对微生物区系、动物健康及生产指标的影响,并给出在动物生产中适宜的添加量,同时还应考虑天然化合物的多效性,从多方面进行评价。4)开发植物天然产物化合物的合成工艺,以利于工业化合成并降低合成成本。

