纤维素分解菌与布氏乳杆菌联合接种对青贮玉米发酵品质、有氧稳定性和瘤胃降解参数的影响
张凡凡 张玉琳 王旭哲 贾舒安,2 马春晖*
(1.石河子大学动物科技学院,石河子832000;2.新疆维吾尔自治区动物卫生监督所,乌鲁木齐830011)
青贮玉米是世界范围内最为重要的反刍家畜饲料原料之一,而其发酵过程受制影响因素诸多,如何控制发酵体系厌氧条件、含水量、能氮平衡、产酸能力等,以达到提质降耗的目的是青贮加工研究的重点问题[1]。一直以来,添加微生物制剂是国内外学者改善青贮品质的主要手段[2-4]。乳酸菌制剂常被应用于各类青贮饲料中,其作为一种发酵促进剂,主要作用是调节青贮原料微生物区系,以确保青贮营养成分的保存;同时促进多糖和纤维的转化,提高青贮的消化率及适口性[1]。根据乳酸菌代谢产物的不同将其分为同质型和异质型乳酸菌[2-3]。其中,接种乳酸杆菌(Lactobacillusspp.)或片球菌(Pediococcusspp.)等的同质型乳酸菌可利用葡萄糖产生乳酸,确保发酵体系前期快速达到酸性环境,以减少蛋白质的降解和乙醇的生成;同时可显著提高干物质回收率和剩余可溶性碳水化合物含量,进而改善青贮品质[4]。然而同质型乳酸菌产生的挥发性脂肪酸(乙酸、丙酸)含量极少,不能有效抑制青贮中致腐真菌等的生长,不仅增加了干物质的损失,且造成青贮的二次发酵,降低有氧稳定性(aerobic stability,AS),并对家畜健康造成潜在威胁[5-7]。类如布氏乳杆菌(Lactobacillusbuchneri)或肠膜明串珠菌(Leuconostocmesenteroides)等的异质型乳酸菌虽消耗青贮底物营养物质较多,且乳酸转化效率低,但其利用葡萄糖和乳酸源产生的乙酸能够有效抑制霉菌的生长,且可通过提高青贮的有氧稳定性以弥补潜在的营养损失[6-8]。因此,诸多研究采用同质型、异质型乳酸菌联合接种以改善青贮品质[2-3];但即便联合接种,异质型乳酸菌在发酵体系中仍占据主要地位;众多研究也证实了采用同质型乳酸菌∶异质型乳酸菌=1∶4的比例进行联合接种效果更优[2]。随着目前饲料业的飞速发展,单纯乳酸菌制剂依然不能满足现有行业的需求,因此诸多学者将乳酸菌制剂与纤维素酶、半纤维素酶等酶制剂进行配合使用,其主要目的是通过纤维类物质向单糖的转化,促进乳酸菌发酵,提高饲料利用率及动物生产性能[9-10]。那么,利用某些纤维素分解菌(cellulose decomposing bacteria,CDB)产酶特性是否能达到相同的目的?黑曲霉(Aspergillusniger)、绿色木霉(Trichodermaviride)、枯草芽孢杆菌(Bacillussubtilis)作为美国食品药品监督管理局(FDA)和我国农业部认证的安全菌,均能产生高活性的纤维素酶、酸性蛋白酶、果胶酶等多种胞外酶,适合饲用复合酶的固体生产[11]。这3种产酶菌均为好氧菌,理论上在青贮发酵早期大量繁殖,产生大量分解底物的酶类物质,迅速消耗原料中的氧气,使青贮饲料进入无氧状态,其活动还可以提高青贮体系温度,从而抑制其他好氧腐败菌的生长繁殖。此外,某些纤维素分解菌对青贮品质和奶牛消化率的提升作用也均已得到证实[12-13]。而这些产酶细菌与异质性乳酸菌的协同效果如何?是否能够改善青贮品质?目前尚未明确。鉴于此,本研究拟将Aspergillusniger、Trichodermaviride、Bacillussubtilis与Lactobacillusbuchneri联合接种发酵青贮玉米,通过对青贮玉米发酵品质、微生物含量、有氧稳定性、瘤胃降解率等的详细分析,明确二者之间协同作用对青贮发酵的影响,为我国今后新型青贮菌剂的研发提供理论依据。
1 材料与方法
1.1 试验材料
青贮玉米试验地位于新疆石河子大学牧草试验站(N44°20′,E88°30′,海拔420 m),当地为典型的大陆性干旱气候,年日照时间2 721~2 818 h,年降水量180~270 mm,年蒸发量1 000~1 500 mm,年平均温度7.5~8.2 ℃,无霜期147~191 d。耕作土层(0~30 cm)有机质含量16.7 g/kg,碱解氮含量17.3 g/kg,速效磷含量0.64 g/kg,pH为6.44。青贮玉米种植时间为2017年4月10日至2017年8月20日(生长期为112 d),玉米种植为穴播,密度按照宽窄行处理(60 cm+40 cm),种植面积为1 050 m2,灌水方式采用滴灌,按照一般青贮玉米种植管理模式进行管理。在青贮玉米进入乳熟末期蜡熟初期(玉米乳线超过2/3)时进行全株刈割,当场粉碎至2 cm左右长度,待贮。
BacillussubtilisACCC19374、AspergillusnigerACCC 30134和TrichodermavirideACCC 30595,购自中国农业微生物菌种保藏管理中心(ACCC),LactobacillusbuchneriCICC 20293购自中国工业微生物菌种保藏管理中心(CICC)。
1.2 试验设计
全株玉米粉碎后立刻采用真空袋法调制青贮(同时留取发酵初始样品进行各指标分析)。试验设3个处理,CK处理(对照处理)不添加任何菌种;Y处理添加4.7×105CFU/gLactobacillusbuchneri;YX处理添加4.7×105CFU/gLactobacillusbuchneri和纤维素分解菌,纤维素分解菌添加比例为Aspergillusniger∶Trichodermaviride∶Bacillussubtilis=2∶1∶1(质量比),添加量为0.3%,添加比例和添加量均已在实验室理论情况下进行初步验证[11]。将各菌种分别在MRS(培养Lactobacillusbuchneri)、NB(培养Bacillussubtilis)、PDA(培养Aspergillusniger、Trichodermaviride)液体培养基中培养,平板计数后确定其数量,按比例配制菌液,以鲜重为基础进行添加。各处理分别混合均匀后称取约2.0 kg样品于聚乙烯厌氧袋中真空密封(真空袋规格40 cm×50 cm),实验室环境(23~30 ℃)下发酵60 d,每个处理6个重复,共计调制18袋。第60天时全部模拟开窖(厌氧袋开袋),测定相关指标(测定3个重复)。
1.3 测定指标及方法
发酵特性主要测定pH、可溶性碳水化合物(WSC)、有机酸(乳酸、乙酸、丙酸、丁酸)和氨态氮(NH3-N)含量。其中,pH用酸度计(PHSJ3F酸度计,上海仪电科学仪器股份有限公司)测定,WSC含量采用蒽酮比色法(722可见分光光度计,上海精密科学仪器有限公司)测定,有机酸含量采用液相色谱法(Agilent 1260高效液相色谱仪,美国安捷伦科技公司)测定,氨态氮(NH3-N)含量采用苯酚-次氯酸比色法[14-15]测定。
营养物质指标主要测定干物质(DM)、粗蛋白质(CP)、粗脂肪(EE)、粗灰分(Ash)、淀粉(Starch)、中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。其中,DM含量采用烘干法(精密型电热恒温鼓风干燥箱,上海合恒仪器设备有限公司)测定,CP含量采用凯氏定氮法(Kjeltec 8400 FOSS全自动凯氏定氮仪,美国福斯公司)测定,EE含量参照索氏浸提法(玻璃索氏提取器)测定,Ash含量参照采用灰化法(XL-3000型高效节能智能一体马弗炉,上海合恒仪器设备有限公司)测定[15],Starch含量参照酶水解法测定[16],NDF和ADF含量采用ANKOM A200i全自动纤维分析仪(美国安康公司)测定。
微生物主要测定乳酸菌(lactic acid bacteria,LAB)、酵母菌、好氧细菌(aerobic bacteria,AB)和霉菌数量。好氧细菌、乳酸菌、酵母菌、霉菌分别采用MRS培养基、麦芽糖浸粉琼脂培养基、营养琼脂培养基和高盐察氏培养基进行培养(培养基均采购自北京路桥集团有限公司),培养结束后进行平板计数,并计算微生物数量[17]。
有氧稳定性主要测定样品60 d开袋后的温度变化(设定每5 min间隔记录1次),将多点式温度记录仪(i500-E3TW,玉环智拓仪器科技有限公司)的多个探头分别放置于发酵袋中心,每个处理放置3个温度探头,同时在实验室中放置3个探头测定环境温度。当样品温度高于环境温度2 ℃时记录时间即为有氧稳定性时间[5]。二氧化碳(CO2)浓度测定按文献描述[5,7,18],自制CO2产气装置。所有产气装置置于30 ℃的恒温培养箱中进行测定。
选用3只体况良好、体重(50.0±2.00) kg、安装永久性瘤胃瘘管的哈萨克羊。试验饲粮由200 g精料(精料组成:玉米51.0%、麸皮24.0%、豆粕18.0%、碳酸氢钙2.5%、添加剂2.0%、尿素1.5%、食盐1.0%,天康畜牧生物技术公司提供)和1.8 kg青贮玉米组成,于晨饲前(08:00)进行投放,全天自由饮水。参照瘤胃瘘管尼龙袋法[19]测定青贮玉米在瘤胃中12、24、36、48、72 h的DM、NDF、ADF、有机物(OM)含量,将前期测定营养品质指标的烘干样品复烘(65 ℃)至恒定过筛(40目),装在尼龙袋中,尼龙袋尺寸为6 cm×9 cm,孔径40~50 μm,每袋准确填装3 g样品,填装后用尼龙线扎口绑在铁链上投放至瘤胃中,每个样品每个时间点每头羊设置4个重复,共计180袋,分2次进行投放,各处理样品随机放置于3只羊瘤胃中,每次每只羊30个。到相应时间后将尼龙袋取出冲洗干净,在65 ℃烘箱中烘干48 h,测定各营养成分含量。瘤胃降解率和降解特征参数计算方法如下[20-21]:
Dx=[(MA-MB)/MA]×100;
Dp=a+b(1-e-ct)×100;
ED=a+[(b×c)/(k+c)]×100。
式中:Dx为待测样品某成分的瘤胃降解率(%);MA为待测样品消化前某成分含量(g);MB为待测样品消化后某成分含量(g);Dp为t时刻被测样品中某成分的实时瘤胃降解效率(%);t为饲料在瘤胃内停留的时间(h);a为快速降解部分(%);b为慢速降解部分(%);c为慢速降解部分的降解速率(%/h);ED为某成分在瘤胃内的有效降解率(%);k为被测样品中某成分瘤胃外流速率常数(%/h),取1.8%/h。采用Matlab软件进行偏最小二乘计算,求得各相关参数。
1.4 数据分析
试验数据使用Excel 2016软件整理,采用SPSS 22.0统计软件进行F检验,F检验之后进行单因素方差分析(one-way ANOVA),多重比较采用Duncan氏法。采用Origin 2017软件进行绘图。采用模糊相似优先比法评价最优处理[22],运用DPS V7.05软件将样品10项指标进行分析计算(由于本研究各处理对某些重要指标无显著影响,因此仅选择存在显著差异的指标进行评价),对其设定识别标识为1;固定样本即为参考品种(各指标为理论最优),对其设定识别标识为0,执行“模糊相似优先比分析”功能,计算结果中待测样与参考品种的相似程度大小即反映牧草品质的优劣。
2 结果与分析
2.1 不同处理对青贮玉米发酵品质及微生物数量的影响
由表1可知,各处理pH、WSC、DM、淀粉、NDF、ADF含量及4类主要微生物(好氧细菌、乳酸菌、酵母菌、霉菌)数量均较初始发酵时明显下降,乳酸、乙酸、NH3-N、EE含量较初始发酵时明显上升,CP和Ash含量变化不明显。其中,Y处理pH显著低于CK和YX处理(P<0.05),CK处理WSC含量显著高于Y和YX处理(P<0.05),YX处理乳酸含量显著高于CK和Y处理(P<0.05),YX处理乙酸含量显著高于CK处理(P<0.05),各处理丙酸和丁酸含量均未检测出,Y处理DM含量显著高于CK处理(P<0.05),YX处理NDF含量显著低于CK和Y处理(P<0.05),YX处理EE含量显著高于CK和Y处理(P<0.05)。各处理间NH3-N、淀粉、CP、ADF、Ash含量及4类主要微生物数量差异均不显著(P>0.05)。
2.2 不同处理对青贮玉米开袋第5天时有氧稳定性及微生物数量的影响
由表2可知,青贮玉米开袋第5天时,YX处理pH和霉菌数量均显著高于Y和CK处理(P<0.05),CK处理CO2浓度显著高于Y和YX处理(P<0.05),YX和Y处理有氧稳定性显著高于CK处理(P<0.05)。各处理间好氧细菌、乳酸菌、酵母菌数量差异均不显著(P>0.05)。
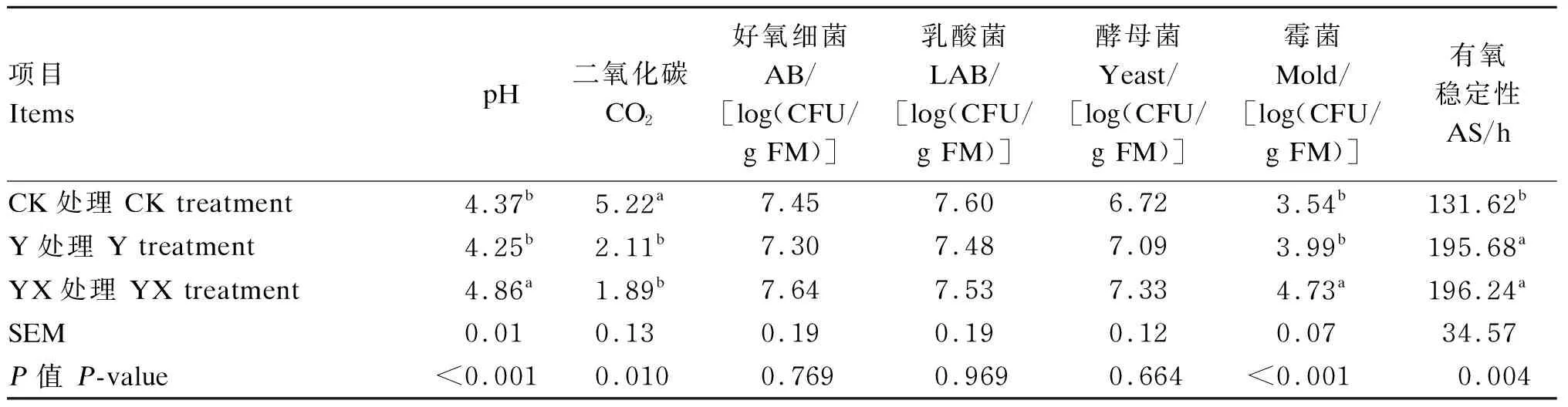
表2 不同处理对青贮玉米开袋第5天时有氧稳定性及微生物数量的影响
2.4 不同处理对青贮玉米瘤胃营养物质降解率及降解参数的影响
由图1可知,随瘤胃停留时间的延长,各营养物质在瘤胃中的降解率呈上升趋势。其中,DM降解率仅在48 h时,CK处理显著高于Y处理(P<0.05);NDF降解率仅在36 h时,Y处理显著高于CK处理(P<0.05);OM降解率仅在72 h时,CK和Y处理显著高于YX处理(P<0.05)。
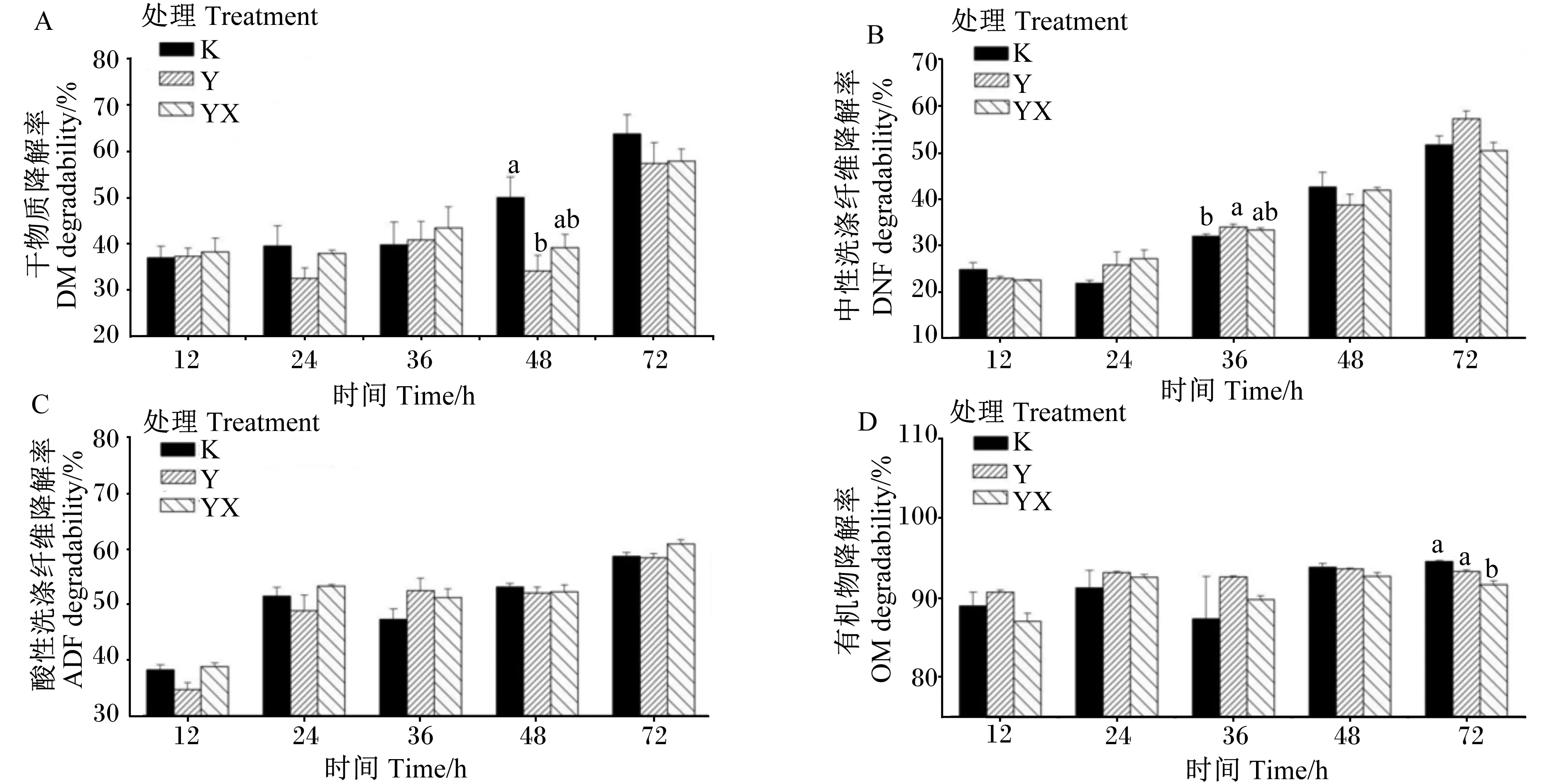
数据柱形标注不同小写字母表示差异显著(P<0.05)。
由表3可知,DM降解参数中,Y处理的DM基础含量显著高于CK处理(P<0.05),CK处理的DM有效降解率显著高于YX处理(P<0.05)。NDF降解参数中,YX处理的NDF基础含量显著低于Y和CK处理(P<0.001),YX处理的NDF慢速降解部分的降解速率显著高于Y处理(P<0.05)。各处理间其余各指标降解参数差异均不显著(P>0.05)。

表3 不同处理对青贮玉米瘤胃降解参数的影响
2.5 不同处理复合发酵青贮玉米综合价值评价
采用模糊相似优先比分析,10个指标权重选取均设定见表4,求得不同处理与参考样本(表4)间各指标的相似序号之和,相似度越小,该处理与参考理想样本的综合价值越接近,综合价值越好,结果表明(表5),YX处理(1.80)>Y处理(1.95)>CK处理(2.25)。

表4 参考品种综合品质及其权重

表5 各处理与参考品种相似程度及综合价值排序
3 讨 论
3.1 纤维素分解菌与Lactobacillus buchneri复合发酵对青贮玉米发酵品质及微生物数量的影响
青贮饲料的发酵品质是由多个指标所共同决定的。饲料pH的增加是检验青贮饲料是否变质的直观参数[23],NH3-N和有机酸含量则反映青贮饲料中蛋白质和碳水化合物转化情况。其中,青贮过程中多种微生物对底物蛋白物质的大量消耗,转化成NH3-N和胺类物质;且pH在3~7时,随着pH的增大,蛋白质水解作用增强[1],本研究虽各处理pH存在差异,但均未显著影响蛋白质的腐败,即各处理间CP、NH3-N含量差异不显著,而各处理NH3-N含量较发酵前有所升高,其原因可能由于梭菌未被完全抑制,导致蛋白质分解所致[4];此外,由于发酵结束时未检测到丙酸与丁酸,更有可能的原因则是由于纤维素分解菌中Aspergillusniger提高了NH3-N含量[24],具体原因还有待进一步探索。以往研究在青贮玉米中单独添加Lactobacillusbuchneri或与纤维素酶联合接种均可降低青贮pH,提高乳酸、乙酸含量[8-10,25]。本研究Lactobacillusbuchneri与纤维素分解菌联合接种时,乳酸和乙酸含量均最高,说明纤维素分解菌的接种并未抑制青贮中乳酸菌的产酸能力,这与前期培养基中理论情况结论相同[11];而联合接种使得发酵体系整体pH变高,且开袋第5天时也表现相同结果,这说明接种纤维素分解菌可能降低了青贮抵御外来好氧微生物的能力,进而使得pH有略微升高;另一种可能是由于联合接种产生了竞争性抑制,进而一定程度上促进了同质性乳酸菌利用底物产乳酸的能力,具体原因还有待继续探索。但总体联合接种Lactobacillusbuchneri与纤维素分解菌有利于发酵体系产酸,维持较为适中的酸度。
以往研究表明,纤维素酶和乳酸菌制剂联合接种使用可有效减少青贮玉米NDF和ADF含量[9-10,26]。也有研究将纤维素酶、果胶酶与Lactobacillusbuchneri联合接种玉米秸秆后发现,NDF、ADF、纤维素及半纤维素含量显著降低,玉米秸秆营养品质得到改善[27]。本研究得到相同结果,其原因主要由于纤维素分解菌产胞外酶作用所致,这一结果证明了纤维素分解菌和Lactobacillusbuchneri复合接种,纤维素分解菌能够起到降解纤维的作用。本试验中,各处理DM含量较青贮前有所下降,而其中接种Lactobacillusbuchneri较不添加菌剂处理可显著提高DM含量,其原因可能是Lactobacillusbuchneri可启动发酵后期由异质型乳酸菌主导的异质型发酵,加速了青贮内乙酸等挥发性脂肪酸的生成,抑制有害微生物的活动,从而降低有害微生物对DM的损耗[2-3,6-8]。另外,本研究中各处理淀粉和WSC含量均较青贮前下降,其主要原因为青贮体系微生物对底物糖类物质的利用所致[1]。本研究中的2个接种处理均显著降低了WSC含量,一定程度上促进了乳酸、乙酸的生成;然而,各处理间淀粉含量无显著差异,其原因可能为纤维素分解菌中Bacillussubtilis产生的α-淀粉酶含量过低所致[28]。本研究中EE含量较发酵前有所升高,其与以往研究结果[29]相似,可能的原因主要由于水分的损失,造成混贮底物总质量下降;而复合接种较其他处理显著提高了发酵体系EE含量,其原因可能由于纤维素分解菌的作用抑制了脂肪类物质的腐败[24]。除此以外,发酵60 d时主要微生物数量较发酵前下降明显,而各处理之间并未产生显著差异,其原因主要是在青贮发酵的过程中,底物营养物质的消耗使得好氧细菌、乳酸菌发酵前期数量增加而发酵后期数量减少,直至趋于稳定;酵母菌和霉菌生长繁殖受到抑制,主要受发酵体系厌氧环境和酸性环境影响[1]。
3.2 纤维素分解菌与Lactobacillus buchneri复合发酵对青贮玉米有氧稳定性的影响
有氧稳定性是指青贮饲料在开封后随着pH、温度升高依然保持新鲜、气味酸香的能力。一般实际生产中青贮玉米开袋后接触到空气的部分不会超过5 d[6-8,30]。因此,本研究以有氧暴露第5天的各项指标分析不同处理对青贮玉米有氧稳定性的影响,结果表明Lactobacillusbuchneri单独或与纤维素分解菌联合接种均可显著降低CO2产气量,其主要原因由于异质型乳酸菌利用底物生成乙酸,抑制好氧微生物的生长[5]。同时,诸多研究表明,Lactobacillusbuchneri能够改善青贮饲料有氧稳定性[8],本研究也得到相同结论,Lactobacillusbuchneri无论单独或联合纤维素分解菌接种,均可使有氧稳定时间持续在190 h以上,显著高于不接种处理。霉菌、好氧细菌和酵母菌一直以来被认为是导致青贮饲料有氧变质的主要微生物。本研究中,接种纤维素分解菌的处理使得霉菌数量显著高于其他处理,原因主要由于纤维素分解菌中Aspergillusniger和Trichodermaviride增加了发酵体系霉菌数量;然而各处理间好氧细菌、乳酸菌和酵母菌数量并未产生显著差异,其原因主要由于开袋后发酵体系变成有氧环境,青贮底物接触到更多好氧微生物,不仅为其提供了繁殖所需要的营养物质,且pH的升高为好氧微生物创造了更有利的环境[5],因而在开袋有氧环境下各类菌剂未能显著影响微生物生长。另外,由于本研究采用真空袋法青贮,由于发酵体系较小(2 kg),接种的菌剂在有氧环境下发挥作用不明显,因此还需今后扩大发酵体系进行更为贴近生产的研究。
3.3 纤维素分解菌与Lactobacillus buchneri复合发酵对青贮玉米瘤胃降解率的影响及综合评价
微生物发酵可改变饲草原料细胞壁的微观结构,破解纤维素之间的碳链,使纤维结构疏松,有利于瘤胃微生物附着并产生消化酶,促进纤维成分快速降解,同时也有利于被木质化成分包被的营养成分释放,提高营养物质的瘤胃降解率[1,19,31]。诸多研究证实,青贮玉米在瘤胃中各营养物质的有效降解率主要取决于瘤胃消化时间,尤其是纤维性物质在瘤胃消化需要保证有效的消化时间[32]。在本试验中,DM、ADF、NDF、OM降解率随瘤胃停留时间的延长(12~72 h)逐渐升高,这与以往研究结果相同。瘤胃内环境作为一个相对复杂的微生物系统,其中多种微生物发挥着重要作用[19],而本研究接种各菌剂处理并未显著影响ADF、NDF和OM有效降解率,其原因可能由于接种的菌剂主要在发酵过程中起作用,仅改变了青贮的发酵品质和营养价值等,对瘤胃微生物区系的影响甚小。其中,Lactobacillusbuchneri和纤维素分解菌联合接种显著降低了DM有效降解率,其原因可能是二者的协同性作用限制了反刍家畜对DM的实际利用效率,具体还需要继续对协同效应进行深入研究。
目前,对于青贮质量的综合评价往往单纯以发酵指标、饲用指标等进行评价;或采用V-Score、隶属函数法进行综合评价[5,22,33]。采用这些评价方法评价较为片面且未考虑权重因素,因此本研究通过经验和文献法设定主要指标(各处理间产生显著变化的指标)权重,采用相似优先比分析,通过对标参考样本(理论设定各指标均为最优)进行综合评价,评价出的结果更具有全面性,以此得到最优处理为Lactobacillusbuchneri和纤维素分解菌联合接种综合效果最优,然而由于目前尚无青贮有氧稳定性和瘤胃降解率的相关国标,且在指标选取中,选择的指标不同造成了权重的不确定性,因此今后还需继续深入研究,明确各指标在青贮中的重要程度,以此作出更为科学的评价。
4 结 论
青贮玉米中Lactobacillusbuchneri单独或与纤维素分解菌群联合接种可有效改善青贮玉米的发酵品质,提高青贮的有氧稳定性。综合评价表明,纤维素分解菌和Lactobacillusbuchneri联合接种效果最好。

