猪圆环病毒1型LAMP检测方法的建立及初步应用
田瑶,李佳昕,杨莹,王硕,时建立,彭喆,李琛,徐绍建,吴晓燕,刘畅,韩红,李俊,3
(1.青岛农业大学动物医学院,山东 青岛 266109;2.山东省农业科学院畜牧兽医研究所,山东 济南 250100;3.山东师范大学生命科学院,山东 济南 250014)
猪圆环病毒(PCV)最初被认为是猪肾连续细胞系中的一种类似于微小病毒的病毒污染剂。随后,Allan等[1]证实该病毒来源于制备PK-15细胞的猪肾组织,是一种无包膜、小(17 nm)病毒,含有单链环状DNA基因组。在群体水平上,PCV1的血清流行率在10%到100%之间[2]。虽然PCV1对猪没有明显的致病性,但是PCV1和PCV2具有76%以上的核苷酸同源性,并且两种病毒在猪群中临床感染率均比较高,存在共同感染的现象,所以不能忽视PCV1的潜在致病性[3]。据报道,体外感染PCV1能够对猪肺泡巨噬细胞功能产生短暂影响[4]。经PCV1感染后部分仔猪的肺脏、肠道与淋巴器官等组织中能够检测出相应的抗原[5]。因此,目前仍难以排除PCV1对猪免疫系统的潜在损害作用。
LAMP是在2000年由日本的Notomi等[6]发明的一种能够在恒温条件下快速扩增核酸片段的技术。特异性核苷酸延伸是通过具有链置换活性的DNA聚合酶和两对内外引物实现的。保持恒定温度60~65℃在30~60 min内即可完成反应[7,8]。与其他方法相比,LAMP具有快速、特异、经济等优点[7-11]。SYBR GreenⅠ是一种可以结合在双链DNA双螺旋小沟区域的染料,游离状态时SYBR GreenⅠ可发出微弱荧光,肉眼观察呈橙色;与双链DNA结合后,荧光增强,紫外分析仪下呈绿色[12]。因此,SYBR GreenⅠ也被用于LAMP产物的检测[13]。
猪圆环病毒之间及其与猪瘟病毒、猪蓝耳病病毒之间存在共感染现象。PCV1可在肺组织中高效复制并产生病理学改变,因此建立一种PCV1的快速检测方法是必要的。
1 材料与方法
1.1 试验菌株与试剂
猪圆环病毒1型(PCV1)、猪圆环病毒2型(PCV2)、猪圆环病毒3型(PCV3)、猪伪狂犬病毒(PRV)、猪细小病毒(PPV)均由山东省畜禽疫病防治与繁育重点实验室保存。103份病料组织来自山东省规模化猪场。2×Lamp Master Mix购自生工生物工程(上海)股份有限公司;DL2000 DNA Marker购自宝生物工程(大连)有限公司;2×EasyTaq®PCR SuperMix购自北京全式金生物技术有限公司。Biospin病毒DNA提取试剂盒购自杭州博日科技股份有限公司;质粒小提试剂盒购自Axygen。
1.2 试验方法
1.2.1 引物设计 根据NCBI中GeneBank公布的PCV1基因序列(GenBank登录号:AY193712.1),利用在线设计软件Primer Explorer V 4.0(http://primerexplorer.jp/elamp4.0.0/index.html)设计LAMP引物。利用Primer 5.0设计普通PCR引物。引物均由生工生物工程(上海)股份有限公司合成。
1.2.2 DNA的提取及PCR扩增 采用Biospin病毒DNA提取试剂盒提取DNA并进行普通PCR扩增。反应体系(20.0μL):上游引物0.5μL,下游引物0.5μL,SuperMix 10.0μL,DNA模板0.5 μL,ddH2O 8.5μL。反应条件:95℃3 min;94℃30 s,56℃30 s,72℃30 s,30个循环;72℃7 min。反应结束取5μL扩增产物经1.0%琼脂糖凝胶电泳进行检测。
1.2.3 LAMP检测方法的建立 LAMP反应体系(25.0μL):2×Lamp Master Mix 12.5μL,FIP(10μmol/L)2.0μL,BIP(10μmol/L)2.0μL,F3(10μmol/L)0.5μL,B3(10μmol/L)0.5μL,DNA 模 板1.0μL,DNA Polymerase 0.5 μL,ddH2O 6.0μL。无菌去离子水作为阴性模板。反应结束后取5μL扩增产物经1.0%琼脂糖凝胶电泳进行检测。
1.2.4 LAMP反应条件优化 水浴温度控制在60℃进行反应时间优化,分别于水浴锅中反应40、45、50、55、60、65 min,取5μL扩增产物置于1.0%琼脂糖凝胶电泳进行检测,依据扩增效果确定最佳反应时间。选取最佳反应时间后分别将温度控制在57、58、59、60、61、62、63、64℃条件下扩增,反应结束取5μL扩增产物于1.0%琼脂糖凝胶电泳进行检测,确定最佳反应温度。
1.2.5 LAMP特异性和敏感性试验 分别以PPV、PRV、PCV2、PCV3为模板,同时设阴性对照。在优化条件下进行LAMP反应,扩增产物经1.0%琼脂糖凝胶电泳进行特异性检测。
将PCV1阳性质粒10倍倍比稀释(初始浓度为200 ng/μL)进行PCR及LAMP敏感性方法检测。
1.2.6 临床样品检测 取103份疑似患病猪组织分别进行LAMP和普通PCR检测,比较两种方法的检出率,评估建立的LAMP方法在临床检测上的适用性。
2 结果与分析
2.1 引物筛选
本研究设计了多组LAMP引物以及PCR引物,对各组引物扩增条带清晰度和整齐度进行比较,从而筛选出LAMP最佳引物组(表1)。PCR引物为F3、B3。PCR以及LAMP扩增条带大小均为190 bp左右。图1为筛选出的LAMP引物所在位置。
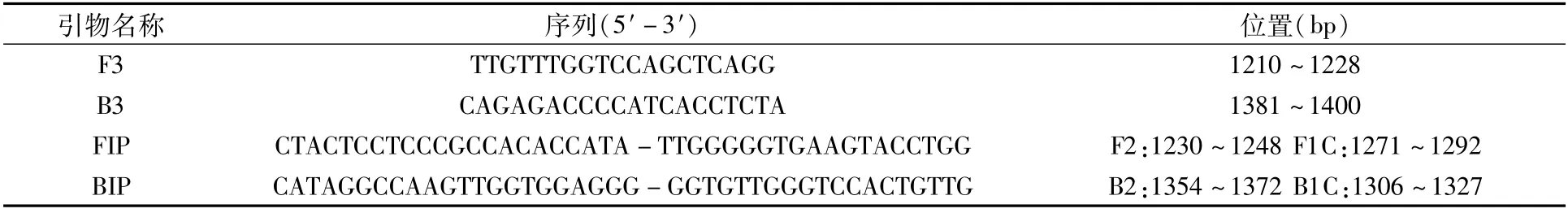
表1 引物序列和位置

图1 LAMP引物位置
2.2 LAMP反应条件优化
根据琼脂糖凝胶电泳结果中条带的清晰度以及整齐度,确定最佳反应时间为60 min(图2),最佳反应温度为62℃(图3)。
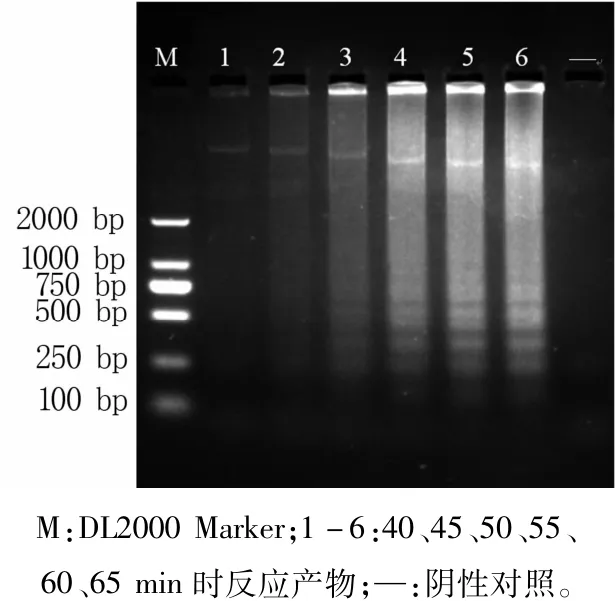
图2 LAMP反应时间优化

图3 LAMP反应温度优化
2.3 LAMP特异性
特异性试验(图4)及LAMP可视化结果(图5)显示,只有PCV1为阳性,其他均为阴性,说明该方法有很好的特异性。
图4 LAMP反应特异性

图5 LAMP可视化特异性试验
2.4 LAMP敏感性试验
敏感性试验表明,LAMP检测限为1×101copies/μL(图6、图7),普通PCR最低检测限为1×103copies/μL(图8)。

图6 LAMP敏感性试验

图7 LAMP可视化敏感性试验

图8 普通PCR敏感性试验
2.5 临床样品检测试验
对103份疑似患病猪组织分别进行LAMP和普通PCR检测,LAMP阳性率为34.0%(35例),普通PCR阳性率为29.1%(30例)。两种方法检测结果一致的样本数占总样本数的比例即为两者的符合率。结果表明,两种检验方法的符合率为89.5%。
3 讨论与结论
虽然PCV1对猪没有致病性,但是猪场中常存在PCV1、PCV2和PCV3共感染现象,对养猪业存在潜在的危险。Krakowka等[14]对接种未感染的细胞裂解物或单一病毒接种物(PPV、PCV-1或PCV-2)的仔猪进行研究,结果显示仔猪临床均正常,并且接种PCV-1的仔猪淋巴结出现轻度的增生,10头仔猪中有5头是短暂的病毒血症。因此,有必要建立一种快速、准确、敏感的PCV1检测方法。目前,环介导等温扩增技术已经和常规PCR、实时荧光定量PCR等共同成为常规检测的主要工具[15]。但是常规PCR和荧光定量PCR均需要特定的仪器设备,价格不但昂贵而且还需专业人员操作,成本高、检测时间长,不适用于现场快速检测。LAMP技术突出的优势在于不需要特定的仪器设备,只需要保持温度在60~65℃,且1 h之内就可以完成反应,具有简单、快速、特异性强和敏感性高等特点。在结果判定方面,已有多种肉眼可视的方法及实时荧光检测法得到广泛应用,可以从源头上控制由琼脂糖凝胶电泳造成的气溶胶污染问题,尤其适用于现场快速检测及床旁检测[16]。本研究建立的LAMP检测方法紫外分析仪下阳性结果为黄绿色,阴性结果为橘色,检测结果直观且容易分辨。
张福良等[17]建立的PCV1型荧光定量PCR检测方法检测限为1.0×104copies/μL。王立娇等[18]建立的PCV1与PCV2型双重PCR检测方法中PCV1的检测限为1.7×103copies/μL。本试验建立的PCV1 LAMP可视化快速检测方法检测限为1×101copies/μL。该方法为进一步研究PCV1在猪体内的分布情况、病毒的感染机制以及PCV1在PCV2致病机制中的作用奠定了基础,可用于PCV1的流行病学调查及其他PCV1相关研究。

