阿法替尼对人表皮生长因子受体突变阳性晚期NSCLC患者的治疗效果*
郑波,张敏
(1.鞍山市肿瘤医院 肿瘤内科,辽宁 鞍山 114000;2.北华大学 医学部,吉林 吉林 132001)
非小细胞肺癌(NSCLC)占肺癌总病例数的75%~85%[1],恶性程度较高,其5年内生存率低于20%[2]。化疗是NSCLC的主要治疗方法,但传统含铂类药物化疗方案治疗NSCLC效果并不理想[3],因此寻找新的治疗方案变得十分必要。人表皮生长因子受体(EGFR)具有酪氨酸激酶活性,属于是酪氨酸激酶生长因子受体家族成员之一,在已知众多实体瘤中均发现呈现明显高表达,其作用可能与新生血管生成、癌细胞侵袭、转移密切相关[4-5]。研究显示,EGFR在NSCLC患者中显著升高[6],临床将酪氨酸激酶抑制剂(EGFR-TIKs)作为NSCLC的靶向药物的实验研究,阿法替尼作为新一代的EGFR-TIKs,国外研究显示EGFR-TIKs对EGFR突变阳性的晚期NSCLC患者具有较好的疗效和安全性[7],但国内仍缺乏多中心、病例对照实验数据。故本研究选择91例NSCLC患者为研究对象,并根据DNA直接测序法结果分为EGFR野生型组及EGFR突变型组,野生型组给予常规化疗方案治疗,突变型组在野生型组的基础上增加阿法替尼口服治疗,观察阿法替尼的临床疗效,现报道如下。
1 对象与方法
1.1 研究对象
选择2017年1月—2019年5月接受诊治的晚期NSCLC患者为研究对象,纳入标准:(1)年龄40~70岁;(2)所有患者均经过病锂确诊为NSCLC;(3)TNM分期为ⅢB期或Ⅳ期;(4)预计生存期在3个月以上者。排除标准:(1)1月内EGFR-TKI治疗者;(2)合并肺部感染或肺结核活动期者;(3)妊娠期或哺乳期妇女及精神状态异常者;(4)不愿接受本研究实验计划者。共纳入91例晚期NSCLC患者为研究对象,依据DNA直接测序法检测的EGFR基因突变情况分为EGFR野生型组和EGFR突变型组,将19号外显子缺失或(和)21号外显子(L858R)突变视为EGFR突变阳性。本研究经医院伦理委员会同意(审批文号S-2016-015),所有患者均知情同意。
1.2 治疗方法
EGFR野生型组患者给予标准晚期NSCLC化疗方案[8],包括培美曲赛二钠+顺铂/卡铂方案(PP/C)、吉西他滨+顺铂/卡铂方案(GP/C)、紫杉醇+顺铂/卡铂方案(TP/C)等;培美曲赛二钠500 mg/m2、第1天给药,吉西他滨1 000 mg/m2、第1天和第8天给药,紫杉醇50 mg/m2、第1天给药,卡铂血药曲线下面积(AUC)=5、第1天给药,28 d为1个疗程,化疗3个疗程。EGFR突变型组患者在EGFR野生型组治疗的基础上增加阿法替尼口服治疗(德国勃林格殷格,国药准字J20170028)[9],初始剂量为40 mg/d;如无明显药物相关不良反应3周后可增量至50 mg/d,如果发生明显药物相关不良反应,可减量至 40、30及20 mg/d阿法替尼口服治疗,直至疾病进展期出现而结束。2组患者治疗期间,每月至少进行1次血尿粪常规、肝肾功能、肿瘤标志物、心电图及肿瘤病灶影像学检查。
1.3 观察指标
1.3.1药物治疗疗效评价 采用实体肿瘤药物治疗疗效评价标准(RECIST1.1)进行评估[10],每4 周进行1次评价,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD);CR为所有肿瘤病灶全部消失、且持续1个月以上,PR为肺CT显示肿瘤病灶缩小超过50%、且持续1个月以上,SD为介于PR与PD肿瘤病灶缩小未超过50%,或增大未超过25%,PD为肺CT显示肿瘤病灶增大超过25%、或出现新的肿瘤病灶。客观有效率(ORR)=(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%,无疾病进展时间(FPS)定义为治疗开始到肿瘤进展期出现或死亡时间[11],生存时间(OS)定义为开始治疗后至死亡时间。通过电话、微信及门诊就诊进行随访,随访截止时间为2020年6月。
1.3.2肿瘤标志物检测 所有患者均于早晨空腹促凝血管采集静脉血,3 000 r/min离心10 min分离血清,采用西门子XP全自动免疫分析仪及相关配套试剂进行检测癌胚抗原(CEA)、细胞角蛋白21-1(CYFRA21-1)、糖类抗原125(CA125)。于治疗前和治疗3月时各评价1次。
1.4 统计学方法
2 结果
2.1 一般资料
EGFR突变型组共有48例患者,19号外显子缺失有24例,21号外显子突变有20例,二者复合突变有4例;男22例、女26例,年龄40~68岁、中位年龄57岁;有吸烟史的26例(54.2%),病理类型包括腺癌28例(58.3%)、鳞癌6例(12.5%)、腺鳞癌7例(14.6%)、支气管肺泡癌7例(14.6%)。EGFR野生型组有43例,男19例、女24例,年龄41~70岁、中位年龄58岁。有吸烟史的23例(53.5%),病理类型包括腺癌25例(58.1%)、鳞癌4例(9.3%)、腺鳞癌5例(11.6%)、支气管肺泡癌9例(20.9%)。2组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
2.2 近期疗效
所有患者服药1月时比较近期疗效,全组无CR病例、PR33例(36.3%)、SD33例(36.3%)、PD25例(27.5%),ORR为36.3%,DCR为72.5%。在EGFR突变型组和野生型组比较中,EGFR突变型组的ORR和DCR高于野生型组,差异有统计学意义(P<0.05)。见表1。
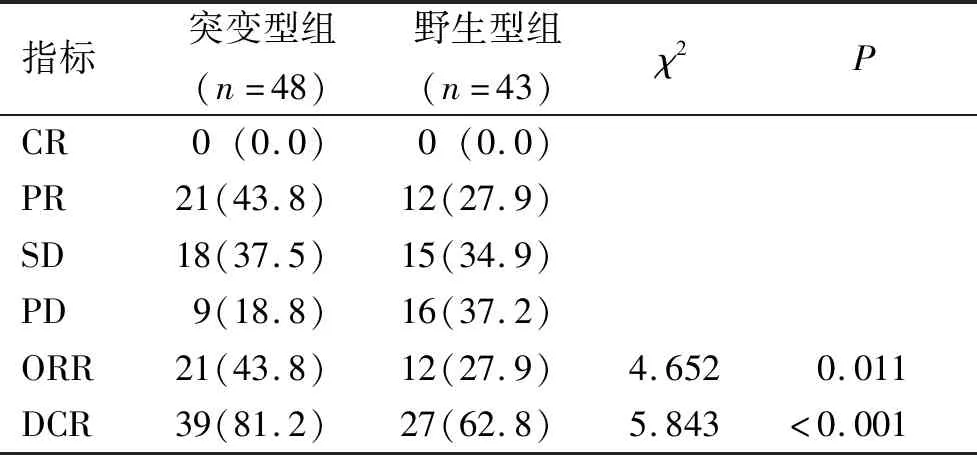
表1 EGFR突变型组与野生型组患者近期疗效比较[n(%)]Tab.1 Comparison of the short-term effects of EGFR mutant group and wild type group[n(%)]
2.3 肿瘤标志物水平
治疗前,2组患者肿瘤标志物水平比较差异无统计学意义(P>0.05)。治疗后,2组患者CEA、CYFRA21-1及CA125均较治疗前下降,差异有统计学意义(P<0.05),且EGFR突变型组低于EGFR野生型组,差异有统计学意义(P<0.05)。见表2。

表2 EGFR突变型组与野生型组治疗前后肿瘤标志物水平 [M(P25,P75),/(U/mL)] Tab.2 Level of tumor markers in EGFR mutant group and wild type group before and after treatment[M(P25,P75),/(U/mL)]
2.4 FPS和OS
FPS结果显示,全组FPS为3~14月,中位FPS为6.8月;EGFR突变型组FPS为5~14月,中位FPS为9.8月,EGFR野生型组FPS为3~15月,中位FPS为6.4月,EGFR突变型组中位FPS高于野生型组,经LogRank检验,差异有统计学意义(χ2=5.253,P<0.001),见图1。OS结果显示,全组OS为5~36月,中位OS为17.3月;EGFR突变型组OS为9~36月,中位OS为18.1月,EGFR野生型组OS为5~35月,中位OS为15.8月,EGFR突变型组中位OS高于野生型组,经LogRank检验,差异有统计学意义(χ2=3.014,P=0.035)。见图1。
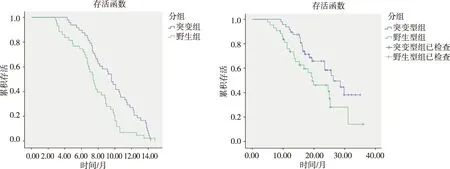
FPS曲线 OS曲线图1 EGFR突变型组与野生型组的FPS曲线及OS曲线结果Fig.1 Results of FPS and OS curves of EGFR mutant and wild type groups
2.5 不良反应
治疗期间,EGFR突变型组发生腹泻5例、皮疹3例、恶心呕吐2例、胃部不适1例,不良反应发生率为22.9%;野生型组发生腹泻6例、皮疹3例、肝功能异常1例、食欲下降2例,不良反应发生率为27.9%。2组患者不良反应发生率比较差异无统计学意义(χ2=1.632,P=0.226)。给予对症处理及减量治疗后均好转,无停药现象。2组患者均未出现骨髓抑制、间质性肺炎、严重肝肾功能不全等严重不良事件。
3 讨论
EGFR属于是酪氨酸激酶生长因子受体家族成员之一,在已知众多实体瘤中均发现呈现明显高表达,其作用可能与新生血管生成、癌细胞侵袭、转移密切相关[5]。以往文献报道约50%~80%NSCLC患者呈现出EGFR的高表达[12],因此以酪氨酸激酶抑制剂EGFR-TIKs作为NSCLC的靶向药物治疗是现阶段临床研究的热点[13]。NSCLC患者EGFR突变主要集中在外显子18~21,主要包括18外显子点突变(G719X)、19外显子缺失(delE746~E750)、20外显子插入和21外显子点突变(L858R),以19外显子缺失和21外显子突变最为常见,发生率约为80%~90%,也是NSCLC靶向治疗敏感性较高的突变位点[14]。
第一代EGFR-TIKs主要有吉非替尼、埃克替尼等,多期临床实验证实可显著改善EGFR突变阳性的NSCLC患者ORR和DCR,延长FPS,但多数患者于10月后出现耐药现象,甚至病情进展[15]。因此,寻找新型有效靶向药物已成必然。阿法替尼作为第二代EGFR-TIKs,能够不可逆与EGFR和HER2双靶点进行结合,抑制酪氨酸激酶生物学活性[16],继而延缓肿瘤进程,提高癌症患者生活质量。Bergfeld等[17]报道了随机开放的比较阿法替尼疗效的三期临床试验,共纳入316例EGFR突变的晚期肺腺癌患者,分组为阿法替尼治疗组和培美曲塞联合顺铂治疗组,实验数据显示2组患者ORR为56.1%及22.6%(P<0.001),中位FPS分布是10.5及6.2月(P<0.05),以19外显子缺失和21外显子突变病例中,中位FPS分别是10.8及6.4月(P<0.05),实验结果显示阿法替尼可以显著延长EGFR突变肺癌患者的FPS,提高疾病缓解率。
阿法替尼是于2013年由美国FDA批准用于治疗(EGFR突变阳性的NSCLC,并于2016年在中国获批使用。而目前国内缺乏阿法替尼多中心、病例对照的实验数据[18],故本研究选择91例晚期NSCLC患者为研究对象,依据DNA直接测序法将19号外显子缺失或/和21号外显子(L858R)突变视为EGFR突变阳性。EGFR突变型组共有48例患者,发生率为52.7%,这与Ye等[19]调查亚裔人群肺腺癌患者EGFR突变阳性率为50.3%相接近。近期疗效比较中,EGFR突变型组的ORR及DCR分别是43.8%及82.2%,明显高于野生型组的27.9%及62.8%,提示阿法替尼可有效缓解EGFR突变阳性NSCLC患者的临床症状。肿瘤标志物是评价恶性疾病患者治疗预后的有效指标,而CEA、CYFRA21-1和CA125是目前评估非小细胞肺癌常用指标[20],结果显示,EGFR突变型组与野生型组患者经治疗后这3个指标均有明显下降,提示治疗有效性 。且EGFR突变型组治疗后的CEA、CYFRA21-1及CA125水平明显低于EGFR野生型组,进一步说明阿法替尼作为靶向药物治疗的良好临床疗效。
FPS可有效反映药物对于病情的控制效果,相比于OS则显著缩短随访时间[21],EGFR突变型组FPS为5~14月,中位FPS为9.8月,高于EGFR野生型组中位FPS的6.4月,提示阿法替尼对于EGFR突变阳性NSCLC患者的的近期疗效显著。对比国内研究,张丽等[22]采用阿法替尼治疗晚期NSCLC患者,对于EGFR突变阳性NSCLC患者的中位FPS为10.1月,野生型和突变状态未知的中位FPS为5.3月,其结果和结论与本研究较为接近。OS则更能反映化疗药物的长期疗效,是评估化疗药物疗效的最有利证据[23]。本研究结果显示EGFR突变型组OS为9~36月,中位OS为18.1月,高于EGFR野生型组中位OS的15.8月,进一步证实阿法替尼于EGFR突变阳性NSCLC患者的的优越疗效。刘涛等[24]同样采用阿法替尼治疗EGFR突变阳性NSCLC患者,其中位OS为17.8月,与本实验数据较为接近。安全性评估中,本研究阿法替尼治疗常见的不良反应为腹泻、皮疹和胃肠功能不适,这和国外相关文献报道的阿法替尼不良反应类型相一致[25],EGFR突变型组和野生型组间不良反应比较差异不明显,且均未见严重不良事件,提示药物治疗安全性较好。
综上所述,针对EGFR突变阳性晚期NSCLC患者的靶向治疗,阿法替尼可提高ORR及DCR,延长FPS及OS,药物安全性较好。但由于本研究观察例数偏少、缺乏多中心研究数据,其实验结论仍需要进一步临床研究予以观察和证实。

