梗阻性黄疸大鼠脂质代谢及肝型脂肪酸结合蛋白的变化*
李福堂,王惠群,杨大刚,孙诚谊,郭平平
(1.贵州医科大学附属白云医院 肝胆外科,贵州 贵阳 550000;2.贵州医科大学 公共卫生学院,贵州 贵阳 550000;3.贵州医科大学附属医院 肝胆外科,贵州 贵阳 550000)
梗阻性黄疸(obstructive jaundice,OJ) 是肝胆外科常见疾病,是指肝内毛细胆管、小胆管、肝胆管、肝总管或胆总管的机械性梗阻,导致胆汁排泄障碍、胆汁淤积,整个胆道系统压力增高,胆红素逆流入血而形成的组织黄染,主要病因是胆石症和恶性肿瘤[1]。梗阻性黄疸病人可引起机体各器官的损害,其中肝脏损害最为严重,其损害机理包括胃肠道细菌移位和内毒素血症[2]、氧自由基的损伤作用[3]、能量代谢障碍[4]、机体免疫功能受损[5]、肝细胞凋亡[6]以及钙稳态失调等,其中氧自由基的损伤及能量代谢障碍在OJ的脂质代谢中起重要角色,脂质过氧化是OJ器官损伤的最重要的机制之一。肝型脂肪酸结合蛋白(liver type fatty acid binding protein,L-FABP)在OJ过程中的表达与游离脂肪酸(free fatty acid,FFA)代谢及肝脏氧化应激损伤密切相关,因此了解梗黄过程中脂质代谢及L-FABP的变化对OJ患者的临床治疗具有重要意义,而OJ的脂质代谢及L-FABP变化的研究鲜有报道。因此本研究期望通过建立OJ大鼠模型,检测在OJ发生及进展过程中脂质代谢及L-FABP的变化,探讨L-FABP在其中的作用,为OJ患者的临床治疗提供理论依据。
1 材料与方法
1.1 实验动物及主要仪器、试剂
选取54只体质量为(280±30)g的健康雄性Sprague Dawley(SD)大鼠,由贵州医科大学动物中心提供[许可证号SCXK(黔)2018-0001];德国西门子公司西门子ADVIA2400全自动生化分析仪(德国西门子公司),总胆固醇、高密度脂蛋白、低密度脂蛋白试剂盒(上海科华生物工程股份有限公司),上海科华东菱诊断用品有限公司甘油三脂检测试剂盒(上海科华东菱诊断用品有限公司),Rat low density lipoprotein(VLDL、FFA、OxLDL、Lp-X、L-FABP)ELISA Kit(美国R&D公司)。
1.2 方法
1.2.1实验分组 大鼠适应性喂养1周后,完全随机分成正常对照组(A组)、假手术组(B组)和胆总管结扎组(C组)共3组,每组18只。C组大鼠,均采用10%水合氯醛按3 mg/kg腹腔注射麻醉,麻醉成功后,固定、备皮,每组取6只大鼠,碘伏、75%乙醇消毒手术野;正中切口约3 cm,解剖肝蒂,游离出胆总管后,以2-0号丝线双重结扎胆总管,关闭腹膜腔,切开处常规消毒;B组,大鼠仅游离胆总管,不结扎,其余操作同C组;A组,不作任何处理。分别于术后第5、12和19天,每组取6只大鼠固定后,切开一侧腹股沟部位的皮肤,分离暴露股动脉,再用血管钳将其挑起,用剪刀剪断血管后直接用常规生化试管及带有枸橼酸钠抗凝剂的试管取血,每只大鼠采全血3~4 mL检测下列指标。
1.2.2大鼠一般情况及肝脏组织肉眼观察 观察3组大鼠3个时间点的一般情况(大鼠的精神、食欲、皮肤及巩膜的颜色、大小便颜色)、解剖后胆总管结扎部位以及肝脏颜色、硬度。
1.2.3检测指标及方法 谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspertate aminotransferase,AST)、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、间接胆红素(indirect bilirubin,IBIL)、甘油三脂(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(high density lipoprotein,HDL)、低密度脂蛋白(low density lipoprotein,LDL)用西门子ADVIA2400全自动生化分析仪测定。肝型脂肪酸结合蛋白(L-FABP)、氧化型低密度脂蛋白(oxidized low density lipoprotein,Ox-LDL)、极低密度脂蛋白(very low density lipoprotein,VLDL)、游离脂肪酸(free fatty acid,FFA)、阻塞性脂蛋白X(lipoprotein X,LPx)分别按照ELISA试剂盒说明书测定。
1.3 统计学方法
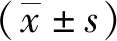
2 结果
2.1 一般情况观察和肝脏组织肉眼观察
观察整个实验过程中A、B、C组一般情况,A组大鼠一般情况及肝脏组织肉眼观察无特殊;B组术后1~4 d仅有食欲不振,精神稍差,体重稍减少,后逐渐恢复和A组一样;C组术后2~3 d,大鼠出现皮肤、巩膜黄染并逐渐加深,尿色深黄,食欲减退,体质量逐渐减轻。开腹后见A组和B组腹腔无特殊,而C组大鼠可见术后5 d近肝门部胆总管囊状扩张充满胆汁,术后12 d肝脏弥漫性肿大、呈黄褐色,术后19 d肝脏质地变硬。见图1。
2.2 术后第5天血清LPx、ALT、AST、TBIL及DBIL
C组大鼠血清LPx、ALT、AST、TBIL及DBIL表达高于A组和B组,差异有统计学意义(P<0.05);而B组与A组比较,差异无统计学意义(P>0.05)。见表1。
注:a为A组正常肝脏组织;b为A组正常的胆总管;c为B组肝脏;d、e为术后5 d胆总管及肝脏,结扎后胆总管囊性扩张,肝脏呈黄褐色;f为术后12 d胆总管及肝脏;g为术后19 d胆总管及肝脏。图1 A、B、C组肝脏组织肉眼观察Fig.1 Visual inspection of hepatic tissue of rats in Goup A ,B,and C
表1 各组大鼠血清中LPx、ALT、AST、TBIL及DBIL的变化Tab.1 Comparison of serum LPx,ALT,AST,TBIL,and DBIL of rats in each
2.3 血脂指标
结果显示,术后第5天,C组TC、TG、HDL以及LDL明显高于A组及B组,差异有统计学意义(P<0.01)。术后第12天,C组TC、LDL高于A组及B组,差异有统计学意义(P<0.05)。术后第19天,C组TC、LDL、VLDL、Ox-LDL高于A组和B组,差异有统计学意义(P<0.05),而FFA低于A组和B组,差异具有统计学意义(P<0.05)。见表2。
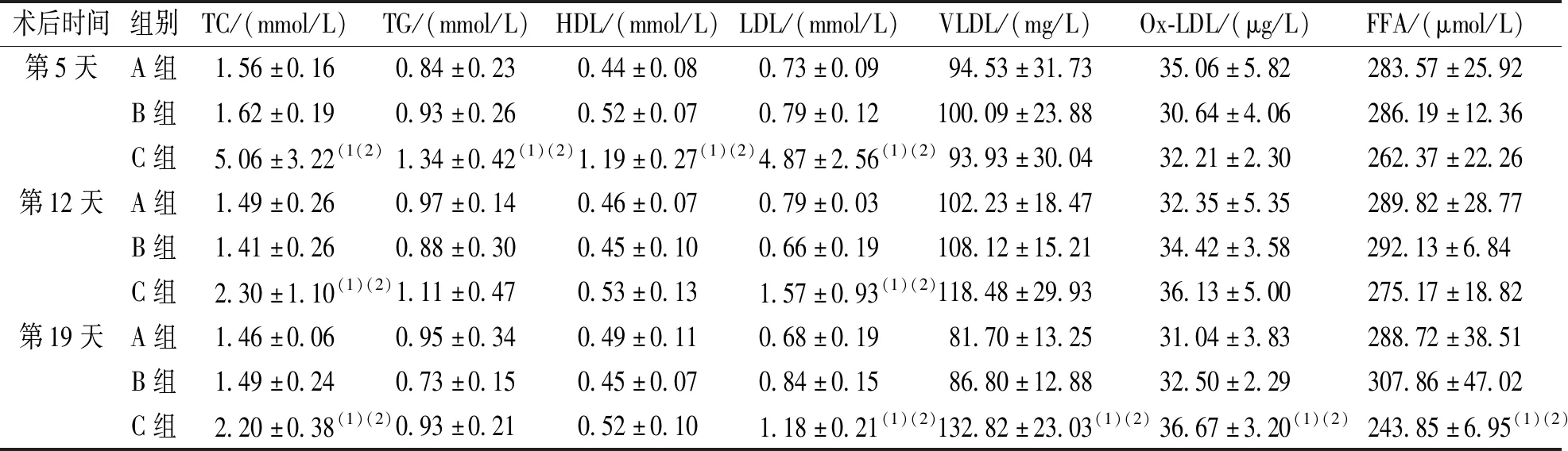
表2 各组大鼠血脂指标的变化Tab.2 Changes in lipid profile of rats in each group
2.4 血清L-FABP水平
术后第5天和第12天,C组术后血清中L-FABP高于A组及B组,差异具有统计学意义(P<0.05);术后第19天,A组与C组、B组与C组比较,差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠3个时间点L-FABP水平Tab.3 Changes of serum L-FABP of rats in each group at three time points
3 讨论
胆道结扎术后5 d,C组大鼠的TC明显增高,其原因为:(1)胆汁酸能反馈抑制7a-羟化酶,抑制胆汁酸合成,使TC代谢去路受阻,在血中积聚;(2)胆道压力增高[7],TC随胆汁逆流入血,使血中TC 的含量增高;(3)梗阻性黄疸,肝功能受损,肝脏合成胆红素减少,消耗胆固醇减少。血清总胆固醇升高,随着梗阻时间延长,胆总管内压力不断增加,胆管直径不断增宽,当胆管内压力同胆管壁的回应力相等时,胆管内压力不再增加[8],致使TC随胆汁逆流入血减少,同时体内消耗部分TC;(4)L-FABP在肝中胆固醇聚集有重要调节作用[9],此为C组术后12和19 d时逐渐下降原因所在。正如Martin等[10]用敲除L-FABP雄性小鼠研究发现高胆固醇膳食后,L-FABP可能成为雄性小鼠胆汁酸合成、肝中胆固醇聚集的重要调节因素。
胆道结扎术后第5天C组血清中TG明显增高,后逐渐降低,第12、19天降为正常;研究表明,TG在梗阻早期是增加,L-FABP的基因多态性也可造成TG升高[11],肝脏严重损害后TG降低。梗阻性黄疸病人还同时存在高TG血症,可能与TG血清清除率降低有关[12]。血清中FFA逐渐减少,原因为:(1)胆总管结扎后食欲不振,造成摄入不足;(2)胆道梗阻时,胆汁不能顺利排入肠道,胰脂肪酶无法被激活,导致脂肪消化吸收不良;(3)脂肪动员加速,使体内FFA减少。L-FABP膜间的脂肪酸转运需要3步,供体膜分离、水相扩散和受体膜连接,每步都是双向可逆的,其由供体到受体膜转运脂肪酸的转运有3种机制[13]:(1)脂肪酸自动发生转运,但其转运率很低;(2)由非膜激活型受体协助,扩散是通过增加溶解的脂肪酸浓度来进行的;(3)由膜激活型受体介导发生,促进与受体膜作用过程中的分离与重新结合。
TC在血液中与载脂蛋白(apo)结合,以可溶性脂蛋白的形式存在,其中3/4存在于LDL中,1/4存在于HDL中[14],故HDL、LDL与TC的变化趋势相似,胆道结扎术后5 d时C组血清中含量最高,后逐渐下降,LDL占TC量多,LDL降低缓慢。LDL在胆道结扎术后5 d时升高还与梗阻性黄疸时血清中出现异常LDL即脂蛋白x有关。HDL的代谢受许多生理和病理条件的影响,在梗阻性黄疸病人,肝静脉系统内的胆盐浓度远远高于可造成细胞损害的浓度(3~6 mmol/L),因此胆盐破坏效应增强,HDL稳定性降低[15]。梗阻性黄疸时卵磷脂胆固醇酰基转移酶(LCAT)活性降低、合成减少,使胆固醇酯化出现障碍,HDL生成减少。HDL与脂多糖(LPS)的结合能有效地封闭LPS的活性中心,竞争性抑制LPS与其受体结合,降低LPS对靶细胞的激活作用,减少炎症介质的释放,从而缓解LPS引起的炎症反应[16],这个机制会使HDL分解增加、浓度下降,而且HDL降幅与疾病严重程度相关[17]。
胆总管结扎术后第5天和12天,C组Ox-LDL与A组及B组无明显差异,随梗阻时间延长,肝脏损害加重,术后第19天时梗阻性黄疸大鼠出现肝硬化,C组Ox-LDL明显高于A组及B组。研究发现梗阻性黄疸改变了机体氧化应激的平衡状态,能加剧肝脏纤维化的发展[18]。脂质是机体发生氧化应激的主要作用底物,而 Ox-LDL又是脂质氧化应激的产物,能诱导内皮细胞的功能紊乱和平滑肌细胞的增生。以往认为Ox-LDL是动脉粥样硬化的重要危险因素[19],近年来研究发现 Ox-LDL能促进胶原纤维的降解,使细胞外基质发生紊乱,而肝脏的内皮细胞、巨噬细胞和枯否细胞中也存在 Ox-LDL特定的受体,Ox-LDL可能促进肝脏纤维化甚至诱导肝硬化[20]。
L-FABP是肝脏内唯一表达的脂肪酸结合蛋白,其结合并转运脂肪酸。肝脏细胞中L-FABP主要在肝细胞胞质中,在正常血清中L-FABP含量较低,胆总管结扎后肝细胞受损,肝细胞膜通透性变化可使其快速溢出质量较小的L-FABP,释放入血,使血浆L-FABP浓度上升,因此在术后5 d时L-FABP升高,并在12 d时达到高峰。随梗阻性黄疸时间延长,肝脏严重损害时,肝脏合成分泌L-FABP减少,进而血浆中的L-FABP浓度减少,至19d时明显低于5d与12d的浓度,与A组及B组无明显差异。目前研究成果,L-FABP参与脂质代谢的调控机制主要有[21]:(1)通过对脂肪酸的调控来影响脂质代谢,将脂肪酸从细胞膜转运到代谢场所,比如L-FABP结合长链脂肪酸并转运至β氧化场所及磷脂和TG的合成部位;(2)影响脂质代谢酶的活性来调控脂质代谢,L-FABP增强脂质代谢酶的活性,提高对脂肪的吸收能力;(3)对激素的介导作用来影响脂质代谢;(4)L-FABP能维持FFA的平衡,L-FABP结合脂肪酸,使体内FFA维持相对平衡状态;(5)L-FABP具有维持脂质代谢内环境的稳定,作为脂肪酸和胰腺辅酶A生化反应的辅助因子影响胞质内脂肪酸分室化,并缓冲辅酶A级长链脂肪酸对机体的副作用。
此外,L-FABP的改变与氧化应激状态及抗氧化能力的改变有关,在梗阻性黄疸5~12 d时,为对抗氧化应激的加重,机体的L-FABP增加。Yan等[22]用L-FABP的cDNA转录模型证实了L-FABP有抗氧化活性,发现与缺乏L-FABP肝细胞比较,含L-FABP的肝细胞能更明显减少细胞内活性氧的水平。Wang等[23]运用胆管结扎大鼠模型研究L-FABP在肝脏的表达及抗氧化作用,结果显示L-FABP表达上升后,ROS水平降低,肝功能血清总胆红素、谷丙转氨酶等指标改善和血氨减少;在另一个将L-FABP基因转染至张氏肝细胞的研究中,发现L-FABP可以减轻H2O2、缺氧所导致的氧化应激损伤,提示L-FABP在肝细胞氧化应激中有重要的抗氧化功能。L-FABP结构中有1个半胱氨酸和7个甲硫氨酸,具有抗氧化作用,这些残基可参与巯基的氧化还原,提高还原性谷胱甘肽的生成率。除此之外,L-FABP对脂肪酸和脂质过氧化产物有高亲和力和结合能力,发挥内源性抗氧化剂的重要作用,维持细胞内脂质的平衡[24]。在生理状态下,FFA与白蛋白结合,在线粒体或过氧化酶体内氧化供能[25],在梗阻性黄疸,FFA可造成细胞内膜性结构如线粒体的肿胀等,还能形成ROS激活并诱导产生细胞因子,发生持续的肝细胞坏死和凋亡,并且加重肝细胞脂肪变性进展为脂肪肝,纤维化甚至肝硬化。L-FABP抗氧化作用及机制:在正常生理条件下,机体细胞内氧自由基与超氧化物歧化酶、谷胱甘肽和过氧化氢酶等抗氧化酶类系统保持动态平衡[26],在梗阻性黄疸状态下此动态平衡打破,L-FABP结构中的半胱氨酸结合疏水性配体,能有效清除自由基,或作为抗氧化剂参与S-硫醇化/去硫醇化[25]。L-FABP中的甲硫氨酸氧化成亚砜甲硫氨酸,抑制了肝细胞的氧化应激,同时把甲硫氨酸亚砜还原酶还原成甲硫氨酸。这一系列催化反应的净化效果是活性氧转化为无害产物,驱动NADPH氧化反应。在梗阻性黄疸中甲硫氨酸氧化-还原循环发挥着重要的抗氧化作用。此外,L-FABP与ROS反应来阻止磷脂氧化反应的扩大,从而保护细胞膜不被破坏,L-FABP还通过结合多不饱和脂肪酸来调节脂肪酸在细胞内氧化途径的利用度,从而控制ROS的释放量,同时L-FABP可能是通过调节FFA的代谢和发挥抗氧化作用来减轻氧化应激损伤[27]。L-FABP在梗阻性黄疸的脂质代谢起着重要调节作用,可为梗阻性黄疸患者的治疗提供新的治疗靶点。

