羧甲基壳聚糖复合纳米银、纳米氧化铜的制备及抑菌性研究*
开梓翔,刘春,2△,刘宇翔,徐彬,郭亚雄
(1.山西医科大学第一临床医学院,太原 030001;2.山西医科大学第一医院泌尿外科,太原 030001)
1 引 言
细菌感染给医疗、公共卫生、社会经济带来了巨大的压力[1-2],过量和不当使用抗生素对抗细菌,易导致细菌基因突变产生耐药性,给生物安全带来了巨大的威胁[3-4]。近年来,许多研究致力于开发非抗生素类抗菌剂,其中纳米银(Ag nanoparticles,Ag NPs)和纳米氧化铜(CuO nanoparticles,CuO NPs)作为无机抗菌剂的代表,具有广谱抗菌作用,且不易产生细菌耐药,获得了极高的关注[5-6]。制备纳米级金属粒子的关键是还原剂的选择。使用水合肼作还原剂制备Ag NPs[7],毒副作用强不适于医用;利用海藻酸钠[8]或獐牙菜提取物[9]等天然化合物,又存在工艺复杂、制备时间长等缺陷。Raghavendra等[10]成功利用壳聚糖制备出CuO NPs,却依旧无法避免需要特殊处理以增强壳聚糖水溶性的问题。羧甲基壳聚糖(carboxymethyl chitosan,CMCS)作为一种壳聚糖的衍生物来源广价格低,具有还原能力,能促进伤口愈合,且生物相容性良好、无毒、绿色环保,同时还具有一定的广谱抗菌能力[11-12],相比于壳聚糖水溶性更强。本研究利用CMCS的还原稳定性,在碱性体系下通过水热法制备羧甲基壳聚糖复合纳米银(CMCS-Ag NPs)以及羧甲基壳聚糖复合纳米氧化铜(CMCS- CuO NPs),并测试比较其体外抑制大肠杆菌的能力,为开发医用抗菌材料提供一种选择方案。
2 材料与方法
2.1 材料制备
2.1.1主要原料和试剂 CMCS(分子量9 000 Da),上海麦克林生化科技有限公司;AgNO3、CuSO4·5H2O、NaOH,天津科密欧化学试剂有限公司;大肠杆菌,山西医科大学第一医院医学检验科;所有溶液均采用实验室自制去离子水配制。
2.1.2分析测试仪器 UV-1800型紫外可见光分光度计(UV-vis),扫描范围200~800 nm,扫描步长0.5 nm,日本Shimadzu公司;D8 Advance型X射线粉末衍射仪(XRD),扫描范围5~85°,扫描步长0.5°,德国BRUKER公司;JEM2010型透射电子显微镜(TEM),分辨率1.9 Å,工作电压120 kv,日本JEOL公司。
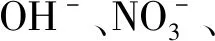
2.1.4CMCS- CuO NPs的制备 在室温条件下,将90 mg CuSO4·5H2O和45 mg CMCS分别溶于10 mL的去离子水中。在60℃下,将CuSO4溶液缓慢滴加入CMCS溶液中并恒温恒速搅拌15 min后,升温至100℃,利用NaOH溶液调节PH至碱性。保持碱性环境反应30~40 min,溶液逐渐由淡蓝色变为黑色悬浊液。将混合溶液透析去杂质后,采用真空冷冻干燥法,得到黑色的CMCS- CuO NPs粉末。
2.1.5大肠杆菌的培养 将大肠杆菌以平板划线法接种于营养琼脂培养基上,在恒温恒湿培养箱中培养24 h。取较大的细菌菌落转移到营养肉汤培养基中,恒温震荡培养24 h。抽取营养肉汤培养基中的菌液,用PBS缓冲液反复离心洗涤后,根据麦氏比浊法用OD值调整稀释菌液浓度,以获得一定浓度的细菌悬液(大约4×108CFU/mL)。用PBS缓冲液制备一系列浓度梯度的细菌悬液以备后用。
2.2 表征测试
2.2.1实验制备的样品进行表征测试 UV-vis可显示单质银的特征吸收峰,通过XRD分析得到衍射图谱确定物质的成分等。TEM可以观察样品的形貌、粒径尺寸、粒态分布等。
2.2.2用平板菌落计数法分别测定CMCS-Ag NPs、CMCS- CuO NPs的抗菌活性 根据文献[13]所展示的方法进行改良抗菌试验。实验组将一定质量的CMCS-Ag NPs和CMCS- CuO NPs分别溶入到10 mL的大肠杆菌悬浊液(105CFU/mL)中,记为A组(2 mg/100 mL CMCS-Ag NPs)、B组(4 mg/100 mL CMCS-Ag NPs)、C组(2 mg/100 mL CMCS- CuO NPs)、D组(4 mg/100 mL CMCS-CuO NPs),对照组采用同条件下等量的未溶入抗菌材料的大肠杆菌悬浊液(105CFU/mL)。实验组、对照组均在37℃恒温条件下,摇床震荡培养18~24 h,然后将各组分别用移液枪抽取100 μL混合溶液,滴到营养琼脂培养基上进行划线涂板(每组涂板三份)。将各组平板在37℃下恒温恒湿培养24 h后进行活菌落计数。相同条件下不同时间内重复三次上述实验。抑菌率计算采用以下公式:
抑菌率(%)=(对照组菌落数-实验组菌落数)/对照组菌落数×100
3 结果与讨论
3.1 CMCS-Ag NPs 和CMCS- CuO NPs的溶液表观
CMCS-Ag NPs溶液呈黄褐色、溶解度高、水溶性良好,与之对比CMCS- CuO NPs溶液呈黑色、悬浊状,溶解度相对较低。静置120 d后,所有CMCS-Ag NPs样品溶液均无结块或沉淀,也无明显的颜色变化;CMCS- CuO NPs样品悬浊液出现沉降现象。由于Ag NPs易氧化,利用UV-vis测定静置后的CMCS-Ag NPs样品溶液,对比发现,光谱无明显变化,说明该方法制备的CMCS-Ag NPs 不易氧化,具有较高的稳定性。CMCS起到还原剂、稳定剂的作用,吸附在Ag NPs和CuO NPs表面,防止纳米粒子团聚,且能不同程度改善二者溶解性,CMCS-Ag NPs的溶解性更强。
3.2 CMCS-Ag NPs 和CMCS- CuO NPs的表征
CMCS-Ag NPs溶解性强,可以利用UV-vis的紫外可见光谱研究确定溶液中Ag NPs的存在,这是由于它在紫外可见区(380~450 nm)激发了表面等离子体共振,因此该实验被认为是一种简单而敏感的表征银纳米粒子的技术[14]。紫外可见光谱研究展示所有的CMCS-Ag NPs样品均在约410 nm左右表现出Ag NPs的特征吸收峰,且吸收带较窄,说明Ag NPs粒子的直径分布较窄。由于CMCS- CuO溶液呈悬浊状,无法行UV-vis测试。CMCS-Ag NPs 和CMCS- CuO NPs的XRD测试结果与标准卡片对比,分别证明含有单质银或氧化铜的特征衍射峰,未出现其他杂质的衍射峰,说明复合材料杂质少较纯净。TEM测试了CMCS-Ag NPs 、CMCS- CuO NPs的形貌和粒态分布,结果表明,本研究制备的CMCS-Ag NPs、CMCS- CuO NPs在CMCS基体中均具有良好的分散性,颗粒尺寸直径相近,几乎不存在团聚现象。CMCS-Ag NPs复合材料中的Ag NPs粒子大部分为球形或近似球形,尺寸集中分布在20~30 nm(见图1),CMCS- CuO NPs复合材料中的CuO NPs呈现典型四叶花瓣状结构,尺寸集中于80~100 nm(见图2)。

图1 CMCS-Ag NPs的TEM图谱Fig.1 TEM spectra of CMCS-Ag NPs

图2 CMCS- CuO NPs的TEM图谱Fig.2 TEM spectra of CMCS- CuO NPs
3.3 CMCS-Ag NPs 和CMCS- CuO NPs的体外抑菌对比研究
大肠杆菌是最常见的人类致病菌之一,革兰氏染色阴性,可通过不同的毒力因子如毒素、菌毛、脂多糖等诱发感染[15]。近年来,临床上抗生素类抗菌药物的广泛使用,加速了大肠杆菌等致病菌的耐药基因突变,使其耐药性大大增加,严重危害生物安全,因此亟待开发新型抗菌制剂以规避以大肠杆菌为代表的致病菌产生耐药性的问题。
本研究制备的CMCS-Ag NPs 和CMCS- CuO NPs复合材料均具有极强的抑制大肠杆菌的能力。抑菌试验结果显示,A组、B组的大肠杆菌抑菌率分别为(92.6±0.8)%和(97.8±1.9)%(P<0.05),表明CMCS-Ag NPs对于大肠杆菌具有明显的杀菌作用。有研究认为,Ag NPs可以通过产生自由基来破坏细菌细胞膜的通透性,降低某些膜酶的活性,导致错误的的营养和信号供应,最终产生致命的损伤引发大肠杆菌死亡[16-17]。而对于CMCS- CuO NPs,实验显示C组、D组的抑菌率分别为(89.4±1.4)%、(95.3±1.6)%(P<0.05),这可能是由于CuO NPs能穿透细菌细胞膜或包裹于细胞膜之中,诱导细菌细胞质泄露,剥夺其与外界物质交换的能力,最终加速细菌裂解[18]。因此,实验结果表明,CMCS-Ag NPs 和CMCS- CuO NPs均具有明显的抑制大肠杆菌的能力,但前者更佳。CMCS-Ag NPs在低浓度(2 mg/100 mL)下就可以表现出杀菌效果,而在此浓度下CMCS- CuO NPs仅表现出抑菌效果,在较高浓度(4 mg/100 mL)下二者均表现出杀菌效果;同时该抑菌能力呈现剂量依赖性,相比于低浓度的A组、C组(2 mg/100 mL)而言,高浓度的B组、D组(4 mg/100 mL)抑菌率更高(见图3)。
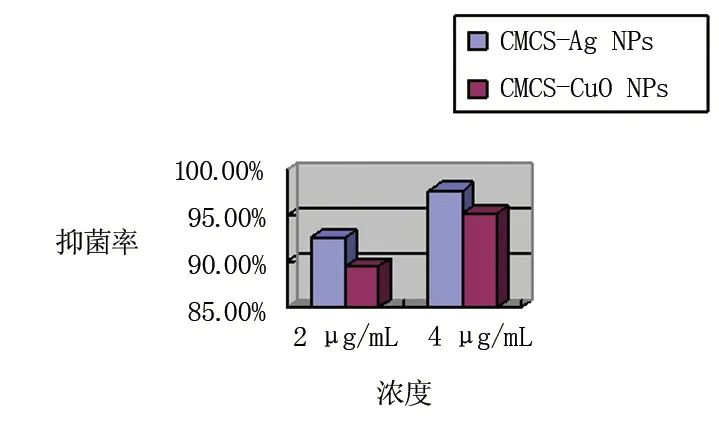
图3 不同浓度 CMCS-Ag NPs 和CMCS- CuO NPs的抑菌率对比
传统抑菌剂主要是抗生素类药物,通过不同方式破坏不同种类细菌的细胞膜或者干扰细菌遗传物质,从而抑制或杀死细菌。然而抗生素类药物通常仅针对某一类细菌,单一使用难以达到广谱杀菌效果,且使用过程中容易引发细菌基因突变产生耐药性,危害生物安全[3]。革兰氏阳性或阴性菌表面通常携带负电荷,而微小的纳米级金属类不仅可以穿透细胞膜,还可以通过释放阳离子产生静电作用破坏细胞膜,从而杀死细菌。此外,纳米金属类产生的氧自由基对杀菌也起到了重要作用[19]。因此,纳米级金属类抗菌剂的杀菌方式决定其拥有广谱抗菌能力,针对革兰氏阳性或阴性菌均能发挥效应,而且不易产生细菌耐药,相较抗生素类药物抗菌性能优秀且更有利于生物安全。
3.4 讨论
细菌感染是医学中十分突出的问题,抗生素的应用是百年来最具成效的解决办法,然而随着临床观察与研究,抗生素的耐药问题已不容忽视。无机抗菌剂的代表Ag NPs及CuO NPs具有极佳的抗菌性能,然而易团聚、稳定性差。许多研究者采用化学制剂等作为还原稳定剂,过程复杂、难以提纯、毒性高,不利于应用于人体[7,20]。CMCS属于壳聚糖的衍生物,来源广泛且具有广谱抗菌、止血等功效,尤其还具备还原稳定性,在医药领域逐渐受到重视。结合CMCS的还原稳定特性以及纳米级金属或金属氧化物的广谱抗菌性,本研究制备了CMCS-Ag NPs及CMCS- CuO NPs复合型纳米抗菌剂,原材料来源广、工艺简单且绿色,未引入毒性高的化学还原剂。制备的Ag NPs粒子尺寸20~30 nm,CuO NPs粒子尺寸80~100 nm,与其他研究者报道的Ag NPs粒子尺寸10~55 nm[8-9]、CuO NPs粒子尺寸20~600 nm[10,21]相比,尺寸类似甚至相对较小,而小尺寸的纳米级金属的抗菌性能强[22],同时稳定性高,水溶性佳,溶液状态均质且稳定,易于通过液态反应与其他物质掺杂以便进一步应用。通过平板菌落计数法测试比较针对最常见的致病菌即革兰氏阴性大肠杆菌,实验结果显示,二者均具有极强的剂量依赖性的抑菌能力,相同浓度对比CMCS-Ag NPs的抑菌能力优于CMCS- CuO NPs,2 mg/100 mL浓度下的CMCS-Ag NPs便可抑制90%以上的大肠杆菌,呈现杀菌效应;而CMCS- CuO NPs在4 mg/100 mL下可以表现出杀菌效果。本研究目前仅针对具有代表性的革兰氏阴性大肠杆菌进行抑菌研究,未进行生物相容性评价,后续可根据不同的抗菌应用方向,针对性地补充相关菌种的抗菌研究及生物相容性评估。当前已有研究将CMCS-Ag NPs、CMCS- CuO NPs应用于医用敷料[23]等,未来本研究将进一步改良,将CMCS-Ag NPs及CMCS- CuO NPs复合型纳米抗菌剂开发更广泛的用途。
4 结论
本研究以Ag NPs和CuO NPs粒子与CMCS相结合制备了复合型纳米抗菌剂。在碱性环境下,通过水热法利用CMCS将Ag+、Cu2+氧化成Ag NPs或CuO NPs,并保持粒子的稳定。通过UV-vis和XRD分析证实了CMCS基质中Ag NP或CuO NPs粒子的形成。TEM显示Ag NPs粒子为球形或近似球形,尺寸为20~30 nm,CuO NPs为四叶花瓣状,尺寸约80~100 nm。研究制备的两种复合型纳米抗菌剂对大肠杆菌均具有良好的抑制作用。基于以上结果,本研究制备的CMCS-Ag NPs及CMCS- CuO NPs复合型纳米抗菌剂,在后续进行进一步的实验改良和研究评价,有望应用于不同的生物医学领域和医药行业,发挥抗菌、抗感染的功效。

