组织CXCL13和Dyrk1b表达预测卵巢癌预后的临床意义
朱怡
卵巢癌是女性生殖系统的常见恶性肿瘤,其死亡率占女性恶性肿瘤之首,并且在我国近年来的发病率呈上升趋势,严重威胁和影响女性的身体健康和生命安全[1]。卵巢癌的发病无典型的临床特征和体征,发现时往往已经属于晚期。CXCL13在结直肠癌、胃癌、乳腺癌和宫颈癌等多种肿瘤浸润,血管形成和肿瘤的发生发展中具有明显的相关性[2-4]。双特异性酪氨酸磷酸化调节激酶1b(Dyrk1b)在乳腺癌、胰腺癌、卵巢癌和胃癌等肿瘤呈高表达,而在正常组织呈表达或者不表达,参与了肿瘤的发生发展[5]。本研究通过免疫组织化学的方法对卵巢癌组织进行检测,观察其表达与临床病理因素和预后的影响。
1 资料与方法
1.1 一般资料 回顾性分析2012年1月至2016年1月在我院行手术治疗的卵巢癌患者116例为卵巢癌组,年龄31~76岁,平均年龄(56.37±12.38)岁;组织类型:浆液性101例,非浆液性15例;分化程度:高分化29例,中分化23例和低分化64例;FIGO分期:Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期98例;淋巴结转移:转移61例,无转移55例;腹腔积液:有71例,无45例。患者均行病理确诊卵巢癌;术前未行化疗和放疗;病历资料完整。选择同期在我院行卵巢良性肿瘤98例,为良性肿瘤组,年龄25~72岁,平均年龄(55.76±14.19)岁;以卵巢良性肿瘤无病变区域的组织标本30例为对照组,所有标本经医院病理科高年资的医师复核。
1.2 随访分组 卵巢癌患者术后以门诊、电话和微信等随访方式进行随访,患者均随访2年,其中死亡患者62例,为死亡组,生存患者54例为生存组。
1.3 免疫组织化学检测 卵巢癌,卵巢良性肿瘤和正常卵巢组织采用免疫组织化学SP法进行染色。取出石蜡切片,用4 μm切片机连续切片,经过脱水和水化后,使用柠檬酸液体进行抗原修复2 min,用PBS冲洗3次,5 min/次,然后经过3%过氧化氢进行水浴10 min,然后用PBS冲洗3次,5 min/次,加入山羊血清50 μl封闭好抗原,并在37℃温度下孵育,时间为15 min。去除山羊血清,加入CXCL13和Dyrk1b一抗(1∶100),在室温下孵育1 h,用PBS冲洗,在室温下孵育15 min后,行DAB显色,显微镜下观察显色4~5 min,自来水冲洗后用苏木素进行复染,PBS冲洗后返蓝,梯度乙醇脱水后,使用二甲苯脱水,用中性树脂封片,并固定。阳性表达的标准:以细胞核和细胞质为出现黄色、棕黄色和棕褐色为阳性表达。通过显微镜和图像采集软件Zoom Browser Ex在40倍物镜下,随机采取阳性部位的图像,每个组织随机采集10个阳性细胞的视野,使用Imagepro Plus图像分析软件测试每个阳性细胞视野的灰度值。根据参考文献[6],计算出代表阳性染色的相对阳性单位(positive unit,PU),每张切片阳性密度最高的区域随机选择5个视野,并求出平均值PU。
1.4 观察指标 比较3组表达CXCL13和Dyrk1b量的差别,卵巢癌组织表达CXCL13和Dyrk1b量与临床病理指标的关系,随访2年后生存组和死亡组的差异,预测死亡的灵敏度和特异性。

2 结果
2.1 3组组织CXCL13和Dyrk1b表达量比较 卵巢癌组组织表达CXCL13和Dyrk1b的量明显高于良性卵巢瘤组和正常对照组(P<0.01),而良性肿瘤组明显高于正常对照组(P<0.01)。见表1。
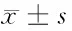
表1 3组组织CXCL13和Dyrk1b表达量比较 PU值,
2.2 卵巢癌组织CXCL13和Dyrk1b表达量与临床指标的关系 卵巢癌组织表达CXCL13和Dyrk1b量与分化程度、FIGO分期、淋巴结转移、腹腔积液、CA125水平和对化疗药物敏感性具有明显的相关性(P<0.01),而与年龄年龄、绝经、组织类型和肿瘤直径无明显相关性(P>0.05)。见图1,表2。
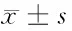
表2 卵巢癌患者组织CXCL13和Dyrk1b表达量与临床指标的关系 PU值,
2.3 卵巢癌组织CXCL13和Dyrk1b表达量与预后的关系 死亡组的卵巢癌组织CXCL13和Dyrk1b表达量明显高于生存组,差异有统计学意义(P<0.01)。见表3。
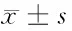
表3 卵巢癌组织CXCL13和Dyrk1b表达量与预后的关系 PU值,
2.4 卵巢癌组织CXCL13和Dyrk1b表达量在预测预后的临床价值 卵巢癌组织表达CXCL13和Dyrk1b量在预测死亡方面,通过受试者曲线进行分析,发现CXCL13和Dyrk1b表达量在预测死亡具有较高的灵敏度和特异性,并且发现两个指标通过二元Logistic分析得曲线0.265X CXCL13+0.216XDyrk1b-19.111,形成联合检测指标,其灵敏度87.1%,特异性88.9%,曲线下面积明显优于单纯指标CXCL13(Z=2.200,P=0.028)和Dyrk1b(Z=2.573,P=0.010),而在预测死亡方面CXCL13和Dyrk1b两指标无明显差异(P>0.05)。见表4,图2。

表4 卵巢癌组织CXCL13和Dyrk1b表达量在预测预后的临床价值
3 讨论
卵巢癌是妇科常见恶性肿瘤,由于卵巢癌位置较深,早期症状不典型,发现往往属于晚期,所以卵巢癌是妇科预后较差的恶性肿瘤。趋化因子参与了肿瘤的血管形成,在肿瘤细胞黏附,侵袭,增殖和转移等过程中具有重要的作用。CXCL13是趋化因子中的重要成员,在调节炎症和内环境稳定方面具有作用,对肿瘤的血管形成和肿瘤细胞的远处转移具有重要作用[7]。本研究表明卵巢癌组织标本表达CXCL13的量明显高于卵巢良性肿瘤和正常对照组,并且发现卵巢癌组织表达CXCL13量与分化程度、FIGO分期、淋巴结转移、腹腔积液、CA125水平和对化疗药物敏感性具有明显的相关性,说明CXCL13参与了卵巢癌的发生发展,并且与卵巢癌的恶性程度具有相关性,同时本研究提示CXCL13指标显示CXCL13与卵巢癌患者化疗耐药具有一定的联系。对乳腺癌患者进行研究发现乳腺癌组织表达CXCL13明显高于正常组织,并且发现与患者的预后不良具有显著的关系[7]。另一项肺癌的研究中,发现CXCL13在肺癌组织的表达明显高于癌旁组织和正常肺组织,并且其阳性率与肿瘤的分化程度,脉管内癌栓和淋巴转移等具有相关性[9]。本研究还发现2年随访出现死亡患者卵巢癌组织CXCL13表达量明显高于存活者,说明CXCL13表达量与患者的预后密切相关。本研究还发现卵巢癌组织CXCL13表达量在预测患者2年死亡方面具有较高的灵敏度和特异性,当卵巢癌组织标本CXCL13蛋白表达量>38.6 PU,其灵敏度79.0%,特异性88.9%,曲线下面积0.881,说明当卵巢癌组织标本表达CXCL13到一定的量,可能预示着预后不良,提示我们对这部分患者进行早期干预。

图2 卵巢癌组织CXCL13和Dyrk1b表达量在预测死亡的效能
本研究还显示卵巢癌组织Dyrk1b表达量明显高于卵巢良性肿瘤和正常卵巢组织,并且发现卵巢癌组织Dyrk1b表达量与分化程度、FIGO分期、淋巴结转移、腹腔积液、CA125水平和对化疗药物敏感性具有明显的相关性,说明Dyrk1b不仅参与卵巢癌的发生发展过程,还与卵巢癌患者的预后和化疗耐药具有明显的相关性。Dyrk1b是属于Minibrain/Dyrk家族成员,具有11个外显子和10个内含子,除骨骼肌细胞外在大多数细胞呈低表达,而在结肠癌,宫颈癌,肺癌和卵巢癌等肿瘤中呈高表达,在卵巢癌的研究中发现其表达水平是正常卵巢上皮细胞的2~17倍[14]。在一项小鼠的研究中发现将Dyrk1b敲除的小鼠为引起明显的表型改变,提示Dyrk1b对生存能力并无明显影响,不是生存必须的蛋白,但对卵巢癌的发生发展具有关键作用[11]。在一项研究中显示宫颈癌组织Dyrk1b表达量与化疗耐药具有明显的相关性[12]。Dyrk1b在对宫颈癌患者的影响,显示随着并且的进展Dyrk1b阳性表达率越高,使用Dyrk1b抑制剂能够明显抑制宫颈癌细胞的增殖,并诱导宫颈癌细胞的凋亡[13]。本研究还显示在卵巢癌患者死亡组卵巢癌组织Dyrk1b表达量明显高于存活组,说明卵巢癌组织Dyrk1b表达量是卵巢癌预后的重要指标。本组研究在研究卵巢癌组织Dyrk1b表达量在预测死亡方面的研究,但Dyrk1b表达量>43.17PU时,其预测2年内死亡灵敏度为79.0%,特异性79.6%,曲线下面积0.862,说明卵巢癌组织Dyrk1b表达在预测预后方面具有重要参考价值。本研究还发现联合CXCL13和Dyrk1b表达量在预测2年死亡方面明显优于单个指标预测,其灵敏度高达87.1%,特异性88.9%,曲线下面积0.935,说明联合检测能够提高预测不良预后的效能。
综上所述,CXCL13和Dyrk1b参与了卵巢癌的发生发展,联合检测组织CXCL13和Dyrk1b表达量对预后判断具有重要的临床价值。

