Rho/ROCK信号通路在眼科疾病发生发展中的作用研究进展
郝一宪,魏慧霞,郭大东,毕宏生,3
0引言
大量研究发现,Rho/ROCK信号通路具有一系列重要的生物学功能,可以在细胞调控过程中起“开关”作用,并参与调控细胞增殖与分化、诱导细胞骨架重组、影响血管和组织通透性和应力纤维形成等。越来越多的研究表明,Rho/ROCK信号通路可调控多种眼组织细胞的生理功能,包括通过调控细胞增殖、上皮分化、细胞迁移和细胞黏附来影响角膜各层功能;控制细胞骨架重塑来调节晶状体上皮细胞的迁移和增殖;调节小梁网收缩来控制房水流通;调控肌动蛋白和肌球蛋白,导致血管平滑肌收缩,影响眼内血流;诱导肌成纤维细胞的形成影响巩膜重塑等(图1)。因此,Rho/ROCK信号通路在眼科疾病的发生发展中起重要的调控作用,本文就Rho/Rock信号通路在眼科疾病发生发展中的作用做简要综述,为临床治疗眼病提供思路。
1 Rho-GTP酶和Rho
Rho-GTP酶是控制所有真核细胞多种信号转导途径的重要分子开关,为20~30kD单体GTP结合蛋白,与Ras超家族蛋白有25% 的同源性[1-2]。哺乳动物Rho-GTP酶主要包括Rho(三种亚型:A,B,C)、Rac(1,2,3)、Cdc42、TC10、TCL、Chp(1,2)、RhoG、Rnd(1,2,3)、RhoBTB(1,2)、RhoD、Rif、和TTF[1]等类型。Rho蛋白受三类蛋白质的高度调控,即鸟嘌呤核苷酸交换因子(guanine nucleotide exchange factor,GEF),GTP酶激活蛋白(GTPase-activating protein,GAP)和鸟嘌呤核苷酸交换抑制剂(guanine nucleotide exchange inhibitor,GDI)。在GEF的作用下,Rho蛋白由无活性的Rho-GDP状态转变为有活性的Rho-GTP状态,并且GAP可以通过GTP的水解使Rho蛋白失活,而Rho-GDI可保护Rho蛋白免受泛素化[3]。
2 ROCK
Rho相关蛋白激酶(Rho-associated coiled-protein kinase,ROCK)属于丝氨酸/苏氨酸激酶家族,包括两种类型ROCK1和ROCK2。其中,ROCK1在肝、肺、肾、脾、睾丸和循环炎症细胞中大量表达,而ROCK2主要存在于心脏、肌肉(包括平滑肌)和大脑中[4]。ROCK的结构包括三部分:位于分子结构氨基端的催化区,位于分子结构羧基端的PH结构域,以及包含Rho-GTP结合结构域的螺旋区。ROCK受到Rho-GTP酶的调控,参与控制多种生理功能,包括细胞收缩、迁移、增殖和黏附。ROCK可以使多种细胞内底物磷酸化,包括肌球蛋白轻链(myosin light chain, MLC)、LIM激酶(LIM kinases, LIMK)、肌球蛋白磷酸酶靶蛋白(myosin phosphatase target protein,MYPT-1)等,并通过与这些底物的相互作用调控肌动球蛋白的收缩、细胞形态变化、细胞黏附、膜通透性等。
3 Rho/ ROCK信号通路在眼科疾病中的相关研究
3.1白内障白内障是有用视力丧失的最常见原因之一,全世界大约有1600万人受到影响[5]。转化生长因子-β(transforming growth factor,TGF-β)诱导的上皮-间质转化可导致眼部纤维化病变,在白内障发生发展过程中起促进作用。Korol等[6]证实TGF-β诱导的上皮-间质转化(最终表达α-SMA)受肌动蛋白动力学的调节,其发生途径是RhoA-ROCK-MRTF-A。Imaizumi等[7]发现,ROCK抑制剂Y27632抑制了TGF-β2依赖性诱导的小鼠晶状体上皮细胞(lens epithelial cells,LECs)Ⅰ型胶原表达和UV-B照射诱导的前囊下白内障(anterior subcapsular cataracts,ASCs)形成,对ASCs的发生起抑制作用。因此,ROCK抑制剂可能是预防ASCs的候选药物。在白内障术后,最常见的并发症是由LECs的迁移和增殖引起的后囊混浊(posterior capsule opacification,PCO)。Lin等[8]发现,ROCK通路可以通过cofilin激活、CAPZA1和ERM蛋白家族表达来调节细胞骨架重塑,其中cofilin可以通过磷酸化调节LECs的迁移和增殖;经ROCK抑制剂Y27632-PLGA改良后的人工晶状体可明显抑制PCO的发展。因此,改良人工晶状体可明显阻止PCO的形成,有望成为临床预防PCO的有效途径。
3.2青光眼青光眼是一组不可逆的进行性视神经疾病,可导致严重的视野丧失和失明[9],表现为房水流通受阻或流通速度下降而导致的眼压升高。在青光眼房水中可以观察到多种细胞因子浓度的改变,其中包括TGF-β水平的增加[10]。Rho蛋白可以通过刺激分泌的生物活性分子受体(如内皮素-1、凝血酶、血管紧张素Ⅱ、溶血磷脂酸、TGF-β和细胞因子)被激活,也可以通过与细胞外基质结合后由整合素激活[11]。Pattabiraman等[12]利用慢病毒作为基因载体,研究大鼠房水流出通道中RhoA-GTP酶(RhoAV14)持续表达对眼压的影响,发现在小梁房水通路中,因RhoAV14失活可导致成纤维细胞活性增加,并以ROCK依赖的方式升高大鼠的眼压。Montecchi-Palmer等[13]发现TGF-β2通过Smad和非Smad依赖性途径诱导人小梁细胞内交联肌动蛋白网络的形成,且ROCK抑制剂对肌动蛋白应力纤维具有破坏性,因此房水流出受阻和眼压升高可能是由于Rho/ROCK信号传导途径的激活,使用Rho/ROCK信号通路抑制剂可能在青光眼治疗中发挥作用。
3.3视神经相关病变
3.3.1视神经损伤常见的视神经病变包括青光眼性视神经病变和外伤性视神经损伤。视网膜神经节细胞(retinal ganglion cells, RGCs)的逐渐丧失和相关的视野缺损是青光眼性视神经病变的典型标志,而RGCs的凋亡会导致视力损害和失明[14-15]。Yu等[16]发现视网膜RhoA/ROCK信号在外伤性视神经病变中被激活;同时,中枢神经损伤后,RGCs上调表达Nogo-髓鞘相关糖蛋白(Nogo myelin-associated glycoprotein,Nogo-A),这是一种富含髓鞘的中枢神经系统轴突生长和再生抑制蛋白[17]。Nogo-A与细胞膜上的受体结合后将信号传入细胞内,激活RhoA-ROCK-LIMK-Cofilin信号通路,调控肌动蛋白和肌球蛋白从而引起细胞生长锥的塌陷,抑制神经轴突的生长[18-19];Yu等[16]研究证实,ROCK抑制剂法舒地尔(Fasudil)可通过作用于Rho/ROCK信号通路减轻RGCs的损伤,降低Nogo-A和ROCK-2基因的表达,从而减轻视神经损伤。
3.3.2缺血性视神经病变缺血性视神经病变根据视神经乳头(optic nerve head, ONH)的肿胀部位分为前部和后部两种类型[20]。青光眼眼压升高可增加ONH筛板上的机械力,使RGCs轴突功能受损,同时,随着ONH中RhoA蛋白水平显著增加,Rho/ROCK信号通路调控肌动蛋白和肌球蛋白作用增强,导致血管平滑肌过度收缩,最终导致ONH缺血[21-23]。Sugiyama等[24]研究发现,局部或全身注射ROCK抑制剂法舒地尔抑制L-NAME或内皮素-1诱导的ONH血流量减少以及ONH功能和形态的损害。Chihara等[25]研究表明,外用ROCK抑制剂利帕舒地尔(Ripasudil)增加了原发性开角型青光眼和高眼压的ONH
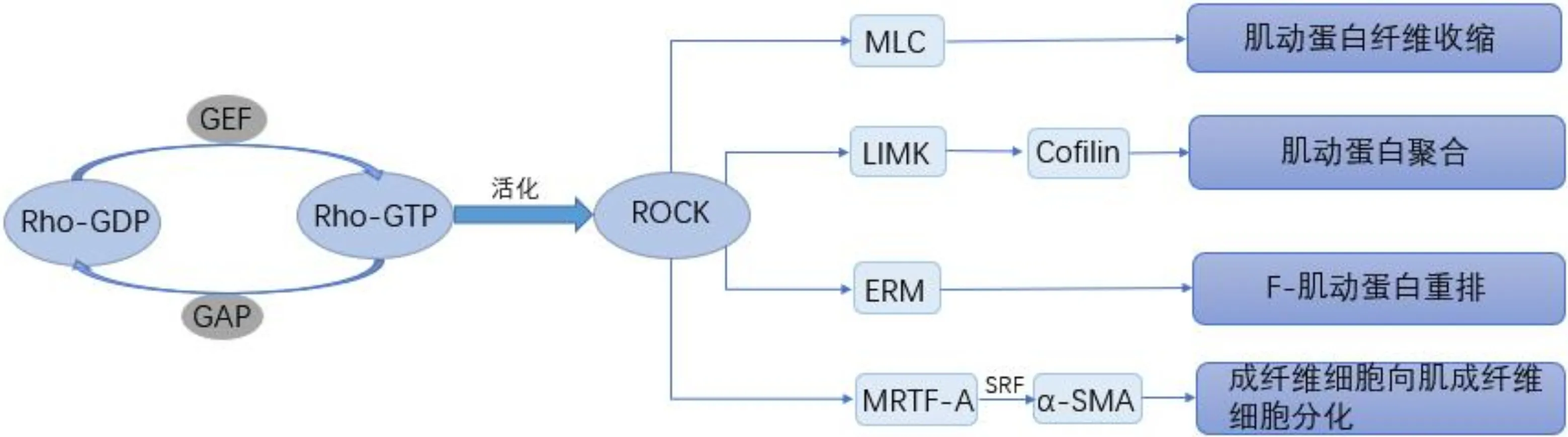
图1 Rho/ROCK 信号通路活化作用简图 GEF:鸟嘌呤核苷酸交换因子;GAP:GTP酶激活蛋白;MLC:肌球蛋白轻链;LIMK:LIM激酶;ERM:(Ezrin/Radixin/Moesin) 蛋白家族;MRTF-A:心肌相关转录因子-A;SRF:血清反应因子。
浅周血管密度,扩张毛细血管周围血管。因此,ROCK抑制剂可作为缺血性视神经病变的治疗方法。
3.4视网膜相关病变
3.4.1糖尿病性视网膜病变对糖尿病患者而言,糖尿病视网膜病变是致其失明的主要原因[26]。Arita等[27-28]在糖尿病大鼠的视网膜微脉管系统中观察到显著的Rho/ROCK活化,应用ROCK抑制剂法舒地尔,使糖尿病大鼠视网膜内皮型一氧化氮合酶的磷酸化水平显著增加,并且降低MYPT-1磷酸化和细胞间黏连分子-1表达,通过抑制白细胞黏附并减少白细胞诱导的内皮损伤来保护血管内皮。事实上,抑制Rho/ROCK通路可调节血管内皮细胞从而抑制血管内皮生长因子诱导的血管生成[29]。Hollanders等[30]用ROCK抑制剂AMA0428靶向Rho/ROCK通路可有效减少早期糖尿病视网膜病变改变。Rothschild 等[31]发现在2型糖尿病视网膜中,视网膜内皮细胞和视网膜色素上皮细胞中的ROCK-1信号激活,可诱导细胞骨架重塑,进而导致微血管闭合和视网膜缺氧,并破坏视网膜色素上皮屏障和渗漏,而眼内注射法舒地尔能有效逆转该损害。
3.4.2年龄相关性黄斑变性年龄相关性黄斑变性是视网膜色素上皮和神经感觉性视网膜的退行性病变,其特征是视网膜色素上皮丧失、脉络膜新生血管、色素上皮脱离和黄斑纤维瘢痕形成[32-33]。Hollanders等[34]发现在体外琼脂糖迁移实验中,ROCK抑制剂AMA0428可减少人脑微血管周细胞中肌球蛋白磷酸化,并诱导应力纤维和局灶性黏连的丢失,从而促进该细胞的迁移和招募,促进血管的成熟,且AMA0428在激光诱导的脉络膜新生血管小鼠模型中具有抗炎、抗血管生成和抗纤维化作用。
3.4.3视网膜脱离视网膜脱离最明显的特征是杆状细胞轴突及其末端从外突触层向细胞本体的回缩[35]。RhoA/ROCK信号通路在受伤后可迅速活化,促进轴突回缩[36]。Wang等[37]发现视网膜脱离后,通过RhoA-ROCK-LIMK通路,使cofilin磷酸化增加,促进了视杆感光细胞肌动蛋白纤维的解聚,从而有助于视杆轴突损伤后的收缩。
3.5角膜内皮疾病角膜内皮层为角膜最内层,灵长类角膜内皮细胞(corneal endothelial cell,CEC)是不可再生的,因此CEC的任何损伤都只能通过代偿性迁移和残余CEC的扩散来修复,以覆盖受伤区域,从而导致CEC密度下降,当低于临界水平(通常小于500~1000cell/mm2)时,可能导致角膜混浊[38]。研究发现,ROCK抑制剂可加速角膜内皮伤口愈合,从而导致具有高内皮细胞密度的角膜内皮单层细胞再生[39]。Okumura等[40]证实ROCK抑制剂Y-27632通过抑制Rho/ROCK信号通路,促进CEC的黏附,抑制细胞凋亡,来增加CEC细胞的数量。在角膜受损的伤口愈合过程中,新生血管的生成以及纤维化可损害视力,ROCK抑制剂AMA0526在体外能有效抑制血管生成,并可减轻炎症反应和Ⅲ型胶原沉积,从而有效控制创面愈合的全过程[41]。
3.6近视近视作为一种青少年常见的眼部疾病,其特征在于眼轴的过度增长。大量实验和临床证据表明,与近视相关的眼球后段过度延长是巩膜细胞外基质重塑改变的结果,该结果已被人近视眼巩膜的结构和生物力学的变化所证实[42]。Yuan等[43]研究发现巩膜成纤维细胞受到机械应力后可激活RhoA,通过RhoA/ROCK2-MRTF-A/SRF途径,使得心肌相关转录因子-A(MRTF-A)核转移,α-SMA表达增加,诱导其分化为肌成纤维细胞。另外,MDIA和ROCK在Rho引起的应力纤维形成过程中同时被激活,MDIA通过成核和聚合产生肌动蛋白细丝,而ROCK激活肌球蛋白使其交联,从而诱导肌球蛋白束的收缩[44]。因此,Rho可能通过mDia1和ROCK途径同时介导肌动蛋白组装,从而影响近视的发生发展。
3.7葡萄膜炎特发性前葡萄膜炎是人类最常见的眼内炎性疾病,以虹膜和/或球囊的炎症为特征[45]。Uchida等[46]研究发现,在内毒素诱导的大鼠葡萄膜炎中,ROCK抑制剂利帕舒地尔通过抑制细胞间黏连分子-1和MYPT-1的表达,以及通过抑制TNF-α/NF-κB来发挥抗炎作用,从而抑制白细胞黏附和炎性细胞浸润。Yamada等[47]研究发现利帕舒地尔滴眼液对前葡萄膜炎患者的炎症作用有很好的抑制作用,可能与ROCK信号通路抑制剂重新构建血-房水屏障有关。
4小结
综上所述,Rho/ROCK信号通路参与了多种眼病的发生发展,深入探讨Rho/ ROCK信号通路在眼病发生发展中的作用对治疗眼病有很好的帮助和促进作用,相关的Rho酶抑制剂和ROCK抑制剂的开发也在相关眼病的治疗过程中显示出越来越大的潜力,并为治疗眼病提供了更多的选择和帮助。

