大鼠外伤性视神经损伤的闪光电生理特性和Tau蛋白及其磷酸化研究
王鹏飞,申 晨,喻哲昊,聂祖庆,李志伟,文 婕,李 萌,曹 霞
0引言
外伤性视神经损伤(traumatic optic neuropathy,TON)是指外力作用导致的视神经功能障碍[1],可分为直接性损伤和间接性损伤。直接性损伤指外力直接作用于视神经造成的开放性视神经损伤[2-3];间接性损伤多由于震荡力经头部传递至视神经管,引发视神经病理性改变,严重者可导致失明[3-4]。目前TON无特效治疗方法,可通过视神经管手术减压或皮质类固醇激素改善症状[5-8]。
TON除可直接导致视神经轴突损伤外,还可继发诱导视网膜病变,进一步加剧患者的视觉障碍[9]。闪光视觉诱发电位(flash visual evoked potentials,FVEP)是评价视觉通路功能的常用方法[10],闪光刺激导致的视觉电信号的振幅强弱可反映黄斑的接收功能和参与兴奋的神经元数量;而电信号的潜伏响应程度可反映神经传导和轴突髓鞘的完整性[11]。标准FVEP电位包含5个组份,含3个正向波P1、P2、P3和2个负向波N1和N2,其中N2和P2是成人FVEP中最一致和稳健的组份[12],N2-P2的振幅变化常被临床运用于监测视神经功能的完整性和预后提示[13-14],异常的N2和P2波形可预测某些严重的退行性疾病[15]。在大鼠缺血性神经病变模型中,N2-P2波振幅可用于评估体内视网膜神经节细胞(retinal ganglion cell,RGC)的结构和功能,RGC损失可导致N2-P2幅度衰减[16-17]。同时有报道称颅内高压造成的脑缺血、缺氧和乳酸沉积可减缓神经传导速度,病理进展与FVEP电位潜伏期呈正相关,且N2波潜伏期的延长可作为TON预测的良好指标[18-19]。
Tau是一种微管相关蛋白,生理状态下主要分布于细胞轴突。Tau通过选择性磷酸化发挥稳定和促进微管形成的功能,可调节轴突运输;病理状态下,Tau通过过度磷酸化发生Tau聚集,分布异常,毒性增加,使得稳定微管的能力下降甚至丧失[20]。近期研究表明,在小鼠间接性TON模型中可出现内角膜水肿引起高眼压和RGC丢失等病理变化,其中RGC出现Tau过度磷酸化等病变[21]。在大鼠青光眼模型中,Tau异常分布于RGC的树突中,视网膜中Tau的Ser 396/404位表现出过度磷酸化现象[22]。在阿尔茨海默病转基因小鼠(3×Tg)中,视网膜Tau的Ser 396/404位点却没有发生过度磷酸化现象,相反在Ser 202和Thr 205位点中发生了过度磷酸化[23]。因此,对于视网膜轴突受损的TON来说,Tau在其病理进展中发挥了关键作用,但其磷酸化变化可能与在其他疾病模型中探索出的改变模式有所不同。本研究通过构建大鼠TON模型,运用FVEP技术检测大鼠TON后视觉通路障碍的变化情况,并分别探究大鼠TON后视神经轴突及视网膜中Tau及pTau-Ser 396/404的状态变化。
1材料和方法
1.1材料
1.1.1实验动物SPF级雌性健康成年SD大鼠30只(昆明医科大学实验动物中心提供),双眼外观正常,检查双眼屈光间质清,瞳孔等大等圆,对光反射灵敏,眼底无异常,体质量约180~200g。动物实验方案考虑了实验动物福利原则,但因FVEP检测对动物麻醉状态敏感,为提高准确性和可重复性采取手术眼和假手术眼在同一个体上进行实验的策略。本研究经昆明医科大学动物实验伦理审查通过,本实验操作人员具有云南省实验动物从业资格。
1.1.2主要试剂及仪器主要试剂:一抗:Anti-Tau(phospho S396) Abcam ab109390,Anti-Tau(phospho S404) Abcam ab92676;Anti-Tau(Tau-5) Abcam ab80579;GAPDH Proteintech 10494-1-AP。二抗:Goat Anti-Rabbit IgG (H+L) Antibody KPL(214-1516);Goat Anti-Mouse IgG(H+L) Antibody KPL(214-1806)。蛋白提取试剂盒:MinuteTM Total Protein Extraction Kit for Animal Cultured Cells and Tissues Catalog Number: SD-001/SN-002。蛋白酶抑制剂Cocktail (不含EDTA,100× DMSO储液,bimake),磷酸酶抑制剂Cocktail (100× bimake)。其他:EpiZyme科技PAGE凝胶快速制备试剂盒(10%)、义齿基托树脂、盐酸奥布卡因、青霉素G钾。主要仪器设备:瑞沃德脑定位仪、瑞沃德手持钻孔器、眼科罗兰电生理测试仪器(德国)。
1.2方法
1.2.1动物分组及造模先将30只SD大鼠行FVEP电极植入,康复恢复1wk后随机分成5组,每组6只,各组大鼠进行TON模型构建,左眼进行视神经夹持,右眼进行视神经暴露假手术。
1.2.1.1 FVEP模型构建(1)SD大鼠碘伏消毒腹部,用2%戊巴比妥钠腹腔注射(0.4g/kg,约0.4mL)进行麻醉,待大鼠角膜反射消失,仰卧位无法自主转身,呼吸深慢,且用镊子轻夹下肢脚趾无反应时即麻醉成功;(2)用动物剃毛器进行头部备皮,碘伏消毒;(3)将大鼠固定于脑定位仪,用组织剪于颅顶正中做3~4cm切口,用弯钳钝性分离皮下组织,用棉签蘸取3%双氧水擦去颅骨表面筋膜,直至清晰辨认前后囟门;(4)拨动定位仪以前囟为起点向前3mm为阴极电极点,向后7mm后左右旁开3mm为2个阳极电极点(图1),用转孔机组合0.8mm颅骨钻头进行颅骨打孔,用有齿钻头在光滑颅骨表面打磨,便于牙科义齿树脂黏合(图1左图);(5)用有齿弯钳夹取1mm直径的无菌不锈钢螺丝钉分别拧入3个钻孔,深约2mm;(6)按照1∶1比例配取牙科义齿树脂,快速混合,用加样枪吸取液态树脂置于手术区域,覆盖至手术切缘为止,待自然凝固后,取下固定中的大鼠(图1右图);(7)配制200000IU/mL浓度的青霉素G钾,每只大鼠行大腿一次性肌肉注射200μL。术后给予伤口恢复1wk,期间查看是否有感染迹象。

图1 FVEP电极植入示意图。

图2 TON模型构建及视神经视网膜取材示意图 A:TON视神经夹持示意图,箭头处所示为暴露的视神经;B:摘取眼球后,分离暴露的模型动物大脑;C:缓慢抬起大脑,从颅底抽出视神经,箭头处所示为抽出的视神经;D:取出的完整视神经,箭头处所示为左眼视神经;E:从冠状面分离出眼球角膜、虹膜及晶状体;F:从杯状眼组织中钝性分离出视网膜,箭头处所示为分离出的完整视网膜。
1.2.1.2 TON模型构建(1)大鼠麻醉同前;(2)麻醉成功后,将大鼠取右侧卧位置于手术台上,用拇指和食指固定其头部位置,两指稍用力将眼睑向两边提拉,左眼滴2~4滴盐酸奥布卡因进行表面麻醉;(3)解剖显微镜下操作,剪开左眼外眦约2mm,环形剪开左眼球结膜,避开大血管,向后方钝性分离眼外直肌,然后提起球结膜向前稍牵拉眼球,暴露视神经3~4mm(图2A箭头所示),用夹持力为50g的视神经夹持镊在球后约2mm处钳夹视神经10s造成夹持损伤,注意避免损伤血管;(4)大鼠右眼为假手术眼,仅分离并暴露视神经,但不行钳夹损伤;(5)确定造成视神经夹持损伤后,将眼球恢复原位,在眼睑上使用红霉素眼膏敷眼,后将大鼠放回笼中,观察呼吸有无异常;(6)术后第2d手术眼出现Marcus-gunn瞳孔,眼球无明显突出,检眼镜观察眼底无明显出血者为成功模型。
1.2.2 FVEP测量TON模型构建完成后,5组大鼠依次按夹持后1、3、7、14、28d进行FVEP检测。FVEP检测方法:(1)大鼠麻醉后置于黑箱子中进行暗适应约30min,电热毯保持大鼠体温;(2)检测时,检测眼滴入1滴复方托吡卡胺滴眼液扩瞳,对侧眼不透光黑眼罩进行遮罩,连接相应电极,检查电阻情况;(3)眼科罗兰电生理测试仪FVEP参数设置:电极电阻低于5kΩ,频闪强度3.0cd/(s·m2),1Hz频闪频率记录有效光刺激60次,检测时间200ms,抽样率5kHz,刺激响应放大2万倍,最高和最低band-pass过滤频率分别为1、100Hz;(4)每个眼球重复测量3次,查看FVEP检测图像,根据国际电生理标准(ISCEV)的标准峰型指导及既往关于大鼠FVEP检测波型指导[24],结合仪器自动峰型识别确定实验大鼠FVEP的各项指标。

图3 TON模型大鼠FVEP检测结果 左眼:手术眼;右眼:假手术眼。
1.2.3取材FVEP检测完成后将大鼠处死(过量2%戊巴比妥钠2mL腹腔注射,断颈处死)。分离头部,去皮肤,分离左眼眶处组织,剪断视乳头处神经,取出眼球;从枕骨处正中分离顶骨,暴露大脑,从小脑处切断,用镊子缓慢抬起大脑,暴露并抽取视神经(若视神经管内发生炎性黏连,注意抽取视神经的完整性),剪取左眼视神经(图2B~D)。取分离的左眼球,置于盛有PBS的平板中,用眼科剪在角膜上截一孔,随后沿冠状面剪去角膜、虹膜及晶状体(图2E),用镊子缓慢钝性分离视网膜(图2F)。
1.2.4视神经/视网膜组织蛋白提取(1)按照蛋白提取试剂盒说明书进行蛋白提取,将视神经/视网膜组织放入试剂盒蛋白裂解液中,迅速依次加入蛋白酶抑制剂2μL,磷酸酶抑制剂A 2μL,混匀后加入磷酸酶抑制剂B 2μL;(2)用电动匀浆器进行冰浴匀浆,高速离心机离心14000r/min,4℃,5min;(3)吹吸过滤液,每200μL过滤液中加入100μL 3×loading buffer,10μL DTT,沸水浴10min。
1.2.5 Western blot检测TON大鼠视神经及视网膜中Tau及pTau-Ser396/404蛋白水平(1)按快速制备试剂盒说明书配制10% PAGE凝胶;(2)上样并电泳,90V 30min后120V 90min,电泳至溴酚蓝刚跑出即可终止电泳,进行转膜90V 90min;(3)转膜结束后切取内参及目的条带,于摇床PBS-Tween洗膜5×5min;5% BSA,37℃摇床封闭1h,于摇床PBS-Tween洗膜5×5min;(4)于摇床4℃过夜孵育一抗,GAPDH(1∶1000),Anti-Tau (phospho S396)(1∶2000),Anti-Tau(phospho S404)(1∶2000),Anti-Tau(Tau-5)(1∶2000);(5)次日,于摇床PBS-Tween洗膜5×5min; 二抗(1∶20000)室温摇床孵育1h,于摇床PBS-Tween洗膜5×5min;ECL化学发光试剂显影。蛋白样本检测进行独立3次重复实验。运用Image J软件进行灰度扫描,经内参校准后进行蛋白表达差异分析。
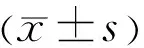
2结果
2.1 TON大鼠FVEP电生理信号变化通过观察大鼠FVEP电生理图谱发现,各组大鼠3次重复测量均一性较好,其中尤以N2-P2峰识别性较高,故本研究统计分析围绕N2波潜伏期和N2-P2波振幅进行,其他指标不予分析。检测结果发现,TON模型大鼠假手术眼出现了典型的FVEP波形,表明仅暴露右眼视神经并不会对FVEP的各项指标产生严重影响(图3);相较于假手术眼,手术眼各检测时间点FVEP的N2波均发生显著延迟,平均延迟时间为14.98ms,FVEP的N2-P2波振幅均发生显著缩减,平均缩减42.85μV(表1,图4),且手术眼在检测时间范围内(1~28d)均无法恢复至对侧假手术眼视觉水平。此外,TON大鼠双眼N2-P2波振幅相对值和N2波潜伏期相对值在各时间点上总体均不存在显著差异(F=1.023,P=0.400;F=1.619,P=0.176),但N2波潜伏期相对值在3~7d延迟幅度明显降低(图5)。以上结果表明大鼠视神经受到外伤性损伤之后视觉障碍加剧,7d时机体可能发生了N2波潜伏期改善,提示大鼠视神经脱髓鞘可能有所缓解。
2.2 TON大鼠视网膜Tau及其磷酸化变化TON大鼠视网膜Tau及其磷酸化位点Western blot检测泳道内可检测到多个条带(与标准蛋白marker比对,其阳性条带大小约为45、55~70、120kDa),均为Tau不同单体型,其中55~70kDa可见紧密重叠的两条主要Tau单体型,故本研究围绕此附近条带进行分析(图6)。结果显示,夹持损伤后视网膜总Tau含量显著降低(F=8.808,P=0.001),其中1d内变化不明显,随后急剧下降,3d时达低谷,7d时存在一定量的恢复随后继续下降,直至28d稳定至略低于正常水平;pTau-Ser396/404的含量与总Tau的变化一致,均显著降低(F=5.901,P=0.006;F=16.543,P<0.001),但pTau-Ser396/404与总Tau含量的相对比率变化则不同,Ser 396位点在夹持损伤后的磷酸化比率更高(F=11.999,P<0.001),而Ser 404位点的相对磷酸化水平则降低(F=8.970,P<0.001),表明夹持损伤后视网膜中Tau的Ser 396位点较Ser 404位点更易发生磷酸化。

图4 TON后不同时间点手术眼与假手术眼FVEP检测结果比较 A:N2波潜伏期;B:N2-P2波振幅。bP<0.01 vs假手术眼。

图5 TON后不同时间点手术眼相较于假手术眼N2波潜伏期延迟和N2-P2波振幅缩减情况 A:N2波潜伏期相对值;B:N2-P2波振幅相对值。
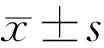
表1 TON后不同时间点手术眼与假手术眼FVEP检测结果分析
2.3 TON大鼠视神经Tau及其磷酸化变化TON大鼠视神经Tau及其磷酸化位点Western blot检测较视网膜更难以检测,但条带位置与视网膜结果所示位置一致(图7)。结果显示,夹持损伤后视神经中总Tau含量呈增多趋势(F=9.469,P=0.001),14d时达最高值,直至28d仍处于一种略高于正常水平的状态;pTau-Ser396/404的变化与总Tau的变化大致相同,其中pTau-Ser396表达呈增多趋势(F=6.176,P=0.005),而pTau-Ser404表达明显增加(F=12.419,P<0.001),7d时增长并抵达高峰随后回落至高于正常水平值;pTau-Ser396/404与总Tau含量的相对比率分析显示,Ser 396位点相对磷酸化程度降低(F=37.173,P<0.001),而Ser 404位点7d时表现出相对磷酸化程度增高的现象(F=15.088,P<0.001)。
3讨论
本研究探讨了FVEP技术检测大鼠TON后视觉障碍的变化情况,识别度较高的N2及P2相关指标可用于监测大鼠视觉功能水平。FVEP检测结果表明TON后大鼠FVEP波形明显紊乱,视觉功能发生严重障碍,且随着检测时间的持续,该障碍的状态没有发生逆转,说明TON模型构建对大鼠视觉功能的影响是不能短期自愈的。FVEP检测结果中,TON后7d时,模型鼠的视觉功能发生了小幅度且短暂的改善现象,分析可能是视神经与视网膜中胶质细胞活化清除受损细胞和部分修复受损轴突脱髓鞘所致[25]。值得注意的是,上述改善未能获得很好的统计学支持,说明改善程度轻微或分组内个体不足导致了检验效能不足,今后进行FVEP检测大鼠TON视觉通路变化情况需要增大分组内个体数目。尽管如此,这种短暂改善并没有持续发生和进一步增强,表明在缺乏外界干预的情况下,TON大鼠视神经的自发修复有限,可能存在完整功能的神经元发生了进一步凋亡的现象[26]。

图6 TON后不同时间点大鼠手术眼视网膜Tau及其磷酸化蛋白相对表达情况 对照组:大鼠视神经夹持损伤后1d右眼(假手术眼)视网膜组织。A:视网膜总Tau含量相对于对照组的变化情况;B:视网膜Tau磷酸化位点Ser 396含量相对于对照组的变化情况;C:视网膜Tau磷酸化位点Ser 404含量相对于对照组的变化情况;D:视网膜总Tau、Tau磷酸化位点Ser 396及Tau磷酸化位点Ser 404的蛋白电泳图;E:视网膜Tau磷酸化位点Ser 396含量与总Tau含量比值相对于对照组的变化情况;F:视网膜Tau磷酸化位点Ser 404含量与总Tau含量比值相对于对照组的变化情况。aP<0.05,bP<0.01 vs 对照组;cP<0.05,dP<0.01 vs 夹持损伤后1d;eP<0.05 vs 夹持损伤后3d。

图7 TON后不同时间点大鼠手术眼视神经Tau及其磷酸化蛋白相对表达情况 对照组:大鼠视神经夹持损伤后1d右眼(假手术眼)视神经组织。A:视神经总Tau含量相对于对照组的变化情况;B:视神经Tau磷酸化位点Ser 396含量相对于对照组的变化情况;C:视神经Tau磷酸化位点Ser 404含量相对于对照组的变化情况;D:视神经总Tau、Tau磷酸化位点Ser 396及Tau磷酸化位点Ser 404的蛋白电泳图;E:视神经Tau磷酸化位点Ser 396含量与总Tau含量比值相对于对照组的变化情况;F:视神经Tau磷酸化位点Ser 404含量与总Tau含量比值相对于对照组的变化情况。aP<0.05,bP<0.01 vs 对照组;cP<0.05,dP<0.01 vs 夹持损伤后1d;eP<0.05,fP<0.01 vs 夹持损伤后3d;gP<0.05,hP<0.01 vs 夹持损伤后7d;jP<0.01 vs 夹持损伤后14d。
大鼠TON后,1~3d时视网膜中总Tau的含量急剧降低,这表明在神经元受损的早期,视网膜中的神经元胞体死亡或受到干扰难以合成足量的Tau进行微管稳定,存量的Tau逐渐被消耗,这与高眼压青光眼模型中的Tau聚集在视网膜RGC胞体内的情况不同[22]。TON后7d时视网膜Tau产生了一定量恢复,说明部分RGC已经恢复功能开始正常合成Tau,这与FVEP中观测到的7d改善现象一致。与视网膜中总Tau含量变化不同的是,视神经总Tau的含量却是逐渐增加的,其可能的原因是破损的轴突中多聚化Tau的清除机制降低,残留多聚化Tau与眼球近端轴突转运来的大量Tau在损伤处形成神经纤维缠结[27]。此外,受损轴突中伴随着Tau增多,两个检测位点的磷酸化水平也随之增高。有研究表明,在人类阿尔茨海默病患者的外周血中,Tau的Ser396/404过度磷酸化是潜在的疾病诊断指标之一,因此TON后视神经中pTau-Ser396/404的增加可能对视神经的修复起到抑制作用[28]。此外,TON后视网膜和视神经轴突中pTau-Ser396和404两个磷酸化位点发挥作用的程度也不同,在视网膜中主要的磷酸化增量位点为Ser 396,而在视神经中的增量磷酸化位点为Ser 404,其原因可能是两个磷酸化位点对Tau功能影响存在差异;另一种可能是磷酸化次序因素,Ser 396位点磷酸化后404位点才进一步磷酸化。
总的来说,FVEP技术可在活体状态下对模型动物的视觉通路功能进行无创检测,这是研究某些视网膜或视神经相关疾病损伤的优良终点指标,但是该技术对研究者电极植入和FVEP波形的识别有一定的要求,且不同实验项目对分组动物个体数目的要求也会不同。近年来研究者对神经退行性疾病中Tau和Tau磷酸化等相关指标的兴趣倍增,本研究表明异常的Tau聚集和Tau过度磷酸化是TON后疾病发生发展的重要因素,探索Tau与TON发展的分子机制和研究视神经微管稳定与TON的关系是今后开展治疗视神经损伤的坚实基础。

