白蛋白结合型紫杉醇联合替吉奥在胰腺癌中的应用
杨海林 白英伟
河南省濮阳市油田总医院 1 放疗科 2 普外科 457001
胰腺癌是一种发病率较高的消化系统恶性肿瘤,具有病程短、进展快、起病隐匿等特点,其致死率在恶性肿瘤中位居第4位,5年生存期≤5%[1]。大多数患者在确诊时病灶已开始向远处转移,难以实施根治性切除治疗,针对此类患者,通常选择吉西他滨进行姑息性化疗[2]。但是,该疗法的临床疗效并不十分令人满意,生存期中位数≤1年。白蛋白结合型紫杉醇(Nab-P)经美国FDA于2013年批准通过,可用于治疗胰腺癌,尤其对于中晚期患者具有较好的效果[3]。替吉奥则是一类氟尿嘧啶类衍生药物,服用方法简单,且对消化道刺激较小,对于年老体弱类胰腺癌患者具有良好适应性[4]。为了探究二者联合用药对于胰腺癌患者的疗效,本文选取2017年5月—2018年4月在我院肿瘤科进行治疗的40例晚期胰腺癌患者,分组探讨Nab-P联合替吉奥的效果,内容如下。
1 资料与方法
1.1 一般资料 选取2017年5月—2018年4月在我院肿瘤科进行治疗的40例晚期胰腺癌患者。入选标准:(1)经病理切片及细胞病理学确诊为胰腺癌,且手术无法切除;(2)未接受过放、化疗,且可评估转移病灶≥1个;(3)体力状况ECOG评分(最高分5分)0~2分;(4)肝肾功能及血常规均在正常范围内,生存期≥3个月。排除标准:(1)存在其他恶性肿瘤;(2)对实验药物过敏;(3)存在严重肝肾功能不全或造血系统异常。40例患者按照随机数表法分为观察组及对照组,各20例,对照组男12例,女8例,年龄52~75岁,平均年龄(63.51±5.32)岁;原发部位:胰头颈部9例,胰尾部11例;TNM临床分型:Ⅲ期13例,Ⅳ期7例;单器官转移共计8例,多器官转移共计12例。观察组男13例,女7例,年龄55~75岁,平均年龄(63.87±5.22)岁;原发部位:胰头颈部7例,胰尾部13例;TNM临床分型:Ⅲ期12例,Ⅳ期8例;单器官转移共计9例,多器官转移共计11例。两组性别、年龄、原发部位、临床分型等基线资料差异不显著(P>0.05),可比性较好。
1.2 方法 对照组给予替吉奥(山东新时代药业有限公司,批准文号H20080802,规格20mg×42粒)口服,体表面积在1.25m2以下者,40mg/次,2次/d;体表面积在1.25m2以上者,60mg/次,2次/d。连续服药14d,停药7d,共21d为1个疗程。观察组在对照组基础上加用Nab-P(美国费森尤斯卡比股份有限公司,批准文号H20130650,规格100mg)静脉滴注125mg/m2,滴注时间不超过1h,给药时间为第1天、第8天,患者用药前无须接受过敏预处理,21d为1个疗程。两组患者均于每周期化疗前进行血常规及心电图检测,若患者不良反应达到4级以上则下个周期化疗剂量减少25%~30%。两组患者均进行为期2个周期的化疗。
1.3 观察指标 (1)对比两组疗效,参照美国癌研所编订的实体肿瘤RECEST标准[5],CR:所有病灶消失,PR:基线病灶长径和减小≥30%,SD:基线病灶长径和减小未达到PR、加大未达到PD,PD:基线病灶长径和加大≥20%或有新病灶出现。疾病控制率DCR=CR+PR+SD,客观有效率ORR=CR+PR。(2)评估两组患者治疗前、治疗2个疗程后癌性疼痛评分,参照国际疼痛数字评分法(NRS)标准[6],评分为0~10分,0分即未感到疼痛,1~3分即轻度,4~6分即中度,7~9分即重度,10分即剧烈,分数减少3分及以上即可判定疼痛缓解。(3)抽取晨起空腹静脉血,检测两组患者治疗前、治疗2个疗程后的血清糖链抗原(CA19-9)及癌胚抗原(CEA)水平,仪器采用Elecys2010型电化学发光免疫分析仪(德国Roche公司)。
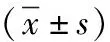
2 结果
2.1 两组临床疗效判定 观察组DCR较对照组明显更高,差异有统计学意义(P<0.05);两组ORR差异不显著(P>0.05),详见表1。
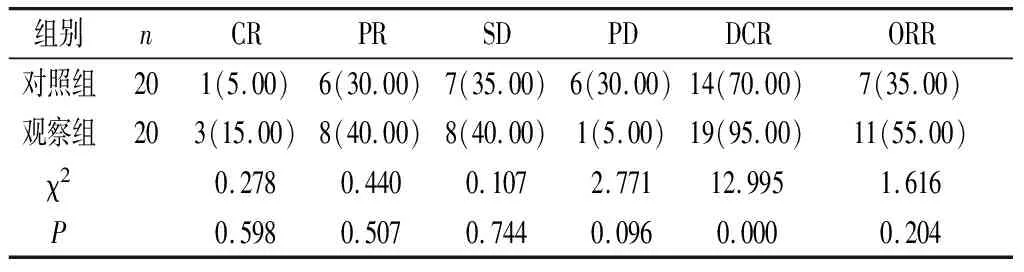
表1 两组临床疗效比较[n(%)]
2.2 两组癌性疼痛评分 治疗前,两组NRS评分差异不显著(P>0.05);治疗后,两组NRS评分均比治疗前有所下降,观察组较对照组下降更明显,差异有统计学意义(P<0.05),详见表2。
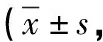
表2 两组患者NRS评分情况分)
2.3 两组癌性指标对比 治疗前,两组CA19-9及CEA值差异不显著(P>0.05);治疗后,两组CA19-9及CEA水平均比治疗前有所降低,观察组降低程度比对照组更显著,差异具备统计学意义(P<0.05),详见表3。
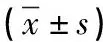
表3 两组CA19-9及CEA水平
3 讨论
胰腺癌往往一经发现便已是晚期,错过了手术最佳时机,化疗成为患者首选治疗方案。Nab-P是一种新型靶向制剂,通过纳米技术手段将人血白蛋白与紫杉醇组合成直径130nm左右的胶状悬浮颗粒,该技术利用人血白蛋白优越的转运功能,由肿瘤间质中的酸性分泌蛋白(富含半胱氨酸)与血管内皮GP120介导紫杉醇完成集聚,克服了传统紫杉醇制剂导致的多重副反应,提升了其药代动力学优势[7]。朱斌等人[8]采用吉西他滨联合Nab-P治疗中晚期胰腺癌,较好地延长了患者的无进展生存期并提高了总生存率;黄少江[9]将Nab-P联合贝伐珠单抗对晚期胰腺癌患者展开治疗,有效控制了其病情的进展。替吉奥是一种由替加氟、吉美嘧啶和奥替拉西钾复合而成的制剂,其主要通过肝药酶作用不断转化为5-氟尿嘧啶(5-Fu),后者则因分子量较小,在细胞膜及组织间隙的穿透能力较强,能够轻易穿过肿瘤表面组织,并经肝脏分解代谢出人体,副作用较小。
在此基础上,本文观察组选取Nab-P联合替吉奥对20例胰腺癌患者展开治疗,观察其与单一替吉奥组患者的临床疗效差异发现,观察组疾病控制率DCR显著高于对照组,但两组客观有效率ORR差异不显著,这与韩世炜[10]报道的观察组ORR高于对照组有所不同。DCR提高的原因可能是Nab-P以白蛋白作为载体,促进药物集聚,增加了肿瘤细胞内的有效药物浓度,阻碍癌细胞增殖,从而增强了化疗效果[11]。ORR两组差异不明显的影响因素可能是本文选取的病例数量过小导致的。另外,本文结果证实观察组NRS评分低于对照组,说明其癌性疼痛得到了较好缓解。
CA19-9及CEA是常用的血清肿瘤标记物,CA19-9主要存在于胰管上皮细胞及胃肠道、胆道内,消化道肿瘤的发病可引起其水平的升高,CEA是一种由胚胎组织产生的抗原物质,出生后逐渐减少至消失,当肿瘤发生时又会重新合成,并分泌至血液中[6]。本文对两组患者治疗后的CA19-9及CEA进行检测发现,观察组两种标记物水平显著低于对照组,提示患者病情得到了有效抑制。
综上所述,针对胰腺癌患者采用Nab-P联合替吉奥治疗,能够有效控制病情进展,缓解疼痛,具有一定推广意义。

