蜡样芽孢杆菌与酿酒酵母混菌发酵效果探究
程国富,郑自强,卫春会,黄治国
(1.四川宇晟酒业投资管理有限公司成都分公司,四川成都 610000;2.四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川宜宾 644000)
蜡样芽孢杆菌(Bacillus cereusFrankland)属于芽孢杆菌属(Bacillus),革兰氏阳性菌,菌体两端较平整,多呈链状排列,是一种好氧性细菌,可产抗菌、增香物质,抑制不利环境微生物的繁殖[1-3]。酿酒酵母(Saccharomyces cerevisiae)是白酒酿造的主体菌种,可将原料中的氨基酸等前体物质转化为重要风味物质,并合成多种酶,对白酒的产量和风味有重要影响[4]。
随着我国白酒产业的迅速发展,单一菌种的普遍应用引起白酒风味特征同质化,商业竞争力降低,混菌发酵逐渐受到关注,混菌发酵能改变发酵产物的风味特征,改善酒质,使风味更加丰富、浓厚[5]。在白酒酿造过程中,微生物混菌发酵研究也十分典型,徐岩等[6]将酿酒酵母和异常毕赤酵母(Pichia anomala)共培养的结果表明,混菌发酵可丰富醛类物质的种类,高级醇含量与总酸含量相对减少,有效改善了发酵液的风味特性,有利于增加发酵产物的风味复杂性。吴轩德等[7]利用混菌发酵采用同步接种和顺序接种方式研究了酿酒酵母与巴氏醋杆菌(Acetobacter pasteurianus)的相互作用有利于乙酸乙酯的合成,其最高达595.72 mg/L±5.01 mg/L,是单菌发酵的10.1倍。
目前,微生物在白酒生产中的作用研究,主要是通过提高功能微生物在发酵过程中的浓度来改善白酒品质,虽然已经取得了一些进展,但对功能微生物的筛选应用还存在不足,同时缺乏发酵过程中重要微生物之间互相作用的研究以及应用微生物在发酵过程结构变化的解析,从而在本质上对发酵过程机理认识不足[8]。俗话说“好曲产好酒”,而大曲在曲中表现出优良的性能,从大曲中筛选芽孢杆菌并运用于曲,更具有研究意义,本研究以前期从高温大曲中筛选得到的蜡样芽孢杆菌为研究对象,检测分析蜡样芽孢杆菌的生产性能,探究蜡样芽孢杆菌与酿酒酵母共发酵的效果,以期有效提高白酒品质,为中国白酒酿造机制提供参考依据,为微生物相互作用运用于酿造工业生产提供理论背景[9]。
1 材料与方法
1.1 材料、试剂及仪器
蜡样芽孢杆菌:从川南某酱香型白酒厂高温大曲中分离得到的菌种;酿酒酵母:酿酒生物技术及应用四川省重点实验室菌种。
可溶性淀粉、酪素、浓盐酸、蔗糖、葡萄糖、氢氧化钠均为分析纯,甲醇、正己烷均为色谱纯,卢氏碘液,购自成都市科龙化工试剂厂;牛肉膏、蛋白胨、酵母浸粉和琼脂均为生物试剂,购自北京奥博星生物技术有限责任公司。
仪器设备:LRH-250 生化培养箱,上海齐欣科学仪器有限公司;ZHWY-103D 恒温培养振荡器,上海智城分析仪器制造有限公司;MLS-3020 全自动高压蒸汽灭菌锅,北京艾飞博科技有限公司;DZKW-4 水浴锅,北京市中兴伟业仪器有限公司;7890A-5975B 气相色谱质谱联用仪,美国Agilent;Sherlock 微生物鉴定系统,美国MIDI;Scan1200 全自动菌落分析仪,上海智理科学仪器有限公司。
1.2 试验方法
1.2.1 培养基
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,用氢氧化钠调节pH7.0,121 ℃灭菌20 min。
液态发酵培养基:土豆200 g/L,葡萄糖20 g/L,牛肉膏1.5 g/L,蛋白胨5 g/L,氯化钠2.5 g/L,121 ℃灭菌20 min。
固态发酵培养基:原料按高粱∶麸皮∶水=3∶2∶4配比60 g,接入5 U/g α-淀粉酶,以30 ℃恒温水浴2 h;淀粉酶液化,接入150 U/g 糖化酶60 ℃恒温水浴20 h,121 ℃灭菌20 min。
1.2.2 菌种的生理生化和耐受性
菌落形状确定:分别取两株菌株于牛肉膏蛋白胨琼脂培养基平板涂布,37 ℃恒温倒置培养24 h,观察记录菌落形态。
生理生化试验:参照钟小廷等[10-13]《产细菌素蜡样芽孢杆菌的筛选、鉴定及培养基优化》的步骤及方法,分别对菌株进行革兰氏染色、糖发酵试验、淀粉水解试验、乙酰甲基甲醇试验、过氧化氢酶试验。
耐受性试验:①制备菌悬液:取0.9%的生理盐水9 mL,接种稀释至10-1、10-2、10-3,分别取样,用血球计数板计数,镜检,配制浓度梯度为10-7~10-8的菌悬液。②温度耐受性试验:移取1 mL 菌悬液于细菌种子液LB 培养基,分别于35 ℃、37 ℃、40 ℃、45 ℃、50 ℃、60 ℃,在转速170 r/min 摇床中培养24 h,于600 nm下测定培养液的吸光值,并计数;③pH 值耐受性试验:移取1 mL 菌悬液于细菌种子液LB 培养基,控制温度为40 ℃,调节初始pH 值分别为5.50、6.00、6.50、7.00、7.50、8.00,在转速170 r/min摇床中培养24 h,于600 nm 下测定培养液的吸光值,并计数;④耐乙醇试验:移取1 mL 菌悬液于细菌种子液LB 培养基,控制温度为40 ℃,初始pH7.0,调节初始乙醇浓度分别为6 %vol、8 %vol、10%vol、12%vol、14%vol、16%vol、18%vol,在转速170 r/min 摇床中培养24 h,于600 nm 下测定培养液的吸光值,并计数。
1.2.3 菌种在液态发酵中的相互作用
接种顺序对蜡样芽孢杆菌与酿酒酵母混菌发酵的影响:分别按不同顺序接种于液态发酵培养基,37 ℃,150 r/min 摇床中培养2 d,并计数[14-15]。接入时间对蜡样芽孢杆菌与酿酒酵母共发酵的影响:分别以0 h、2 h、4 h、6 h、8 h、10 h的时隔接入液态发酵培养基,37 ℃、150 r/min摇床中恒温培养2 d,并计数。全程均无菌操作,所有试验均做3 个平行试验。
1.2.4 菌种固态发酵对比研究
固态单发酵:取B-1、B-2 蜡样芽孢杆菌1×107CFU/mL 11 mL 于不同固态发酵培养基中,在37 ℃下发酵20 d。固态共发酵:先接入B-1、B-2蜡样芽孢杆菌1×107CFU/mL 11 mL 于不同固态发酵培养基中培养4 h 后,分别接入酿酒酵母1×107CFU/mL 11 mL,在37 ℃下发酵20 d。空白:接入空白细菌种子液LB 培养基11 mL,空白土豆培养基11 mL,在37 ℃下发酵20 d。
1.2.5 发酵产物风味分析
样品前处理:称取3 g 固态发酵样品于顶空瓶中,将顶空瓶放入全自动固相微萃取仪中,于55 ℃平衡10 min,萃取30 min。气相色谱条件:DBWAX 60.0 m×0.25 mm×0.25 µm 毛细管色谱柱;进样口温度230 ℃;分流比20∶1;程序升温:50 ℃保持3 min,以5 ℃/min 升至150 ℃,保持2 min,再以10 ℃/min 升至230 ℃,保持2 min,载气:99.999 %氦气,载气流速:1 mL/min。质谱条件:电离电压70 eV,离子源温度为230 ℃,四极杆温度为150 ℃,电离方式为EI,全扫描。
1.2.6 数据处理
通过固相微萃取气相色谱质谱联用法(HSSPME-GC-MS)检测分析蜡样芽孢杆菌与酿酒酵母混菌发酵产物,采用NIST8.0 谱库检索分析风味物质成分;利用SPSS 软件进行方差分析,数值以“平均值±标准偏差”表示。
2 结果与分析
2.1 蜡样芽孢杆菌的形态和生理特性
从形态分类结果分析(图1),B-1 号菌株单菌落为白色,直径为1~3 mm,边缘不光滑,不透明,菌落比较干燥,易挑取,且挑起无黏性;B-2 号菌株单菌落为白色泛红色,直径为1 mm,菌落扁平,较干燥,易挑取,且挑起无黏性。两株菌均为革兰氏阳性菌,菌株均能利用葡萄糖以及蔗糖产酸,且产过氧化氢酶和淀粉酶(表1)。
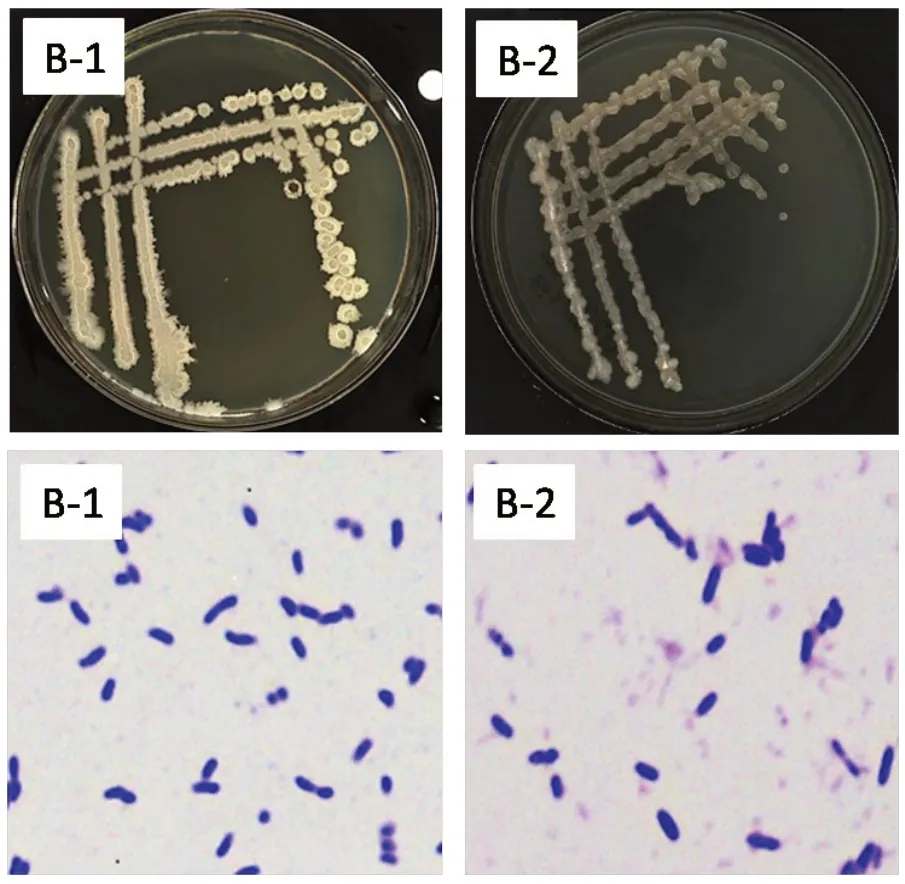
图1 蜡样芽孢杆菌菌落形态和革兰氏染色镜检图(10×100)
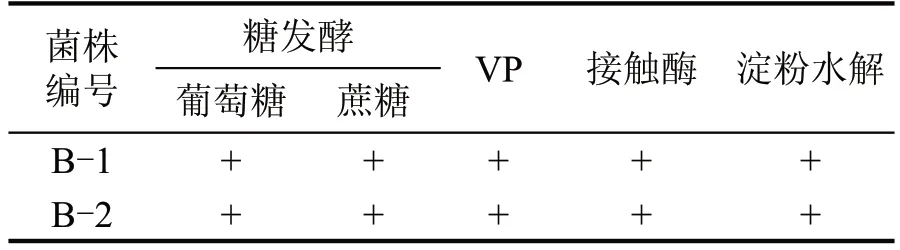
表1 蜡样芽孢杆菌生理生化鉴定结果
2.2 蜡样芽孢杆菌的耐受性
培养条件影响细菌的生长、代谢活动,适宜的培养环境能使菌株生长情况良好,有利于发挥其生产性能。适宜的温度能使细菌有效地吸收培养基中的营养成分,也同时影响菌株的应激性[14]。蜡样芽孢杆菌的生长、代谢不仅可能会产生酸类物质,改变环境酸度,而且不适宜的外部酸度环境也对其活性有调控作用,导致其生长及代谢异常[17],同时,高浓度的乙醇是一个典型的极端条件,更高的乙醇耐受性有助于蜡样芽孢杆菌运用于实际酿造生产[18]。不同培养温度对菌株的影响结果见表2,不同初始pH值对蜡样芽孢杆菌的影响结果见表3,不同初始乙醇浓度对菌株的影响结果见表4。
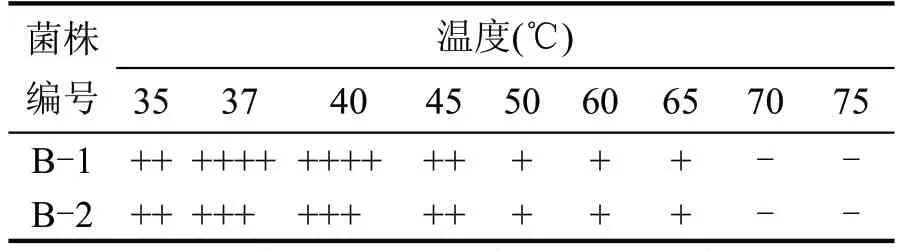
表2 不同培养温度对蜡样芽孢杆菌的影响
两株菌的最适生长温度为37 ℃左右,最高耐受温度为65 ℃,热耐受性情况基本相同,过高的培养温度会降低菌株的存活率,故蜡样芽孢杆菌的培养温度应控制在37~40 ℃为宜。

表3 不同初始pH值对蜡样芽孢杆菌的影响
当生长环境趋近中性条件时,B-1、B-2均能有较好的长势,芽孢杆菌在中性的环境下能实现生物量的最大富集。故控制B-1、B-2 菌株在中性或弱酸性条件下生长有助于提高其生产性能。
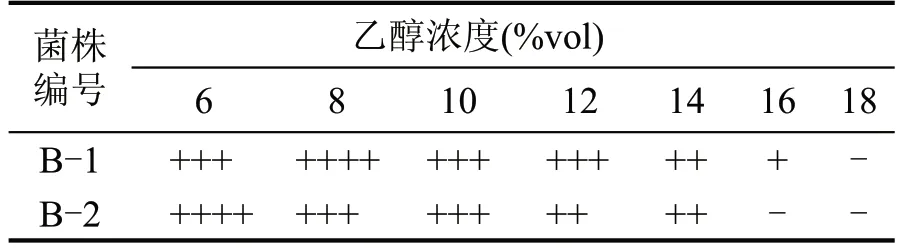
表4 不同初始乙醇浓度对菌株的影响
B-1 菌株在较高的乙醇浓度下仍然生长良好(最大耐受浓度为16 %vol),较B-2 菌株表现出更高的乙醇耐受性(最大耐受浓度为14 %vol),同种菌内在生理特性差异会在一定程度上表现出不同的胁迫表征,致使在相同的酿造条件下,B-1 菌株表现出更优良的生产性能。
2.3 菌种的相互作用
液态发酵适应现代化工业生产,原料适应性强、辅料用量少,且能极大地改善劳动、生产环境[17],模拟蜡样芽孢杆菌与酿酒酵母液态混菌发酵环境能一定程度体现其实际生产价值。发酵过程中,不同的接种顺序以及接种时间会影响菌株的营养利用情况,从而影响菌株代谢,不同的接种顺序、接种时间对液态共发酵影响分别见图2、图3。
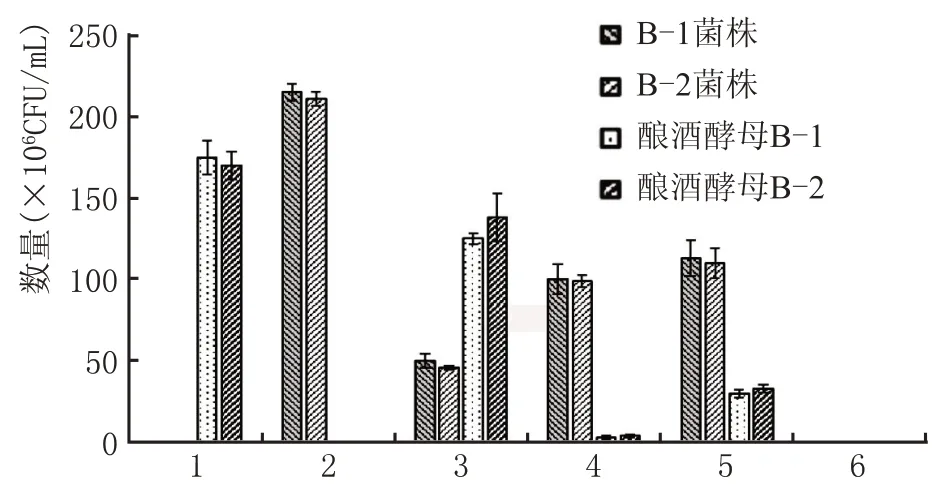
图2 不同接种顺序对菌种数量影响
由图2 可知,先接入酿酒酵母,后接入蜡样芽孢杆菌的接种顺序可使蜡样芽孢杆菌数量与酿酒酵母较为接近,B-1 菌株接种情况整体较B-2 菌株略好。混菌发酵相较于单独酵母培养,虽然蜡样芽孢杆菌数量相对减少,但仍处于一个数量级,这是由于酿酒酵母的发酵过程会产酸,致使发酵环境处于酸性条件,从而抑制了适合于中性生长环境的B-1、B-2 蜡样芽孢杆菌的生长;编号4 中酵母菌数量极少,蜡样芽孢杆菌在此培养条件下生长较快,成为优势菌种,吸收了酿酒酵母生长代谢所需的营养物质,抑制了酿酒酵母的生长;编号5 酿酒酵母与蜡样芽孢杆菌相差一个数量级,可能为同等环境下,蜡样芽孢杆菌相较于酿酒酵母优先进入对数生长期,优先获取发酵液中营养,故长势优于酿酒酵母,但混菌发酵的营养物质受限,相较于编号2 数量更少。综合上述结果:编号3 即先接入酿酒酵母,后接入蜡样芽孢杆菌的接种顺序更有助于蜡样芽孢杆菌与酿酒酵母共混菌酵,利于实际生产。
两株菌生长情况差异较小,先接酿酒酵母,时隔4 h 接入蜡样芽孢杆菌的接种方式可使蜡样芽孢杆菌数量级与酿酒酵母数量级最为接近。在时隔少于4 h 接入蜡样芽孢杆菌的发酵培养基中,蜡样芽孢杆菌数量远大于酿酒酵母,分析其原因,蜡样芽孢杆菌的生长周期较短,生长4 h 左右便进入对数生长期,消耗了酿酒酵母代谢所需的营养物质,随着接种时隔继续延长,酵母抑制蜡样芽孢杆菌的生长,成为优势菌株,可能是酵母代谢产物的积累对蜡样芽孢杆菌有抑制作用。综合上述结果,接入蜡样芽孢杆菌后,最适接入酿酒酵母时间为4 h。
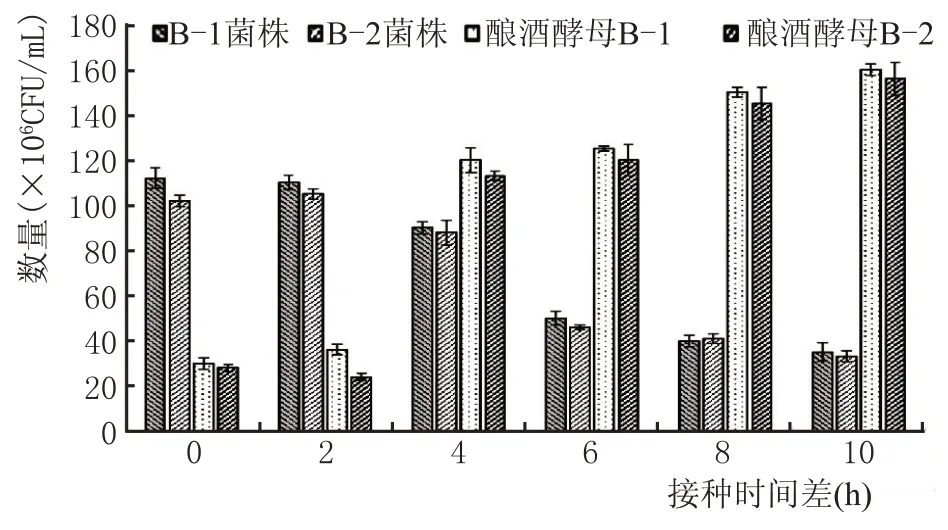
图3 不同接种时间对菌种数量影响
2.4 混合固态发酵的代谢产物分析
固态发酵法是生产大曲酒应用最广泛的酿造方法之一,其法有增粮香、改善酒质等优点。故本研究模拟固态酿造环境,利用HS-SPME-GC-MS对发酵液进行风味物质成分鉴定[19-21],探索两株蜡样芽孢杆菌与酿酒酵母混菌发酵的代谢性能,各香味成分鉴定结果见表5。
由表5 可知,混菌发酵相较于单菌发酵,共新增27 种风味物质,醇类、酯类、酚类、酸类、醛酮类、杂环类及烷烃类化合等风味物质均有所增加,特别是醇类及酯类物质产量有较大提高。丙二醇、苯乙醇在单菌发酵中均未检测到,而B-1、B-2 混菌发酵的苯乙醇产量分别达12.86 mg/kg、13.71 mg/kg,对促进形成酒体风味、促使酒体丰满、浓厚起着重要的作用;单菌发酵产酯类较少,其中辛酸乙酯、α-戊基-γ-丁内酯、苯乙酸乙酯、丙位辛内酯均只产生在混菌发酵中,酯类具有增香作用,混菌发酵可促使酒体呈香多样性上升,放香更为饱满协调。酚类物质如愈创木酚主要呈现出烟熏风味,为酱香型白酒的重要香味成分,具有良好的抗氧化活性,B-1 单菌发酵愈创木酚含量为2.5 mg/kg,B-2 单菌发酵愈创木酚含量为4.20 mg/kg,而混菌发酵产量分别提升至4.6 mg/kg,5.30 mg/kg,增香效果显著。在酸类方面,产乙酸能力混菌发酵表现为协同作用,其中B-1 从不产乙酸到产量提升为13.90 mg/kg,B-2 混菌发酵也更有益于乙酸的生成,酸类物质在白酒风味中起调和、烘托作用,使酒体口感更为醇和。杂环类化合物主要产物为2,3-二甲基吡嗪,2,3,5-三甲基吡嗪等吡嗪类物质,B-1 菌株共发酵菌株产量由8.5 mg/kg 提高至16.40 mg/kg,B-1 与酿酒酵母混菌发酵表现出明显的优势,B-2 菌株则表现出更良好的生产性能,B-1 混菌发酵与单菌发酵相比,新产生了2,3-二甲基-5-乙基吡嗪等风味物质,且四甲基吡嗪含量有较大提升,其具有扩张血管,改善血循环、护肝等功效,为白酒中的健康风味成分[22-23]。固态发酵环境下,混菌发酵表现出更好的协同作用,促进了乙酸乙酯、乙酸、2,3-二甲基-5-乙基吡嗪、麦芽醇、1-十五炔等27 种风味物质的生成,其中醇类、酯类、吡嗪类物质所占比例较大,可有效增加风味成分丰富度,凸显酒体主要呈香,使放香更为饱满协调。愈创木酚、四甲基吡嗪等有益风味成分的提升在改善酒质,发掘其药理作用方面具有积极影响。
3 结论
本研究是从川南某酱香型白酒厂高温大曲中分离得到两株蜡样芽孢杆菌,检测分析蜡样芽孢杆菌与酿酒酵母生产性能,并模拟液态和固态发酵环境,探索混菌发酵与单菌发酵差异,为混菌发酵运用于酿造生产提供理论参考。其中蜡样芽孢杆菌对酿酒酵母的生长有一定的抑制作用,但通过调节添加方式可以削弱这种抑制效应。蜡样芽孢杆菌和酿酒酵母协同固态发酵能够促进乙酸乙酯、乙酸、苯乙醇、2,3-二甲基-5-乙基吡嗪、麦芽醇、1-十五炔等27 种风味物质的生成,特别是能提高愈创木酚、四甲基吡嗪等有益风味成分产量,这将有利于改善白酒酒质,同时能发掘其药理作用方面具有积极影响。
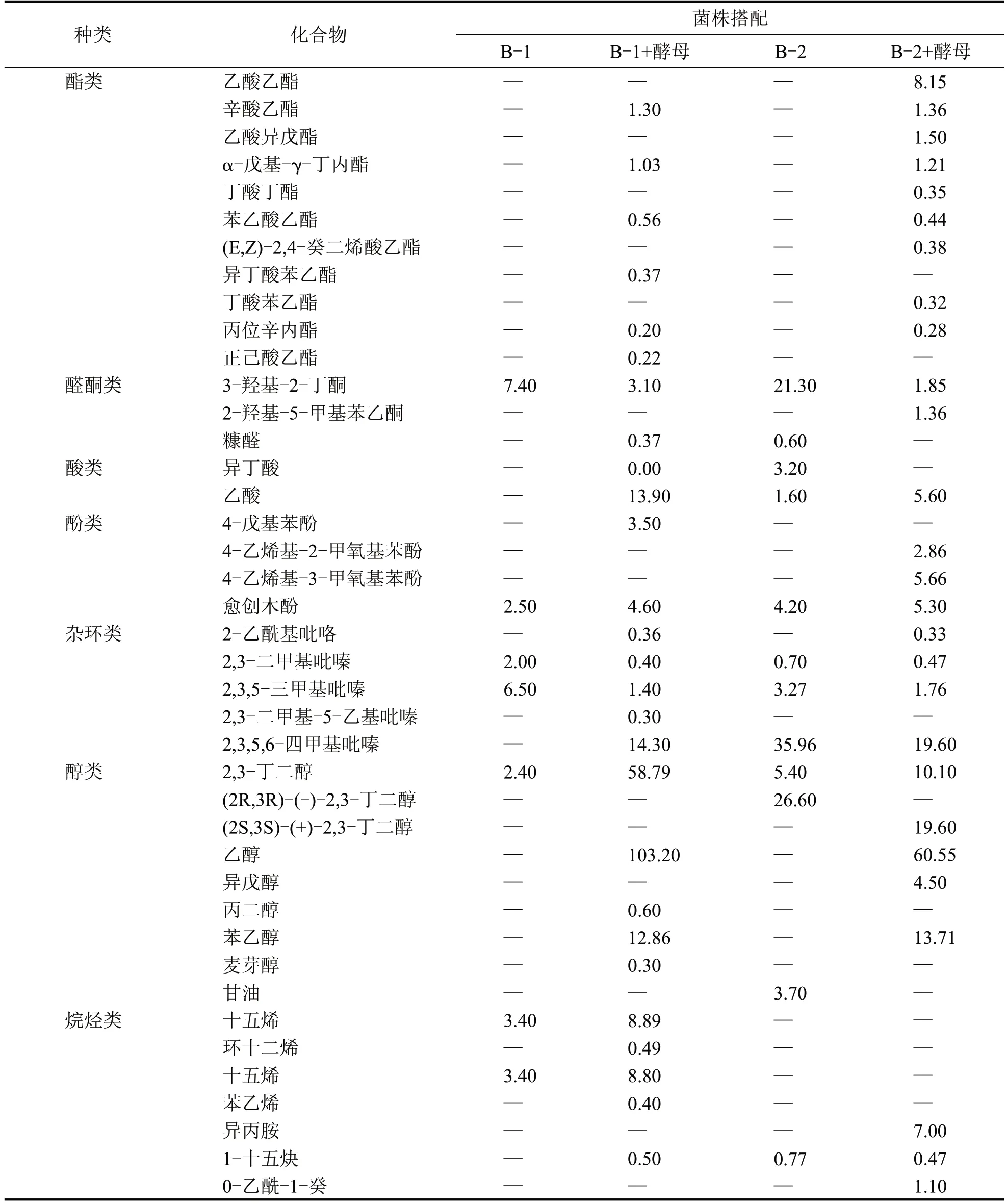
表5 混菌发酵与单菌发酵香味成分分析鉴定结果 (mg/kg)