牛蒡子苷元通过SIRT1/NLRP3途径减轻哮喘小鼠气道炎症
朴艺花,宋艺兰,王知广,姜京植,李良昌,朴红梅,延光海
(1.延边大学附属医院 重症医学科,吉林 延吉 133000;2.吉林省过敏性常见疾病免疫与靶向研究重点实验室,吉林 延吉133002;3.延边大学医学院解剖教研室,吉林 延吉 133002;4.延边大学附属医院呼吸与危重病医学科,吉林 延吉 133000)
支气管哮喘是呼吸系统常见气道慢性炎症疾病之一。近年来,随着空气污染等环境因素的改变,支气管哮喘等过敏性呼吸系统疾病的发病率越来越高[1]。哮喘的主要病理表现为气道炎症、气道高反应性和气道重塑,其中气道炎症是哮喘的本质特征。目前认为辅助性T淋巴细胞(T helper cell,Th)两种亚型Th1、Th2之间的平衡失调也是是哮喘发作的机制之一[2]。因此,研究哮喘的发病机制及治疗药物具有十分重要的意义。
沉默信息调节因子1(silent information regulator 1,SIRT1)是Sirtuins家族(SIRT1-7)的一员,是最近发现的III型烟酰胺腺嘌呤二核苷酸(NAD+)依赖性组蛋白去乙酰化酶[3]。SIRT1主要位于哺乳动物的细胞核中,通过乙酰化活性发挥其功能[3]。最近的研究表明,SIRT1可以调节NOD (nucleotide binding oligomerization domain)样受体家族3(NOD-like receptors,NLRP3)来抑制炎症的发生并延缓炎症反应[4]。NLRP3炎症小体是一种细胞内蛋白复合体,可以调节机体的炎症反应[5]。NLRP3炎症小体在激活需要半胱氨酸的天冬氨酸蛋白酶-1(caspase-1)中起关键作用。活化的caspase-1进一步介导促炎细胞因子及白细胞介素-1β (interleukin-1β,IL-1β)和白细胞介素-18 (interleukin-18,IL-18)的成熟和分化,最后会诱发机体的炎症反应[6]。
牛蒡子苷元(arctigenin,ATG)是从菊科二年生草本植物牛蒡的干燥成熟果实牛蒡子中提取的木脂素类化合物[7],具有多种生物活性,包括抗炎、抗氧化、抗癌和抗病毒[8-10]。有研究表明,牛蒡子苷元可以通过抑制核因子κB(nuclear factor kappa-B,NF-κB)活化从而降低哮喘小鼠气道炎症,NF-κB已被证实可以激活NLRP3炎症小体加重炎症反应[11]。Pu等[4]研究发现,牛蒡子苷元通过SIRT1抑制NLRP3炎症小体减轻葡聚糖硫酸钠盐诱导的急性结肠炎的炎症反应。由此推断,牛蒡子苷元在卵清蛋白(ovalbumin,OVA)诱导的哮喘小鼠模型中有可能通过调控SIRT1抑制NLRP3炎症小体抑制气道炎症,为进一步治疗支气管哮喘提供实验依据。
1 材料与方法
1.1 药物与试剂牛蒡子苷元(批号:HB-01110),纯度≥98.0%,购自武汉科斯坦生物科技有限公司;卵清蛋白(ovalbumin,OVA,批号:9006-59-1)、氢氧化铝粉(批号:24623-77-6),美国 Sigma 公司;β-actin抗体(#3700),购自美国 Cell Signaling Technology(CST)公司,SIRT1(ab18239)、Caspase-1(ab19672)、IL-18(ab19954)和IL-1β(ab16805-15),购自美国Abcam公司。NLRP3(#768319)、胶原酶A(#17100017,Gibco,US),DNase I(#D5025-150KU,Sigma-Aldrich,US),FITC-CD4(#11-0041-82)、PE-CY7-IL-4(#25-7042-41)、APC-IFN-γ(#17-7319-41)、Goat anti-Mouse IgG1 Cross-Adsorbed Secondary Antibody,Alexa Fluor 488(#A-21121)及透化试剂盒(#88-8824-00),购自美国invitrogen公司。全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、迪夫快速染色液(Diff-Quik Stain),购自北京索莱宝科技有限公司。
1.2 仪器JZ-8B 雾化器,北京九州晟欣科技有限公司;2135型轮转式切片机,德国 Leica 公司;Cytation5细胞成像微孔板检测系统,美国Biotek公司;15K高速冷冻台式离心机,美国Sigma公司;CytoFLEX流式细胞仪,美国Beckman Coulter公司;电泳仪及电泳槽(批号:E-C),美国Apparatus Corporation公司;Western blot转膜仪,美国Bio-Rad公司;TXD3细胞涂片离心机,广州泸瑞明仪器有限公司。
1.3 实验动物及分组实验动物为♀清洁级 BALB/c小鼠40只,鼠龄4-6周,体质量(20±2)g,由延边大学实验动物中心提供,合格证号为 [SYXK(吉)2020-0010]。在整个研究过程中,所有动物均在12 h光照-黑暗周期、温度(22±2)℃和相对湿度(55±5)%的条件下饲养。本实验已通过延边大学医学院伦理委员会的批准(批号:IACUC- 20170105039),并按照《实验动物管理条例》,尽可能做到减轻小鼠痛苦。
将40只BALB/c小鼠随机分为5组,每组8只,分为正常对照组(control)、OVA 诱导的哮喘模型组(OVA)、ATG 5 mg·kg-1、ATG 10 mg·kg-1和ATG 20 mg·kg-1组。
1.4 小鼠哮喘模型的制备BALB/c小鼠在层流室饲养 1 周,随后d 1、7、14,正常对照组小鼠每只腹腔注射200 μL生理盐水,其余4组小鼠均腹腔注射200 μL致敏液(致敏液的组成为 10 μg卵清蛋白,1 mg氢氧化铝佐剂和生理盐水)。从d 17开始,正常对照组和OVA组每天腹腔注射二甲基亚砜(DMSO)200 μL,ATG组分别腹腔注射溶于DMSO的ATG(5、10、20 mg·kg-1)200 μL。于d 21,在每日腹腔注射给药1 h后,除了正常对照组使用生理盐水雾化吸入,OVA组和ATG组激发使用3% OVA 10 mL雾化液,30 min·d-1,连续激发3 d。最后一次注射后,小鼠24 h内被处死(Fig 1)。

Fig 1 Model preparation diagram
1.5 标本收集小鼠在末次给药激发24 h后,采用吸入过量乙醚至死,手术部位用乙醇消毒,消毒后使用手术剪刀剪开小鼠颈部皮肤并剥离,暴露气管,在气管中上段剪“-”型切口,并置入软管接1 mL注射器,气管内注入缓慢注入1 mL冷生理盐,同时轻柔小鼠胸部,逐渐回抽,重复冲洗2次,回抽的液体即支气管肺泡灌洗液,肺泡灌洗液3 000 r·min-1离心10 min,提上清液置-80 ℃冻存。剩余的沉淀用于细胞涂片,再将小鼠两侧肺组织剥离,左肺置4%甲醛中固定,右肺-80 ℃冻存。
1.6 支气管肺泡灌洗液( bronchoalveolar lavage fluid,BALF) 中炎症细胞分类及计数BALF以3 000 r·min-1离心10 min后的剩余沉淀中加入生理盐水,至600 μL,充分混均匀后,取200 μL用于细胞涂片,置入细胞涂片离心机,以1 000 r·min-1离心5 min制备细胞涂片。采用迪夫快速染色液(Diff-Quik Stain)染色,在光学显微镜下进行炎症细胞分类及计数。
1.7 肺组织学检查置于4%甲醛中的左肺依次给予脱水、浸蜡、包埋等步骤,并分别进行HE、PAS染色。
1.8 流式细胞术将小鼠肺组织切成小块放入6孔板中,加入1 g·L-1胶原酶A和1 500 kU·mL-1DNase I以及0.025 mol·L-1CaCl2,并在37 ℃孵育4 h进行消化获得的单细胞悬液,选取1×106细胞用于流式检测。染色步骤为:首先行细胞表面染色,用FITC-CD4抗体,4 ℃孵育30 min;再利用细胞固定和透化试剂盒进行破膜打孔;最后进行胞内染色,抗体选用PE-CY7-IL-4和APC-IFN-γ,在4 ℃孵育30 min。在CD4阳性T细胞群中分析IL-4和IFN-γ阳性细胞的比例。
1.9 蛋白免疫印迹法(Western blot)按照全组织蛋白提取试剂盒说明书,提取各组小鼠右肺组织蛋白,采用BCA法蛋白定量后按比例添加双蒸水、上样缓冲液(5×),并在100 ℃沸水上变性5 min。自然冷却至室温。每个泳道加20 μL蛋白样品,用8%-12% SDS-PAGE 凝胶在90 V电压下电泳90 min左右,分离后,转移到PDVF膜中,加入5%脱脂奶粉封闭液中,室温封闭2 h,TBST缓冲液洗膜,加入按1 ∶1 000比例稀释的一抗(SIRT1、NLRP3、caspase-1、IL-1β、IL-18、β-actin)4 ℃过夜后TBST缓冲液洗膜,然后加相应的二抗,室温孵育1 h。最后加入ECL发光试剂,利用Amersham Imager 600采集图像。
1.10 免疫荧光步骤如下: (1)将各组肺组织石蜡切片在60 ℃烤片机上烤片1 h,在室温放置 5 min; (2)常规石蜡切片脱蜡至水后,放入一蒸水中2 min; (3)在枸橼酸盐溶液浸泡切片,微波高火修复 5 min 后,室温自然冷却至30 ℃,PBS缓冲液(×1)洗5 min × 3次; (4)加3%BSA溶液,封闭 60 min,PBS缓冲液(×1) 洗5 min × 3次,加1 ∶50稀释的NLRP3抗体,4 ℃过夜; (5)拿出湿盒室温孵育1 h,PBS缓冲液(×1)洗5 min × 3次; (6)加1 ∶100稀释的羊抗鼠荧光二抗,避光孵育1 h,PBS缓冲液(×1)洗 5 min × 3次; (7)加DAPI染核3 min,PBS缓冲液(×1)洗5 min × 3次; (8)最后用荧光防淬灭封片剂封片后镜下观察。

2 结果
2.1 ATG对OVA诱导的哮喘小鼠肺组织病理改变的影响如Fig 2所示,肺HE染色显示,与正常对照组相比,OVA组小鼠肺可见细支气管周围的炎症细胞的浸润,而ATG治疗组显著减轻炎症细胞浸润。PAS染色显示,ATG对OVA 诱导的气道上皮的黏液分泌增多和杯状细胞的增生抑制作用。以上结果提示ATG可以减轻哮喘小鼠气道周围炎性改变。
2.2 ATG抑制OVA诱导的哮喘小鼠模型BALF中炎症细胞的生成如Fig 3所示,除正常对照组以外,余OVA组、ATG组小鼠BALF中总细胞数(Total)与嗜酸性粒细胞(eosinophil,EOS)、中性粒细胞(neutrophil,NEU)、淋巴细胞(lymphocyte,LYM)的细胞数均不同程度升高。与OVA组相比,ATG组的总细胞数与EOS、NEU、LYM均明显减少。由此得出,ATG可以缓解气道炎症反应。
2.3 ATG抑制OVA诱导的哮喘小鼠肺组织中炎症细胞因子的含量如Fig 4所示,与正常对照组相比,OVA组哮喘模型小鼠肺组织中Th1型细胞因子干扰素-γ(IFN-γ)水平明显下降,Th2细胞因子(IL-4)的水平明显升高,ATG治疗能够显著升高IFN-γ水平同时降低IL-4的水平。以上结果提示哮喘小鼠模型中Th1亚群功能低下,Th2亚群亢进有关。经ATG治疗能够明显改善OVA诱导的哮喘小鼠肺组织中Th1、Th2功能失衡。
2.4 ATG通过SIRT1抑制OVA诱导的哮喘小鼠肺组织中NLRP3炎症小体的表达如Fig 5A所示,Western blot结果中可以观察到OVA组肺组织中SIRT1蛋白表达与正常对照组相比,明显被抑制,但NLRP3、caspase-1、IL-1β和IL-18蛋白表达明显升高。与OVA组相比,ATG组SIRT1蛋白表达明显升高,且抑制NLRP3、caspase-1、IL-1β和IL-18蛋白的高表达。Fig 5B肺组织免疫荧光结果同样提示,经OVA诱导后NLRP3荧光强度明显增强,经ATG治疗后NLRP3荧光强度显著下降。结果表明,牛蒡子苷元激活SIRT1信号通路抑制OVA诱导的哮喘小鼠肺组织的NLRP3炎症小体。

Fig 5 (A) Detection of SIRT1,NLRP3,caspase-1,IL-1β and IL-18 protein by Western blot;(B) Fluorescence intensity of NLRP3 in lung tissues determined by immunofluorescence(×200). ##P<0.01 vs control; *P<0.05,**P<0.01 vs OVA.

Fig 4 Effect of ATG on levels of IFN-γ and IL-4 cytokines in lung tissues of
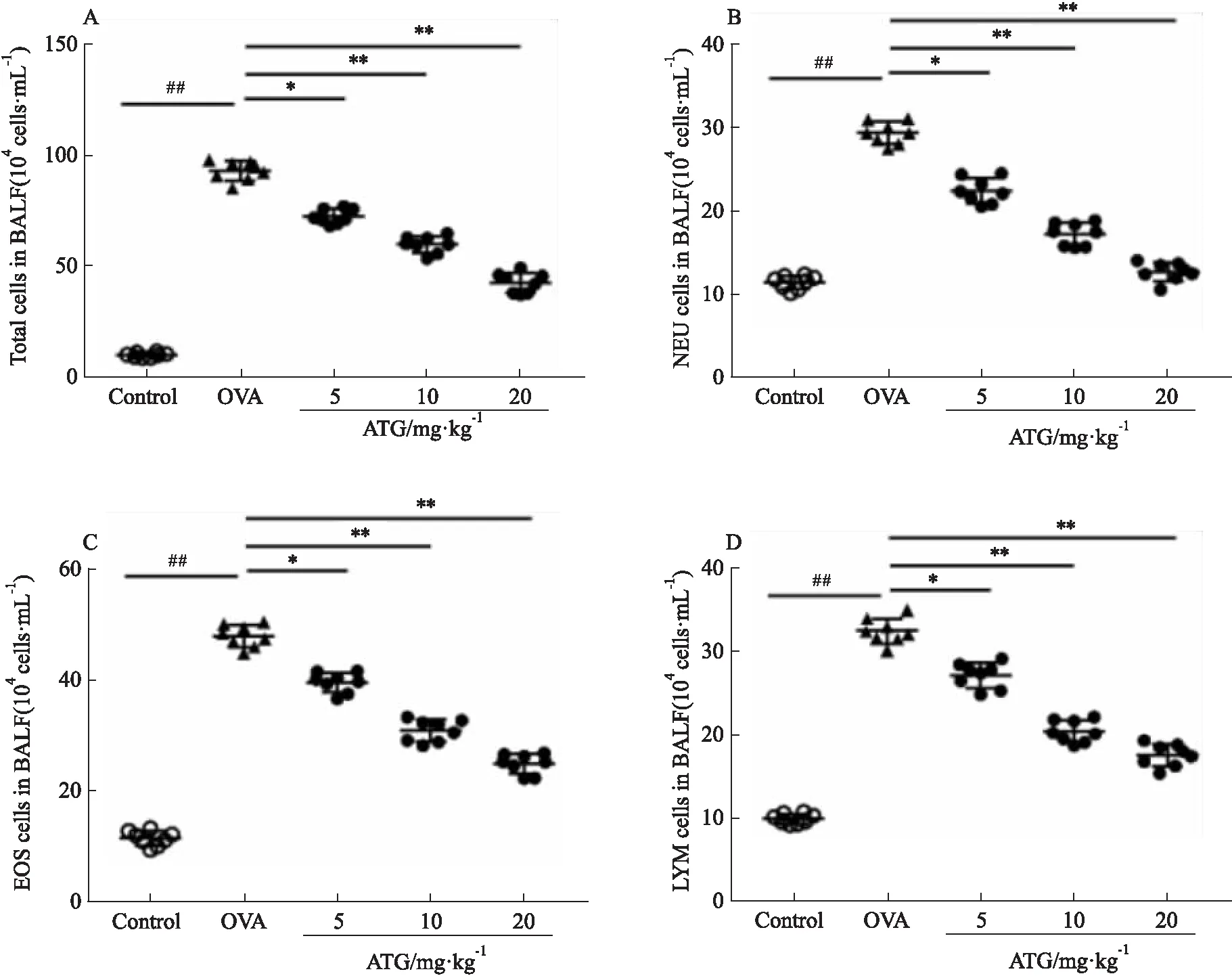
Fig 3 Effect of ATG on number of different inflammatory cells in BALF of EOS: Eosinophil; NEU: Neutrophil; MAC: Macrophage; LYM: Lymphocyte. ##P<0.01 vs control; *P<0.05,**P<0.01 vs OVA.
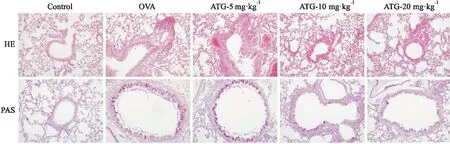
Fig 2 Effect of ATG on pathological changes of lung tissues(×200)
3 讨论
哮喘是一种反复发作的慢性炎症性疾病,不仅发病率高,且难以有效治愈,其最有效的治疗方式仍是使用激素类药物。牛蒡子苷元(ATG)广泛应用于炎性疾病的治疗中。既往研究表明,ATG在急性肺损伤模型中显著抑制LPS引起的肺组织炎症反应,且减少由LPS引起的白蛋白、中性粒细胞、巨噬细胞、淋巴细胞增多的现象[7]。本研究结果提示,HE染色、PAS染色结果显示,OVA诱导后支气管周围杯状细胞明显增生、大量黏液的分泌,炎症细胞浸润、渗出明显。OVA诱导的哮喘模型BALF中淋巴细胞、嗜酸性粒细胞、中性粒细胞等炎症细胞明显增多。而且OVA诱导的小鼠肺组织中Th1细胞因子IFN-γ的水平降低,同时伴随着Th2细胞因子IL-4的水平明显升高,提示OVA哮喘小鼠模型中Th1与Th2之间已失去平衡。ATG治疗后明显改善支气管周围黏液的分泌及炎症细胞的浸润,并降低肺泡灌洗液中总细胞数、中性粒细胞、淋巴细胞和嗜酸性粒细胞的数量。同时ATG治疗能够明显改善OVA 诱导的哮喘小鼠肺组织中Th1/Th2失衡。以上结果提示ATG通过减少炎症细胞总数和各分类细胞数、炎症细胞因子的含量,且同时减少哮喘小鼠气道周围的炎症细胞浸润和杯状细胞增生来抑制OVA诱导的哮喘模型小鼠气道炎症。
SIRT1是一种重要的抗衰老因子,SIRT1可调节炎性反应、调节基因表达、参与糖脂代谢等许多病理生理过程[12]。Peng等[13]研究发现,在慢性阻塞性肺疾病中,上调SIRT1可以抑制NLRP3炎症小体激活,抑制炎症反应。已证实SIRT1是NLRP3的负调控上游因子,SIRT1/NLRP3信号通路广泛研究于炎症性疾病、心脑血管疾病等[4,14]。值得注意的是,在哮喘模型中给予NLRP3抑制剂可抑制AHR和肺部炎症[15]。本实验Western blot结果提示,OVA可以抑制SIRT1蛋白表达,同时诱导NLRP3、caspase-1、IL-1β和IL-18蛋白高表达,经ATG治疗后被抑制的SIRT1表达逐渐升高,上调的NLRP3、caspase-1、IL-1β和IL-18蛋白表达明显被抑制。同样,肺组织荧光结果表明,ATG治疗可以明显减弱被OVA激活的NLRP3荧光强度。
综上所述,ATG可有效减轻OVA诱导的哮喘小鼠气道炎症细胞的浸润并降低其炎症细胞因子水平,并通过上调SIRT1蛋白表达,抑制NLRP3炎症小体,从而起到改善气道炎症的作用。以上实验结果表明,ATG改善气道炎症可能是与SIRT1/NLRP3通路密切相关。

