高频超声对α-硫辛酸联合中药封包治疗糖尿病周围神经病变的疗效评估
胡 培,郑光美,董正森,薛 锐,丁洪成,孙德姣,肖 彬
(十堰市人民医院(湖北医药学院附属人民医院)1.超声影像中心,2.麻醉科,3.内分泌科,湖北 十堰442000)
糖尿病周围神经病变(diabetic peripheral neu⁃ropathy,DPN)是糖尿病(diabetes mellitus,DM)患者常见并发症,如不早期诊断和干预,将会严重影响患者生活、威胁患者健康[1]。因此,在本病初期给予及时的诊治,可促进DPN 患者神经损伤的恢复,这对于DPN 患者具有十分重要的意义。目前,临床上对DPN 的治疗尚以对症治疗为主,如合理降糖、改善血供、营养神经等[1]。相关学者研究认为硫辛酸作为一种抗氧化剂可用于治疗DPN,其能多途径减缓神经损害,从而有效改善或消除DPN,但其疗效尚未得到临床证实。近年来,已有研究证实中药热敷疗法在DPN 中具有较好临床治疗效果[2]。若将上述两种方案联合引入DPN 治疗中,可发挥中药及抗氧化剂各自的优势,或可解决DPN 治疗方面的难题。本课题组近年来致力于DPN 的诊断与相关因素等研究[3],并为DPN 的筛查与随访提供新的联合诊断方法[4]。本研究为DPN 诊疗体系的进一步完善,课题组尝试应用α-硫辛酸联合中药封包治疗DPN,并利用高频超声、神经传导速度以及血清学检查综合评估该联合用药的疗效,为临床改善糖尿病神经损伤患者预后,提高生存质量提供必要帮助。
1 资料与方法
1.1 一般资料
选择2018 年12 月~2019 年12 月入院的110 例DPN 患者,均符合纳入标准及排除标准。根据不同的治疗方案分为观察组和对照组,其中观察组55例,男性29 例,女性26 例,年龄(55.13±5.29)岁,病程(10.23±2.16)年,BMI(23.9±1.21)kg/m2,收缩压(137.29±20.10)mmHg,舒 张 压(86.25±10.20)mmHg;对 照 组55 例,男 性30 例,女 性25 例,年 龄(53.46±4.15)岁,病程(9.97±1.98)年,BMI(23.5±1.17)kg/m2,收缩压(133.43±18.17)mmHg,舒张压(82.64±9.27)mmHg。两组在性别、年龄、病程、BMI 及血压等指标比较,差异无统计学意义(P>0.05),具有可比性。本研究经十堰市人民医院伦理委员会批准,并在其监督下实施,且治疗方案已充分告知患者及其家属,并自愿签署知情同意书。
1.1.1 诊断标准 (1)曾患有DM,或血清学诊断为DM 的患者。(2)患者的周围神经病变出现在DM 诊断之时或之后。(3)符合如四肢持续性的疼痛或感觉异常的症状和体征。(4)满足下述一项或多项阳性者(踝反射或膝反射、压力觉、震动觉、针刺觉)[3]。1.1.2 纳入标准 上述规定时间内医院收治的符合上述DPN 诊断标准的患者。
1.1.3 排除标准 (1)无法满足诊断标准及纳入标准者;(2)其他神经病变患者,如中毒、营养缺乏所致神经损伤、感染性疾病、多发性神经根神经病、恶性肿瘤等;(3)无法获得详细病史、病例残缺或无法配合治疗者;(4)患有精神疾病、凝血功能异常或多器官功能衰竭者[4]。
1.2 治疗方法与观察指标
两组患者均按DM 基础治疗方案合理控制血糖。对照组给予α-硫辛酸300 mg 加入0.9%氯化钠注射液250 mL 静脉滴注,1 次/d。观察组除上述治疗方法外,再引入中药(其成分为:白芷、续断、红花、没药、透骨草各12 克,当归、羌活、醋乳香各10克)打磨成粉,封入包中,并铺于患者患肢,环形捆扎,外敷30 min,2 次/d。两组均连续治疗30 d,利用肌电图及超声分别测量正中神经、尺神经及腓总神经NCV 及CSA,并观察3 种神经二维声像图的变化,比较治疗前、后的差异性,并记录比较血清学指标的变化。
1.3 资料收集方法
1.3.1 病史采集 将符合纳入标准的110 例DPN患者的年龄、病程、症状、既往史、过敏史等相关资料分类收集整理。测量并记录患者血压、体重、身高等指标,并计算体重指数(body mass index,BMI)。
1.3.2 实验室检查 持续监测患者7 次血糖值(空腹、早餐后2 h、中餐前、中餐后2 h、晚餐前、晚餐后2 h 以及睡前),计算MAGE。并在空腹状态下采集患者低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、超敏C 反应蛋白(hs-CRP)、血清铁蛋白(serum ferritin,SF)、甘油三酯(TG)、总胆固醇(TC)等血清学指标。
1.3.3 NCV 检查 在神经功能室利用Keypoint 肌电图检测仪测量患者NCV,室温约25℃,皮温保持在35℃以上,分别测量两组患者正中神经、尺神经、腓总神经的SCV 和MCV。以临床诊断异常值为参考依据,神经传导速度、波幅、末端潜伏期变化超过阈值提示异常[5]。
1.3.4 超声测量神经CSA 应用飞利浦EPIQ5 彩超诊断仪,探头选择高频探头,条件选为肌骨。超声医生需观察患者神经二维声像图变化,并测量3 种神经的纵径、横径及CSA。正中神经检测时,患者需仰卧位,上肢伸直且手心朝上,于腕管入口上方1 cm 处测量;尺神经检测时,患者需坐位,上肢伸直并外展,于肱骨内上髁的尖端处测量;腓总神经检测时,患者需俯卧位,双腿伸直,于坐骨神经分支后1 cm 处测量。用面积描记法测量神经CSA 时,需将探头垂直于神经,以获得最小截面值,并重复测量3次,取平均值[4]。
1.5 统计学处理
所有数据采用SPSS23.0 统计学软件进行分析处理,计量资料以(±s)表示,组间比较采用两组独立样本的t 检验。计数资料的组间比较采用x2检验。用Spearman 秩相关分析治疗前、后3 种神经CSA 与神经电生理各指标之间的相关性。P<0.05为差异具有统计学意义。
2 结果
2.1 两组治疗前后血清学指标的变化
两组治疗后MAGE 值明显低于治疗前,差异具有统计学意义(P<0.05),见表1。
表1 两组治疗前后血清学指标比较(n=55,±s)Tab 1 Comparison of serum indexes before and after treatment in the two groups(n=55,±s)
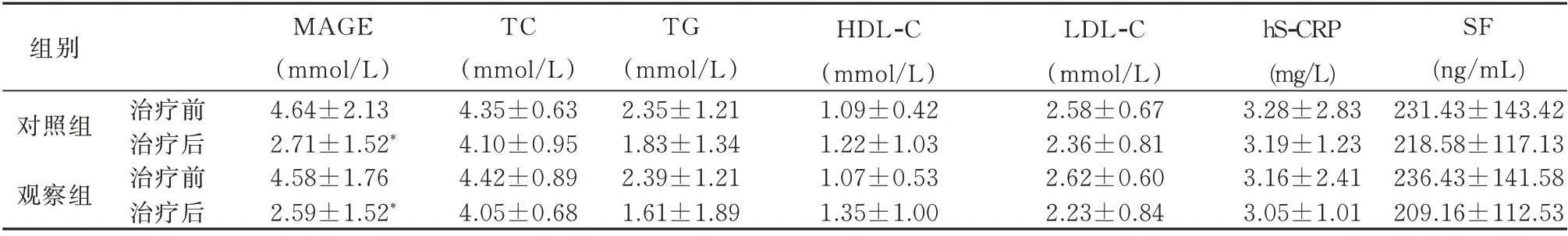
表1 两组治疗前后血清学指标比较(n=55,±s)Tab 1 Comparison of serum indexes before and after treatment in the two groups(n=55,±s)
注:组内与治疗前比较,*P<0.05。
组别对照组观察组SF(ng/mL)231.43±143.42 218.58±117.13 236.43±141.58 209.16±112.53治疗前治疗后治疗前治疗后MAGE(mmol/L)4.64±2.13 2.71±1.52*4.58±1.76 2.59±1.52*TC(mmol/L)4.35±0.63 4.10±0.95 4.42±0.89 4.05±0.68 TG(mmol/L)2.35±1.21 1.83±1.34 2.39±1.21 1.61±1.89 HDL-C(mmol/L)1.09±0.42 1.22±1.03 1.07±0.53 1.35±1.00 LDL-C(mmol/L)2.58±0.67 2.36±0.81 2.62±0.60 2.23±0.84 hS-CRP(mg/L)3.28±2.83 3.19±1.23 3.16±2.41 3.05±1.01
2.2 两组治疗前后NCV 的变化
两组治疗后正中神经、尺神经及腓总神经的SCV 及MCV 值均较治疗前明显增快,而观察组3种神经SCV 及MCV 值明显高于对照组,差异均具有统计学意义(P<0.05),见表2。
2.3 两组治疗前后神经CSA 的变化
治疗后与治疗前对比,观察组正中神经、尺神经及腓总神经的CSA 明显减小(P<0.05);治疗后分析,观察组3 种神经CSA 均较对照组明显减小(P<0.05),见表3。
2.4 两组治疗前后神经的超声异常表现
治疗后的超声表现中:观察组中正中神经、尺神经及腓总神经异常构成比较治疗前明显减低(P<0.05),治疗后分析,观察组3 种神经内部回声减低、模糊的构成比明显小于对照组(P<0.05),见表4。
表2 两组治疗前后NCV 比较(m/s,n=55,±s)Tab 2 Comparison of NCV between the two groups before and after treatment(m/s,n=55,±s)
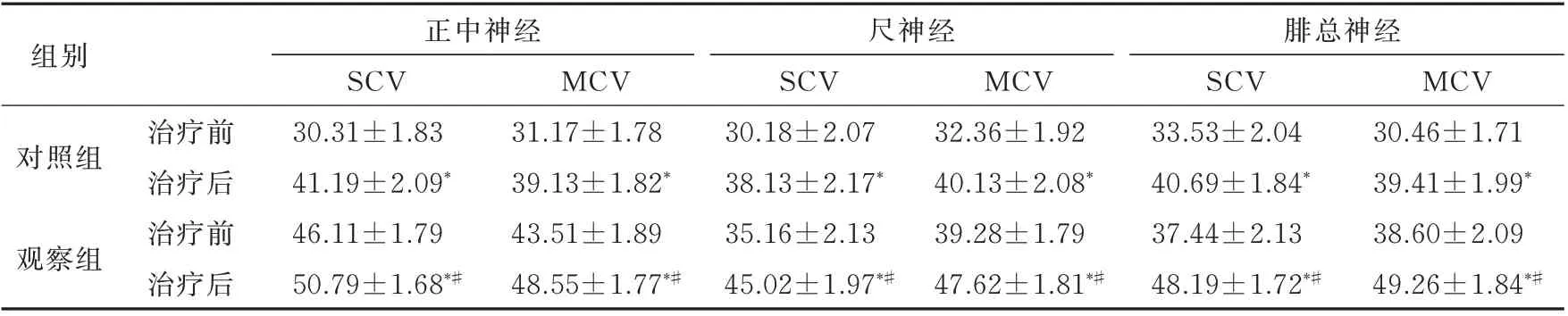
表2 两组治疗前后NCV 比较(m/s,n=55,±s)Tab 2 Comparison of NCV between the two groups before and after treatment(m/s,n=55,±s)
注:组内与治疗前比较,*P<0.05;两组治疗后比较,#P<0.05。
组别正中神经SCV 30.31±1.83 41.19±2.09*46.11±1.79 50.79±1.68*#MCV 31.17±1.78 39.13±1.82*43.51±1.89 48.55±1.77*#尺神经SCV 30.18±2.07 38.13±2.17*35.16±2.13 45.02±1.97*#MCV 32.36±1.92 40.13±2.08*39.28±1.79 47.62±1.81*#对照组观察组MCV 30.46±1.71 39.41±1.99*38.60±2.09 49.26±1.84*#治疗前治疗后治疗前治疗后腓总神经SCV 33.53±2.04 40.69±1.84*37.44±2.13 48.19±1.72*#
表3 两组治疗前后神经CSA 比较(mm2,n=55,±s)Tab 3 Comparison of neurological CSA before and after treatment between the two groups(mm2,n=55,±s)
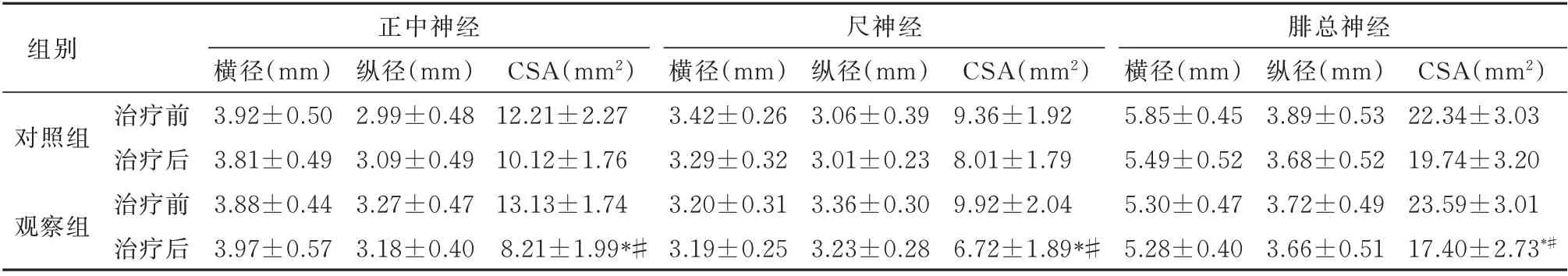
表3 两组治疗前后神经CSA 比较(mm2,n=55,±s)Tab 3 Comparison of neurological CSA before and after treatment between the two groups(mm2,n=55,±s)
注:组内与治疗前比较,*P<0.05;两组治疗后比较,#P<0.05。
组别正中神经尺神经腓总神经CSA(mm2)22.34±3.03 19.74±3.20 23.59±3.01 17.40±2.73*#横径(mm)3.92±0.50 3.81±0.49 3.88±0.44 3.97±0.57纵径(mm)3.89±0.53 3.68±0.52 3.72±0.49 3.66±0.51对照组CSA(mm2)12.21±2.27 10.12±1.76 13.13±1.74 8.21±1.99*#观察组横径(mm)3.42±0.26 3.29±0.32 3.20±0.31 3.19±0.25纵径(mm)2.99±0.48 3.09±0.49 3.27±0.47 3.18±0.40纵径(mm)3.06±0.39 3.01±0.23 3.36±0.30 3.23±0.28 CSA(mm2)9.36±1.92 8.01±1.79 9.92±2.04 6.72±1.89*#横径(mm)5.85±0.45 5.49±0.52 5.30±0.47 5.28±0.40治疗前治疗后治疗前治疗后
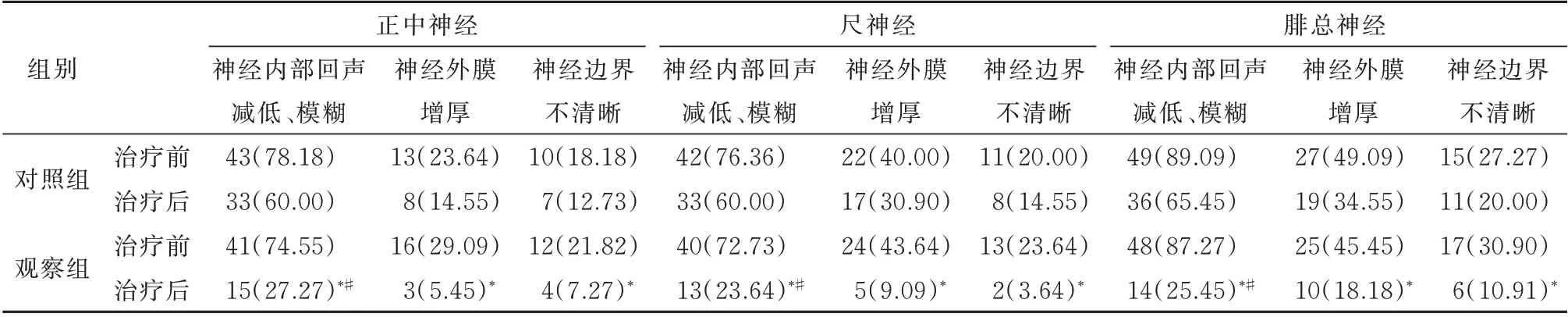
表4 两组治疗前后神经超声表现异常构成比[n=55,n(%)]Tab 4 The composition ratio of abnormal neurosonographic findings in the two groups of patients before and after treatment[n=55,n(%)]
2.5 观察组治疗前、后3 种神经CSA 与神经电生理指标的相关性分析
治疗前后的相关性分析中,3 种神经的CSA 值与潜伏期均呈正相关(P<0.05),而与SCV 及波幅均呈负相关(P<0.05),见表5。
3 讨论
DPN 是DM 患者致残、死亡的主要原因[6]。报道显示:DPN 患者患病率达到70.0%~92.0%[7],DPN 具有“发病初期隐匿、病情发展缓慢”等特点,发病后临床表现主要为“肢体感觉异常或麻木、疼痛”等[8],若病情加剧,可引起足部“溃疡”,更有甚者存在截肢的风险,严重影响患者的生活质量。因此,对DPN 的积极预防、合理治疗以及预后评估具有重要临床意义。
目前,临床普遍的治疗方案均以抗氧化药物辅以营养神经为主[9],但疗效一般。近年来,中医药疗法逐渐应用到DPN 的治疗中,主要以“滋肝补肾、活血化瘀、健脾补气”为主[10]。本研究中,观察组与对照组MAGE 值均明显低于治疗前(P<0.05),这说明两组患者经合理降糖治疗后血糖控制良好。在NCV 检查结果中,两组治疗后3 种神经SCV 与MCV 值均明显高于治疗前(P<0.05),这说明单纯应用α-硫辛酸对DPN 的神经传导速度有修复作用,可缓解DPN 的神经损害,其原因在于α-硫辛酸属强抗氧化剂,其可增加神经营养血管的血流量,并提高神经Na+-K+-ATP 酶活性,使脂质过氧化反应受到抑制,进而恢复神经的传导速度[11]。而观察组3种神经SCV 与MCV 值较对照组明显增快(P<0.05),这说明α-硫辛酸与中药封包联合用药比单纯应用α-硫辛酸效果更佳,中药成分中的白芷、续断、红花、没药具有活血化瘀的功效,可减轻神经缺血、缺氧状态;而透骨草、当归、羌活、醋乳香可疏通经络、消肿止痛[12],亦可减轻炎症反应。封包疗法为局部用药,靠外敷吸收入体,可较快地扩散至病患神经,以缓解神经脱髓鞘改变[13]。观察组3 种神经治疗后的CSA 值均明显小于治疗前(P<0.05),且治疗后比较,观察组CSA 值明显小于对照组(P<0.05),分析原因在于α-硫辛酸可清除氧自由基,从而可缓解DM 患者因过度氧化应激反应而导致的神经水肿,进而改善神经肿胀的程度。而《糖尿病中医防治指南》中说明DPN 的致病因素及病理产物为血瘀[14]。中药封包法是以活血化瘀、通经活络为主要治疗原则[15],是通过封包之后的热效应使病患处的皮下组织松弛,神经的营养血管扩张,血流量增大,从而改善病患处的微循环[16],其与α-硫辛酸联合使用,可进一步加快受损神经的修复[17]。
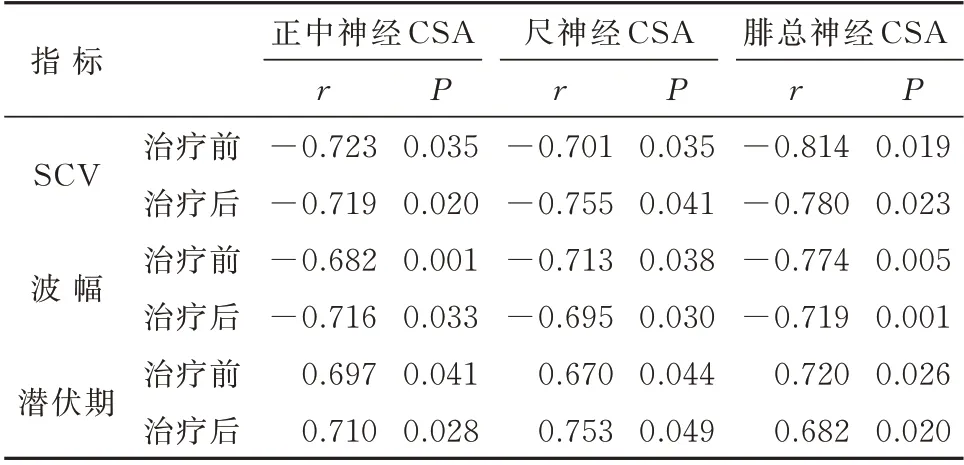
表5 3 种神经CSA 与神经电生理指标的相关性分析Tab 5 Correlation analysis of three kinds of neural CSA and neuroelectrophysiological indexes
DPN 患者周围神经损伤的声像图可表现为内部回声减低、模糊,神经外膜异常增厚,更或者神经边界不清晰等特征[4],本研究中,观察组与对照组在治疗前的神经内部回声减低、模糊的构成比均较高,观察组3 种神经治疗后超声表现异常的比例明显低于治疗前(P<0.05),且治疗后观察组3 种神经内部回声减低、模糊的构成比明显小于对照组(P<0.05),原因在于神经纤维束的血供和营养靠神经内膜供给,当在缺血、缺氧的状态下,神经内膜首先受损,且最为明显,超声表现为神经内部回声减低,筛网状结构模糊等,所以DPN 患者神经损伤的超声异常表现以内部回声减低、模糊为主,但在持续性的高糖作用下,神经细胞进一步发生肿胀、变性,继而造成脱髓鞘改变[18],这时超声可显示为神经外膜增厚,更为严重时可表现为神经边界不清晰。α-硫辛酸与中药封包联合治疗时,可抑制脂质过氧化,纠正神经内膜缺血、缺氧状态,从而进一步使神经水肿减轻,神经束膜显示清晰。
NCV 是评估周围神经损伤最常用的方法,被相关学者认为是诊断DPN 的金标准[5]。但NCV 仅能监测神经传导速度,无法直观地观察神经损伤及预后情况[19]。相关性研究中,治疗前、后3 种神经CSA与潜伏期呈正相关,而与SCV、波幅呈负相关,这说明高频超声对神经数据的监测可用于DPN 患者疗效的评价,且DPN 患者神经损伤的超声特异性表现,可为临床提供直观、清晰的图像及数据,以反映DPN 的损害程度及恢复情况。
综上所述,α-硫辛酸联合中药封包技术对DPN神经损伤的治疗与修复的效果显著,可推广临床应用。高频超声可直观地反映DPN 患者神经损伤的变化,可为临床评估DPN 的预后。

