胰高血糖素样肽1 对巨噬细胞内基因ACAT1、CD36 的表达及胆固醇代谢的影响
岳云飞,韩永魁,张 奎,申晓彧
(山西医科大学第二临床医院,山西太原030000)
巨噬细胞内胆固醇的代谢紊乱及蓄积量过多会导致其泡沫化,泡沫细胞内有着大量的脂肪,是动脉斑块形成的一大因素,而巨噬细胞内胆固醇的代谢紊乱及蓄积量过多会导致其泡沫化,对于动脉粥样硬化的发生发展起了重要作用[1,2]。已有资料表明,在巨噬细胞的细胞膜表面,CD36 可以和氧化型低密度脂蛋白(ox-LDL)相结合,并在此前提下进一步促进了单核巨噬细胞转变为泡沫细胞的过程,是 动 脉 粥 样 硬 化 形 成 的“ 罪 犯 因 子”之 一[3]。ACAT1 对游离胆固醇具有催化作用,使其转化为胆固醇酯,因此ACAT1 与CD36 在对胆固醇在细胞内的代谢中同样起着关键性的作用[4]。且都能够加剧细胞内胆固醇的蓄积,加快动脉粥样硬化的发生速率。部分研究发现,人体内GLP-1 的分泌场所主要来源于小肠中的L 细胞,有2 种生物活性形式,其中之一为GLP-1(7-36a),GLP-1 约80%的活性来自7-36a;另一种活性形式为GLP-1(7-37),其酰胺化产物为GLP-1(7-36a)。有大量研究发现,GLP-1对人体具有多种益处,在对心血管层面则起着抑制动脉粥样硬化发展的作用,但其分子机制及通路尚未完全明确[5,6]。在动物组织学层面已得到证实[7],GLP-1 类似物能够减少主动脉根部斑块面积,从而抑制动脉粥样的发展过程,本研究旨在从细胞学角度进一步观察GLP-1 能否降低ACAT1 与CD36 的表达,并通过检验细胞内胆固醇的含量来进一步验证GLP-1 在人体内能够通过抑制ACAT1 与CD36的表达,从而减少细胞内胆固醇的蓄积,最终起到延缓动脉粥样硬化发生发展的具体过程,并为延缓动脉斑块的形成提供新的治疗思路。
1 材料与方法
1.1 药物
GLP-1(7-36)货号:249125,由上海吉尔生化有限公司生产,GLP-1(7-36)抑制剂[(Exendin(9-39)]货号:055285,由上海吉尔生化有限公司生产。
1.2 试剂
Raw264.7 小鼠单核巨噬细胞白血病细胞、辣根过氧化物酶标记二抗(武汉博士德生物工程有限公司);ox-LDL(北京协生生物科技有限公司);ACAT1 一抗(武汉三鹰生物有限公司);CD36 一抗(上海拜力生物科技有限公司);PCR 试剂盒[宝日医生物技术(北京)有限公司]。
1.3 方法
1.3.1 细胞培养和分组 取小鼠来源的巨噬细胞,并置于37℃、5%CO2条件下进行培育,将其浓度调整为适宜浓度,接种于6 孔培养板,加用RPMI-1640 培养液,饥饿培育1 h 单核细胞,再加入50 mg/L 的ox-LDL 将巨噬细胞诱导为泡沫细胞,而后加入5 nmol/L 的GLP-1(7-36),然后将细胞分为4 组:空白对照组(巨噬细胞)、实验组(将巨噬细胞诱导成的泡沫细胞)、GLP-1 激动组(在泡沫细胞的基础上加 入GLP-1)、GLP-1 抑 制 组[GLP-1 及 其 抑 制 剂Exendin(9-39)]。
1.3.2 油红O 染色 将浓度为50 mg/L 的ox-LDL滴入巨噬细胞对其进行干涉处理24 h,60%异丙醇润洗,每孔各1 次,各孔内加入1 mL 油红O 染色15 min,再用苏木精染色2 min,干预后的细胞泡沫化状况及形态用倒置显微镜察看。
1.3.3 RT-PCR 检测细胞中的ACAT1 和CD36 mRNA 表达 按照试剂盒法提取总RNA,进行逆转录及PCR 扩增,首先,在94℃下预变性3 min,然后再按照变性、退火的顺序进行40 次循环。ACAT1 上 游 引 物:5'-ACGTAATGAGCAGAG⁃GAGCAACAC-3',下 游 引 物:5'-CGTATCCT⁃GTTCCTGCCGTGAG-3';CD36 上 游 引 物:5'-CTTTGAAAGAACTCTTGTGGGG-3',下 游 引物:5'-GTCTGTGCCATTAATCATGTCG-3';β肌动蛋白(β-actin)上游引物:5'-CGAGCUCAAGC⁃GAUUUCCUCGUAU-3',下游引物:5'-AGCTCC⁃GTCTATGGTGGTGGCTAT-3';内参为β-actin。
1.3.4 Western blot 法检测各组细胞中CD36 和ACAT1 蛋白表达 将巨噬细胞诱导转化成为泡沫细胞并对其进行相应的处理之后,使用裂解液提取细胞内总蛋白,并用BCA 法对提取出的蛋白行定量分析。行凝胶电泳、浓缩电泳和分离电泳,再通过湿转法完成转膜,之后用牛奶封闭2~4 h。一抗在温度为4℃条件下以(1∶1 000)孵育过夜。漂洗3次,二抗(1∶2 000)在室温下孵育2 h。漂洗3 次,实验结果用凝胶成像系统进行收集,并测定条带灰度值,将内参基因设定为β-actin。
1.3.5 高效液相色谱法测定细胞内各胆固醇水平 将各组干预后的细胞,参考胆固醇测定试剂盒说明书,在酶标仪仪器发射波长为590 nm 处检测荧光值,游离胆固醇可以直接被检测出;胆固醇的测量需要在胆固醇酯酶的处理下检测;胆固醇酯的测量则为胆固醇与游离胆固醇的差值,单位为mg/mL。
1.4 统计学处理
结果采用SPSS23.0 统计软件处理分析,计量资料均以(±s)来进行表示,多组间数据比较采用单因素方差分析,组间两两比较采用LSD-t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 油红O 染色
用ox-LDL 对巨噬细胞行干涉处理后,对其行油红O 染色,并在镜下察看结果,其形态饱满,在细胞内能够观察到大量的脂滴颗粒后,可以确信泡沫细胞(巨噬细胞来源)的模型已成功建立。
2.2 各组CD36 和ACAT1 mRNA 表达比较
与空白对照组比较,实验组的CD36 和ACAT1 mRNA 表达显著上升,差异有统计学意义(P<0.05);与实验组比较,GLP-1 激动组CD36 和ACAT1 mRNA 表达明显下降,差异有统计学意义(P<0.05);与GLP-1 激动组比较,GLP-1 抑制组CD36 和ACAT1 mRNA 表达明显上升,差异有统计学意义(P<0.05),见表1。
表1 各组ACAT1 和CD36 mRNA 表达比较(n=8,±s)Tab 1 Comparison of ACAT1 and CD36 mRNA expression between the experimental groups and the blank control group(n=8,±s)

表1 各组ACAT1 和CD36 mRNA 表达比较(n=8,±s)Tab 1 Comparison of ACAT1 and CD36 mRNA expression between the experimental groups and the blank control group(n=8,±s)
注:与空白对照组比较,*P<0.05;与实验组比较,#P<0.05;与GLP⁃1 激动组比较,▲P<0.05。
CD36 mRNA 0.49±0.08 1.02±0.26 *0.52±0.08#0.97±0.14▲组别空白对照组实验组GLP⁃1 激动组GLP⁃1 抑制组ACAT1 mRNA 0.53±0.08 1.01±0.17*0.62±0.18 0.92±0.23▲
2.3 各组ACAT1 和CD36 蛋白表达比较
与空白对照组比较,实验组CD36 和ACAT1蛋白表达明显上升,差异有统计学意义(P<0.05);与实验组比较,GLP-1 激动组CD36 和ACAT1 蛋白表达明显下降,差异有统计学意义(P<0.05);与GLP-1 激 动 组 比 较,GLP-1 抑 制 组CD36 和ACAT1 蛋白表达明显上升,差异有统计学意义(P<0.05),见表2 及图1。
表2 各组ACAT1 和CD36 蛋白表达比较(n=8,±s)Tab 4 Comparison of ACAT1 and CD36 mRNA expression level between blank control group and experimental groups(n=8,±s)
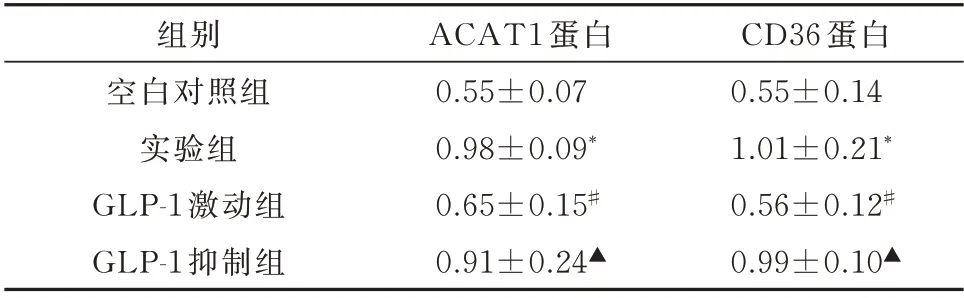
表2 各组ACAT1 和CD36 蛋白表达比较(n=8,±s)Tab 4 Comparison of ACAT1 and CD36 mRNA expression level between blank control group and experimental groups(n=8,±s)
注:与空白对照组比较,*P<0.05;与实验组比较,#P<0.05;与GLP⁃1 激动组比较,▲P<0.05。
CD36 蛋白0.55±0.14 1.01±0.21*0.56±0.12#0.99±0.10▲组别空白对照组实验组GLP⁃1 激动组GLP⁃1 抑制组ACAT1 蛋白0.55±0.07 0.98±0.09*0.65±0.15#0.91±0.24▲
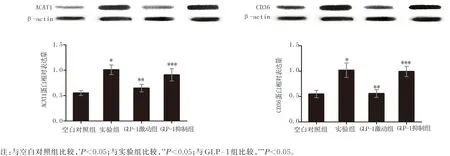
图1 各组CD36 、ACAT1 的蛋白相对表达量比较Fig 1 The relative expression level of CD36 and ACAT1 proteins in each group
2.4 各组胆固醇水平比较
与空白对照组比较,实验组TC、FC、CE 水平均上升,差异有统计学意义(P<0.05);与实验组比较,GLP-1 激动组TC、FC、CE 水平均明显下降,差异有统计学意义(P<0.05);与GLP-1 激动组比较,GLP-1 抑制组TC、TC、CE 水平均明显上升,差异有统计学意义(P<0.05),见表3。
表3 各组胆固醇表达比较(n=8,±s)Tab 3 Comparison of cholesterol expression level between experimental group and blank control group(n=8,±s)
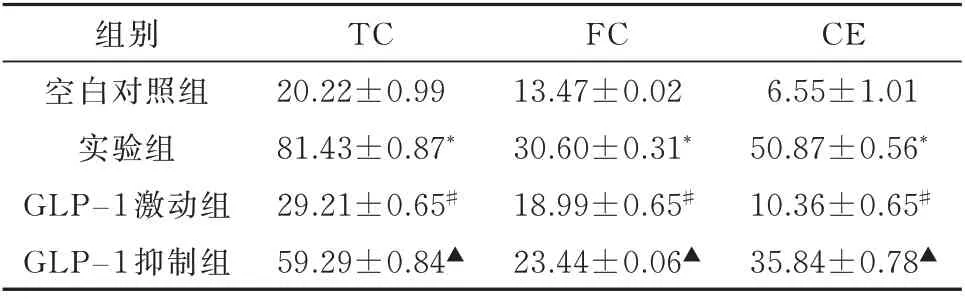
表3 各组胆固醇表达比较(n=8,±s)Tab 3 Comparison of cholesterol expression level between experimental group and blank control group(n=8,±s)
注:与空白对照组比较,*P<0.05;与实验组比较,#P<0.05;与GLP⁃1 激动组比较,▲P<0.05。
CE 6.55±1.01 50.87±0.56*10.36±0.65#35.84±0.78▲组别空白对照组实验组GLP−1 激动组GLP−1 抑制组TC 20.22±0.99 81.43±0.87*29.21±0.65#59.29±0.84▲FC 13.47±0.02 30.60±0.31*18.99±0.65#23.44±0.06▲
3 讨论
细胞中胆固醇代谢主要包括胆固醇的摄取和酯化以及流出等过程[8],整个过程在正常情况下都会受到严格的调控,从而维持巨噬细胞内脂质水平的正常。若是摄取和酯化过程遭到干扰,导致调控能力下降,则可引起巨噬细胞内持续高胆固醇水平。过高的胆固醇水平会使巨噬细胞朝泡沫细胞进行转化,致使动脉粥样硬化的发展过程进一步加快[9]。在ox-LDL 摄取过程中,当CD36 特异性结合ox-LDL 后,其13-羟基十八碳二烯酸和9-羟基十八碳二烯酸被释放出,并通过丝裂原活化蛋白激酶、蛋白激酶B 以及蛋白激酶C 等路径使氧化物酶增殖活化受体γ 被激活,被激活后的氧化物酶增殖活化受体γ 再进一步与视黄醇受体结合,开始了CD36 mRNA 的转录过程,进而使CD36 表达上调,CD36表达上调又进一步增加对ox-LDL 的摄取,且此反应不受负反馈的调节[10,11]。据相关文献报道,先天性CD36 缺乏的患者,其发生动脉粥样硬化发生的概率相较正常人而言相对处于较低水平。另有研究发现[12],在高脂血症患者的体内,其外周血中CD36mRNA 的表达量也会远高于正常人。在胆固醇合成较高会导致细胞内胆固醇大量蓄积,使其代谢失衡,而作为此合成过程的关键酶,ACAT1 则能够 有 效 的 调 节 细 胞 内 的 胆 固 醇 水 平[13,14]。ACAT1与ACAT2 同属ACAT 的两个亚型,前者高表达于巨噬细胞内,而后者则主要表达在小肠中[15],参与脂蛋白加工过程。有关研究发现,ACAT1 在巨噬细胞内可以将游离胆固醇合成为胆固醇酯,当血脂较高时,巨噬细胞胆固醇酯会处于高水平状态,在此水平下,巨噬细胞泡沫化发展进程也会逐步加快。
本研究中实验组中CD36 、ACAT1 mRNA 和蛋白的表达水平及TC、FC、CE 的含量均高于空白对照组,这表明CD36 与ACAT1 在巨噬细胞内表达与泡沫化程度呈正相关。因此是否可以通过药物作用于CD36、ACAT1 靶点,并降低其表达,从而减少巨噬细胞内胆固醇含量,并起到抑制巨噬细胞泡沫化成为本实验的主要研究目的。在本实验中,GLP-1 激 动 组 中CD36 、ACAT1 mRNA 和 蛋 白 的表达水平及其胞内的TC、FC、CE 的含量要低于实验组,进一步证明GLP-1 可通过下调ACAT1、CD36 表达来降低细胞内胆固醇水平。尤其是对于患有2 型糖尿病的动脉粥样硬化症患者,可以更好的降低心血管病风险[16,17]。有研究证实[18],GLP-1类似物与其受体相结合后,可以起到增强胰岛素分泌、降低胰岛素抵抗等降糖作用,亦可使冠心病病人从中获益。此外,GLP-1 激动剂还能够起到独立于降糖作用以外的抗动脉粥样硬化作用[19],减少冠脉的斑块面积。一项Mate 分析表明,GLP-1 受体激动剂还能够降低缺血性脑卒中的发生风险[20]。
综上所述,GLP-1 对于人体多个系统均有益处,本研究在冠脉粥样硬化方面发现,GLP-1 受体激动剂可以减少巨噬细胞内CD36、ACAT1 mRNA和蛋白得表达水平,减少胆固醇的摄取及合成,从而减少巨噬细胞内胆固醇蓄积,并阻止其泡沫化,达到抑制动脉粥样硬化发生发展的目的,降低心血管疾病风险。所以,应用GLP-1 类似药物来针对CD36、ACAT1 这两个靶点对动脉粥样硬化进行预防具有重要意义。

