3种食药用真菌固体发酵对苦荞营养成分、总黄酮含量和抗氧化活性的影响
冯小飞, 马建鹏, 郎 丹, 娜胡兰, 姜兰馨, 杨 斌
(1.西南林业大学生命科学学院,云南 昆明 650224;2.大理白族自治州林业和草原有害生物防治检疫局,云南 大理 671000;3.西南林业大学生物多样性保护学院,云南 昆明 650224)
固体发酵技术在我国有着悠久的应用历史[1],从豆豉、酱油和食醋等食品的制作到生物药品、酶制剂和畜牧饲料等产品的开发和生产,微生物固体发酵技术都发挥着重要作用[2-4].随着发酵产业的发展,生产所用的菌种也从细菌、曲霉和酵母等发展到灵芝、云芝和香菇等食药用真菌[5-6].食药用真菌[7-9]是一类兼具食用和药用价值的真菌,其药用价值主要归功于菌丝体、子实体和孢子等组织在生长发育过程中产生的多糖、多肽和黄酮等物质,这些化合物在临床上表现出优良的抑菌、抗癌、抗肿瘤和增强机体免疫力等药理活性[10-13].真菌生长速度快、代谢产物丰富,更重要的是该类微生物在生长过程中通过代谢水解酶与基质发生相互作用,从而改变基质的结构组成和化合物种类,降低纤维素类物质的含量,优化发酵基质的营养成分和口感[14].因此,研究食药用真菌在固体发酵中的作用,对发酵食品的开发具有广泛的应用价值[15-17].
香菇[Lentinusedodes(Berk.) Sing]、裂褶菌(SchizophyllumcommuneFranch.)和云芝(Coriolusversicolor)是云南地区常见的大型真菌,野生菌种分布广且适应性强,生物学特性和活性成分被深入研究[18-19],但在固体发酵食品中的应用报道较少.食用菌发酵液中的真菌多糖是最具开发价值的产物,如酵解姬松茸多糖具有调节小鼠免疫功能和优化肠道菌群的作用[20];香菇和猴头菇固体发酵能提高小麦基质的蛋白质含量[21].真菌在发酵过程中产生的多糖、蛋白质和氨基酸等物质除了具有一定的生理活性外,也是食品重要的营养组成成分.近年来随着发酵食品研究的深入,合理利用食药用真菌开展固体发酵研究,有利于促进其在发酵食品中的开发和应用[22-23].
苦荞[Fagopyrumtataricum(L.) Gaertn]又名鞑靼荞麦,是我国典型的食药同源的农业作物.苦荞种子含有丰富的淀粉、蛋白质和氨基酸等营养成分,苦荞粉和种壳含有大量的黄酮、多糖和多酚等物质,具有预防“三高”、抗氧化和抗肿瘤等功效[24-25].目前,苦荞作物在市场上已开发出苦荞酒、茶和面条等产品.食药用真菌固体发酵若能在苦荞产品中产生协同作用,将固体发酵技术与苦荞开发进行有机结合,促进苦荞基质不同物质的生成和转化,必将促进苦荞发酵物的转化增值.因此,为了探究不同食药用真菌在发酵过程中对苦荞基质主要营养成分、总黄酮含量和抗氧化活性的影响,以苦荞为基质,开展香菇、裂褶菌和云芝3种食药用真菌的固体发酵试验,测定发酵前后苦荞基质总黄酮含量和抗氧化活性的变化,同时分析不同发酵培养时段苦荞基质总蛋白、粗脂肪和糖类营养物质的变化,旨在为苦荞—真菌发酵产品的研究和开发提供参考.
1 材料与方法
1.1 材料
1.1.1 材料来源 供试基质:苦荞为云南宣威市本地种植品种,除去空壳,选取颗粒饱满的苦荞种子自然晾干后备用.
供试菌株:香菇为云南楚雄永仁县野生品种,裂褶菌为云南昭通鲁甸县的野生菌株,云芝采自西南林业大学树木园旱冬瓜树树桩.3种真菌经分离纯化后获得菌种,保存于西南林业大学生命科学学院生物化学教研室.采用普通PDA培养基对真菌进行分离和培养.
1.1.2 主要试剂 无水乙醇、浓盐酸、浓硫酸、乙醚和过氧化氢(30%)购自汕滇药业有限公司;亚硝酸钠、氯化铝、硫酸铜、三氯乙酸、铁氰化钾、水杨酸、磷酸氢二钠和葡萄糖购自国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine, DPPH)购自阿拉丁试剂有限公司;芦丁标准品(纯度>98%)购自南京泽郎生物科技有限公司.以上试剂均为分析纯.
1.1.3 主要仪器 主要仪器有FOSS2300全自动凯氏定氮仪(瑞典FOSS TECATOR公司)、YXQ-LS立式压力蒸汽灭菌锅(上海博讯实业有限公司)、TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司)、SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司)、粗脂肪提取仪(上海精隆有限公司)、超声波破碎仪(宁波新芝生物有限公司)和烘箱(上海跃进医疗器械有限公司)等.
1.2 试验设计
1.2.1 菌种的活化和培养 将装有云芝、裂褶菌和香菇3种菌种的冻存管于38 ℃的水浴锅中活化30 s,用75%乙醇表面消毒后转移至超净工作台上,无菌条件下分别将3种菌种接种于PDA培养基(直径9 cm)中央,于(25±2) ℃条件下培养9 d后备用.
1.2.2 苦荞基质的处理和接种培养 将颗粒饱满的苦荞种子分装于组培瓶(100 g·瓶-1)中,添加蒸馏水浸泡24 h后弃掉多余水分,封口后于0.15 Mpa、120 ℃条件下灭菌30 min,降温后转移至超净工作台上备用.在无菌条件下用打孔器将3种菌种制成菌饼(直径5 mm),用接种针将菌饼接种于装有苦荞基质的表面,每瓶基质接种5块菌饼,每个菌种设置3个平行,以苦荞原材料作为对照,接种后的苦荞基质于培养箱(25 ℃±2 ℃)中培养.培养30、40、50和60 d后,对发酵基质进行主要营养成分的测定和分析.
1.2.3 发酵基质的处理 不同发酵时段的苦荞基质于60 ℃条件下烘干,粉碎后过60目筛备用.
1.2.4 发酵基质总黄酮含量和抗氧化活性的测定 以发酵30 d的基质为材料,准确称量1.000 g处理后的苦荞基质,用85%乙醇水溶液超声波(500 W)提取3次,每次10 min,提取后的上清液合并定容至50 mL,即为总黄酮提取物待测液.以芦丁为标准品,采用NaNO2—Al(NO3)3比色法[25]进行总黄酮含量的测定.总黄酮含量/%=(m×V×N)/M×100.式中,m为采用标准曲线法测定的含量(μg·mL-1),V为提取液定容后的总体积(mL),N为测定时的稀释倍数,M为样品质量(g).
还原力采用铁氰化钾还原法测定,在700 nm波长下测定样品和对照品的光密度(D),以D为还原力的评价指标,D越大表示样品的还原力越强.
羟基自由基清除能力采用水杨酸法测定;超氧阴离子自由基清除能力采用邻苯三酚自氧法测定;DPPH自由基清除能力参考吴永祥等[26]和许春平等[27]的方法测定.
羟基自由基清除率/%=[D0-(Dx-Dx0)]/D0×100.式中,D0为空白对照液的光密度,Dx为加入样品溶液后的光密度,Dx0为H2O代替H2O2的光密度.
超氧阴离子自由基清除率/%=[D0-(Dx-Dx0)]/D0×100.式中,D0为空白对照液的光密度,Dx为加入样品溶液后的光密度,Dx0为水代替邻苯三酚溶液的光密度.
DPPH自由基清除率/%={1-[(Dx-Dx0)/D0]}×100.式中,D0为空白对照液的光密度,Dx为加入样品溶液后的光密度,Dx0为提取液的光密度.
1.2.5 发酵基质营养成分的测定 发酵基质样品中的水溶性还原糖和总糖含量均采用3,5-二硝基水杨酸(NDS)法测定,总蛋白含量采用凯氏定氮法测定,粗脂肪含量采用索氏提取法测定.
1.3 数据处理
以SPSS Statistics 19.0统计软件对试验数据进行处理和分析,结果以平均值±标准差表示;用Excel软件绘制柱状图.
2 结果与分析
2.1 不同真菌固体发酵对苦荞总黄酮含量和抗氧化活性的影响
由表1可知,3种食药用真菌在苦荞基质中发酵培养30 d,苦荞基质的总黄酮含量和抗氧化活性均发生不同程度的变化.发酵处理后,苦荞基质的总黄酮含量显著上升,其中,香菇和云芝发酵的苦荞基质中,总黄酮含量比对照提高0.5%.3种真菌发酵基质的提取物对羟基自由基、超氧阴离子自由基和DPPH自由基的清除能力表现出不同程度的增强.提取物对超氧阴离子自由基的清除率均超过18.0%,是对照清除率(8.84%)的2倍多;裂褶菌发酵基质的提取物对DPPH自由基的清除能力最强,清除率达到57.02%;裂褶菌和云芝发酵基质的提取物对超氧阴离子自由基的清除能力较强,清除率分别为29.35%和28.22%.除了香菇发酵基质的还原力低于对照外,云芝和裂褶菌发酵基质的还原力显著上升,分别是对照的1.3倍和1.4倍.3种真菌在发酵过程中分泌的多种水解酶能对苦荞壳中的纤维素、果胶和淀粉等大分子物质进行分解,增强基质中黄酮类化合物的溶出;同时,真菌发酵过程中黄酮类化合物的产生,有可能是影响发酵基质总黄酮含量和抗氧化活性变化的主要原因[28].
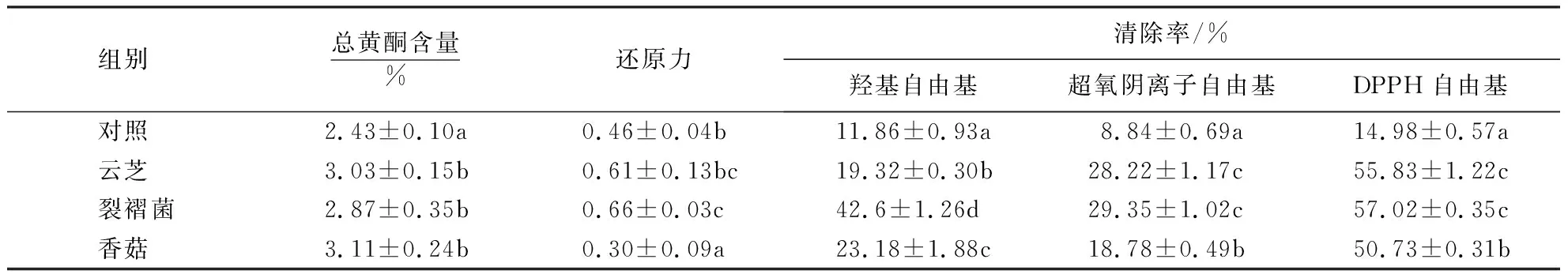
表1 3种真菌固体发酵对苦荞基质总黄酮含量和抗氧化活性的影响1)Table 1 Effects of solid fermentation of different edible and medicinal fungi on flavonoid content and antioxidant activity of tartary buckwheat substrate
2.2 不同真菌固体发酵对苦荞基质主要营养成分的影响
2.2.1 发酵菌株和发酵时段对苦荞基质还原糖含量的影响 图1显示:3种食药用真菌在苦荞基质中发酵培养30 d,基质的还原糖含量显著低于对照;发酵40~60 d,还原糖含量出现不同程度的上升;发酵60 d时的还原糖含量最高,云芝、裂褶菌和香菇发酵基质的还原糖含量分别达到2.41%、2.18%和2.69%,显著高于对照(0.58%).其中,云芝和香菇在基质中发酵40~60 d时,还原糖含量增加最快;裂褶菌在基质中发酵50~60 d时,还原糖含量增加最快.还原糖是微生物生长发育过程中重要的碳源,具有容易吸收和利用率高的特点.固体发酵的第一个时段内(30 d),由于供试菌株主要在苦荞基质上开展营养生殖,优先利用基质中的还原糖,从而降低基质的还原糖含量;发酵40~60 d时,菌丝体生物量的增加以及自身还原糖类代谢物质的生成,促进基质还原糖含量的增加,这有可能是造成此时段还原糖含量上升的主要原因.
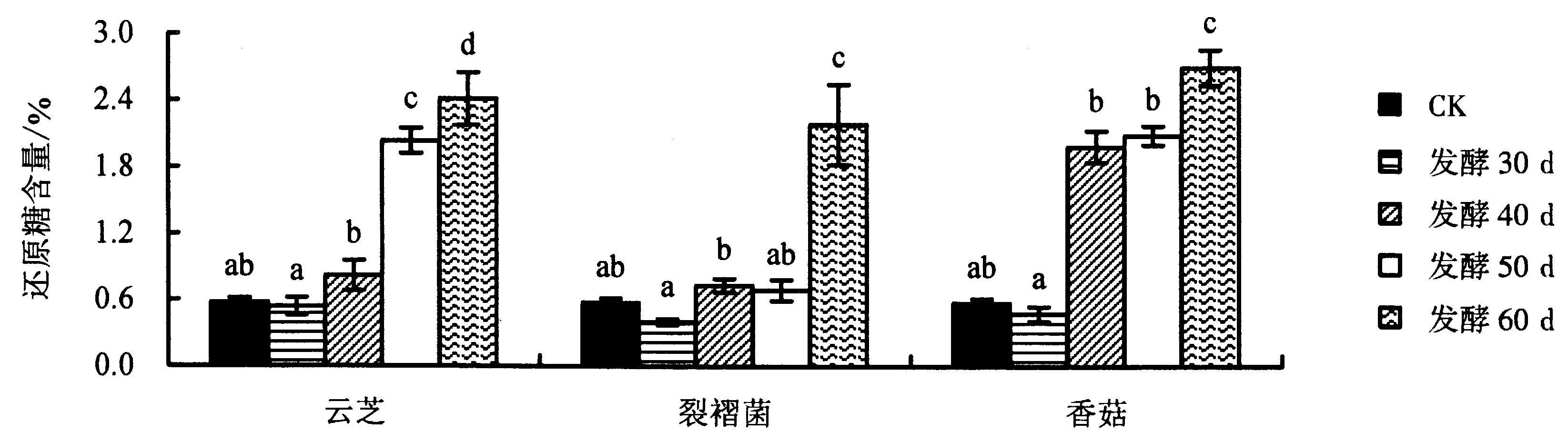
用Duncan法进行多重比较,图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).图1 发酵菌株和发酵时段对苦荞基质还原糖含量的影响Fig.1 Effect of fermentation strain and fermentation period on reducing sugar content of tartary buckwheat substrate
2.2.2 发酵菌株和发酵时段对苦荞基质总糖含量的影响 图2显示,3种食药用真菌固体发酵后,苦荞基质的总糖含量表现出不同的变化趋势.在云芝发酵的4个时段,基质的总糖含量随着发酵时间的推移逐渐下降,且与对照(38.73%)相比显著降低,发酵50 d时的总糖含量低于20.0%.表明云芝对苦荞基质中的淀粉类物质有较好的分解利用能力,不同发酵时段的总糖含量持续下降.裂褶菌发酵基质中,总糖含量随着发酵时间的推移呈先上升后下降的趋势.裂褶菌发酵30 d时的总糖含量最高,达到43.77%;发酵40~60 d时,虽然总糖含量逐渐下降,但该时段的总糖含量均显著高于对照,40、50和60 d时的总糖含量分别达到43.13%、40.62%和40.24%,大于同时段其他两种真菌的发酵基质.结合还原糖含量的测定结果可以推测,裂褶菌在利用苦荞基质发酵的同时,代谢产生大量的糖类物质,这些糖类物质的产生促进基质总糖含量的积累.香菇发酵基质中,总糖含量随着发酵时间的推移呈先下降后上升的趋势.香菇发酵30 d时,由于菌丝体的营养生长需要大量的碳源供给,基质的总糖含量显著下降,仅为29.55%;在香菇发酵的中后期(40~60 d),随着糖类代谢产物的积累,基质的总糖含量增加但不显著,含量为39.0%左右.淀粉类多糖是高等真菌生长过程中的重要碳源,也是苦荞作物中含量最多的糖类物质,3种真菌在发酵培养的过程中都能稳定利用苦荞基质的糖类物质,但3种真菌的利用效率及糖类物质的代谢和转化能力存在差异.

用Duncan法进行多重比较,图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).图2 发酵菌株和发酵时段对苦荞基质总糖含量的影响Fig.2 Effect of fermentation strain and fermentation period on total sugar content of tartary buckwheat substrate
2.2.3 发酵菌株和发酵时段对苦荞基质总蛋白含量的影响 图3显示,3种食药用真菌固体发酵后,苦荞基质的总蛋白含量显著提高.其中,香菇发酵基质的总蛋白含量最高,但不同发酵时段的含量差异不显著,发酵30、40、50和60 d时的总蛋白含量分别为21.80%、21.83%、21.75%和22.3%.表明发酵30 d后,苦荞基质中的香菇菌丝体代谢产生大量的蛋白质、氨基酸和多肽类等含氮化合物,这类含氮化合物的产生提高了总蛋白含量.在裂褶菌不同发酵时段的基质中,其总蛋白含量相对较低,仅为14.0%左右,且与对照的差异不显著,表明裂褶菌在发酵培养的过程中,其含氮类化合物的代谢能力低于云芝和香菇,导致总蛋白含量低于云芝和香菇发酵基质.对比3种真菌发酵基质不同发酵时段的总蛋白含量,云芝菌丝体在发酵培养30~60 d的过程中,其发酵基质的总蛋白含量均有不同程度的增加,表明该微生物在生长过程中,其含氮类化合物的代谢和积累是一个持续的过程,菌丝体生物量的不断生长和发育,促进了含氮类化合物在基质中的逐渐积累.
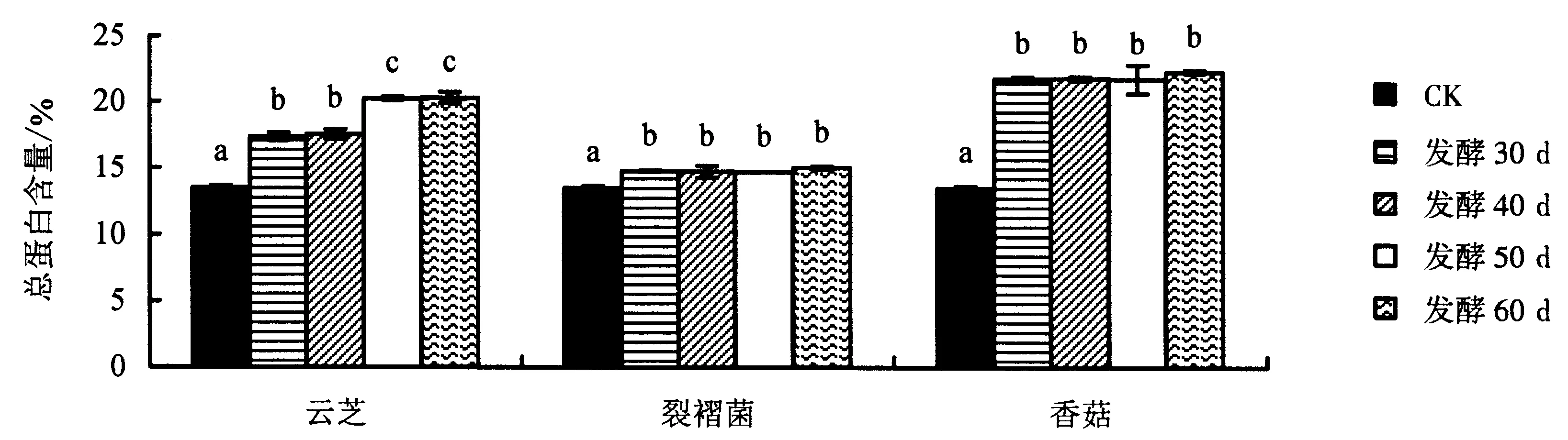
用Duncan法进行多重比较,图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).图3 发酵菌株和发酵时段对苦荞基质总蛋白含量的影响Fig.3 Effect of fermentation strain and fermentation period on total protein content of tartary buckwheat substrae
2.2.4 发酵菌株和发酵时段对苦荞基质粗脂肪含量的影响 图4显示,在云芝固体发酵的苦荞基质中,粗脂肪含量均显著小于对照(3.77%),发酵30~60 d时的粗脂肪含量呈先上升后下降的趋势,含量最高为2.47%(50 d),最低为1.91%(30 d),且4个发酵时段的含量差异不显著.在裂褶菌发酵培养的过程中,基质的粗脂肪含量逐渐上升,且不同发酵时段的含量差异显著,发酵30 d时的粗脂肪含量仅为0.77%,显著低于对照,发酵60 d时的含量最高,达4.19%,显著高于对照.在香菇发酵培养的过程中,基质的粗脂肪含量也出现先下降后上升的趋势,发酵30和40 d时的粗脂肪含量均为2.4%左右,显著低于对照,发酵60 d时的粗脂肪含量最高,达到3.85%,但与对照相比,粗脂肪含量的变化不显著.苦荞是一类脂肪含量较低的作物,且脂肪主要集中在胚乳中,发酵培养的前中期随着水解酶的影响,苦荞基质中大量的脂肪被菌株分解利用,从而导致3种真菌发酵基质的粗脂肪含量显著低于对照;在发酵的中后期,由于3种真菌菌丝体生物量的增加促进脂类次生代谢产物的产生,且菌丝体也含有一定量的脂类物质,从而提高基质粗脂肪的含量.不同菌株之间生物学特性的差异,导致不同发酵基质粗脂肪含量产生差异.

用Duncan法进行多重比较,图柱上附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).图4 发酵菌株和发酵时段对苦荞基质粗脂肪含量的影响Fig.4 Effect of fermentation strain and fermentation period on crude fat content of tartary buckwheat substrate
3 讨论与结论
本研究结果显示:云芝、裂褶菌和香菇3种食药用真菌都能在苦荞基质上正常生长;在3种真菌固体发酵的苦荞基质中,总黄酮含量和抗氧化活性得到不同程度的提高.发酵30 d时,云芝、裂褶和香菇发酵基质的总黄酮含量分别为3.03%、2.87%和3.11%,显著高于对照(2.43%);发酵30 d时,3种发酵基质的提取物对DPPH自由基的清除率均超过50%,显著高于对照(14.98%).初步推测3种发酵基质总黄酮含量的变化主要受到微生物水解作用和代谢产物的影响,酶类水解作用促进基质中黄酮类化合物的溶出,对丹参[29]、感冒清热颗粒药渣[30]和甘草[31]等材料的固体发酵研究也证实了相关结果,同时,微生物在生长过程中产生的多种黄酮类化合物也促进基质总黄酮含量的增加.总黄酮含量的增加是提高发酵基质抗氧化活性的原因之一,除了黄酮类化合物外,多糖、多酚以及部分小分子化合物均有一定的抗氧化活性,要明确阐明发酵基质与抗氧化活性之间的关系还有待于进一步研究.
本研究中,还原糖含量的测定结果显示:在3种食药用真菌固体发酵30 d的苦荞基质中,还原糖含量均低于对照;40~60 d时的还原糖含量不断增加,云芝、裂褶菌和香菇发酵基质的还原糖含量分别达到2.41%、2.18%和2.69%,表明3种菌株在后期的生长过程中产生多种还原糖类物质,提高还原糖含量;发酵60 d时的还原糖含量最大.总糖含量的测定结果显示:除了云芝发酵基质的总糖含量持续下降外,裂褶菌发酵基质在发酵不同时段的总糖含量均高于对照,最高达到43.77%(30 d);从接种到发酵30 d,由于香菇自身菌丝体的营养生长利用苦荞基质中大量的糖类物质,从而引起该时段总糖含量下降;在培养的中后期,香菇菌丝体糖类代谢物质含量的提高促进了基质总糖含量的积累.总蛋白含量的测定结果显示:3种真菌发酵基质的总蛋白含量显著提高;裂褶菌对总蛋白含量的影响较小,含量基本维持在14.0%左右;香菇发酵30 d时的总蛋白含量提高到21.8%,且后期维持在21.0%左右;云芝发酵50 d时的总蛋白含量最高达到20.0%,且后期变化不大.粗脂肪含量的测定结果显示:云芝发酵基质的粗脂肪含量均显著低于对照;裂褶菌和香菇发酵60 d时的粗脂肪含量最大,分别为4.19%和3.85%.综合对比分析3种菌株不同发酵时段的营养成分可知:营养指标的变化因发酵菌株和发酵时间的差异而出现不同的结果,即使在培养基质相同的条件下,菌株因为生物学特性的差异而在生理生化和代谢产物中表现出较大的差异.云芝、裂褶菌和香菇虽然都是木腐类真菌,但三者在菌丝形态、代谢产物和生物学特性等方面都存在诸多差异.本研究中,云芝发酵培养时利用基质中的糖类物质并转化为还原糖类和含氮类化合物,出现总糖含量持续下降、还原糖和总蛋白含量上升的现象.裂褶菌和香菇在发酵培养的中后期,还原糖、总糖和总蛋白的含量均有不同程度的上升,表明裂褶菌和香菇在营养生长的后期产生大量的糖类代谢产物,从而整体提高基质的总糖含量.此外,云芝、香菇和裂褶菌等高等真菌由于缺少叶绿素而不能像自然界中的植物一样开展光合作用来进行营养合成与积累,只能通过菌丝体从基质中获得生长所需的各类营养物质,在此过程中,微生物分解利用基质中的碳源、氮源和无机盐等物质,同时由于次生代谢化合物的产生增加基质中化合物的种类和含量,这些化合物除了具备一定的营养价值以外,同时也具有一定的抑菌、抗氧化和抗肿瘤等活性.微生物发酵技术是近代食品和药品研发的重要手段.

