木薯MeGalt1基因克隆、在采后生理腐烂过程中表达分析及载体构建
安飞飞, 崔梦佳, 杨 龙, 陈松笔
(1.中国热带农业科学院热带作物品种资源研究所/农业部木薯种质资源保护与利用重点实验室,海南 海口 571101;2.南京农业大学农学院,江苏 南京 210000;3.贵州省亚热带作物研究所,贵州 兴义 562400)
木薯(ManihotesculentaCrantz)是世界亚热带和热带地区近10亿人的主要粮食作物,在世界粮食安全、生物质能源和食品加工等领域扮演着不可替代的角色[1,2].然而木薯块根采后24~72 h内周边部位出现褐色或蓝黑色斑点,失去其加工价值,这种现象称之为“采后生理性腐烂”(post-harvest physiological deterioration, PPD)[3-5].PPD现象极大影响了木薯的开发利用,成为制约木薯产业发展的重大瓶颈.研究表明木薯块根活性氧积累和快速迸发是产生PPD的主要原因[6-8],影响PPD产生的代谢通路涉及氧化胁迫[9-11]、钙信号转导和细胞凋亡[12]、乙烯和苯丙酸通路[13]、MAPK(胞外信号调节激酶)cascades[14]、蛋白质N-糖基化修饰通路[15].但至今尚未有一种行之有效的方法可用于抑制木薯块根PPD[16].因此,解析木薯PPD产生的分子机制,选育耐PPD的木薯品种,是今后木薯块根综合利用的研究热点,也是全球木薯育种家面临的挑战.
蛋白质N-糖基化修饰是真核生物蛋白质翻译后修饰的一种重要手段,参与细胞识别、分化、发育、信号转导和免疫应答等多个重要的生命过程[1]〗.β-1,3-半乳糖基转移酶(Galt)是参与蛋白质N-糖基化修饰过程的关键酶,Galt1是形成糖蛋白中Lewis a结构的关键酶,在植物应对环境胁迫中起着重要作用[18],但其在木薯块根PPD中的功能尚未清晰.我们前期研究发现,随着木薯块根腐烂加重,Galt活性也随之增高.为进一步研究MeGalt1在木薯PPD过程中的作用机制,本研究在克隆木薯MeGalt1基因的基础上,分析MeGalt1基因在不同采后生理腐烂程度块根中的表达变化,并构建相关的植物表达载体,为进一步解析MeGalt1在木薯块根采后生理腐烂中的分子作用机制提供依据.
1 材料与方法
1.1 材料
本研究选用的材料TMS 60444、华南9号(SC9)来自中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃,于植后9个月收获木薯块根进行试验.
1.2 方法
1.2.1 试验处理 植后9个月收获SC9块根,置于26 ℃、相对温度为55%~60%的恒温培养箱中,于3、6、9 d对块根PPD程度进行观察并取样,每次取3个重复,经液氮速冻后,保存于-80 ℃备用.
1.2.2 RNA提取与cDNA合成 参照RNA提取试剂盒(DP441)提取木薯块根总RNA,利用北京全式金公司生产的第一链cDNA合成试剂盒(AT311-02)将RNA反转录成cDNA,-20 ℃储存备用.
1.2.3 引物设计与实时荧光定量聚合酶链式反应(RT-PCR) 用Primer 5.0设计MeGalt1全长扩增及定量PCR引物,由广州艾基生物技术有限公司进行合成.引物序列如下表1所示.MeGalt1基因全长扩增正向、反向引物分别带有KpnⅠ和SpeⅠ酶切位点及保护碱基,可用于植物表达载体的构建.RT-PCR采用TaKaRa公司生产的SYBR试剂盒(RR820A),按说明在Thermo Fisher Scientific公司生产的 Real-time Thermal Cycler上操作,反应程序为:95 ℃预变性30 s,95 ℃ 10 s,55 ℃ 10 s,72 ℃ 20 s,40个循环.每个样品重复3次,相对表达量按ΔΔCT法进行计算.

表1 木薯MeGalt1的全长扩增及实时荧光定量PCR引物Table 1 Primers of the MeGalt1 gene for PCR and RT-PCR
1.2.4 N-糖基化修饰的Western Blot检测 参照Carvalho et al[19]方法利用专一性识别糖蛋白中Lewis a结构的JIM84抗体[18]对PPD过程中的N-糖基化修饰水平进行验证.取1.5 g木薯块根,经丙酮沉淀后进行Western blot验证.
1.2.5 生物信息学分析 采用Clustal X软件进行序列比对;采用ExPASy ProtParam软件分析蛋白质的分子量和等电点;采用Mega 4.0软件构建系统发育树.
1.2.6 植物表达载体构建 用限制性内切酶KpnⅠ和SpeⅠ分别对含有目的基因MeGalt1-1和MeGalt1-3的重组质粒和植物表达载体pCAMBIA1300r进行双酶切.酶切体系20.0 μL:dd H2O 14.0 μL,质粒3.0 μL,10×Fast Digest Buffer 2.0 μL,KpnⅠ和SpeⅠ各0.5 μL,37 ℃反应3 h,65 ℃ 10 min.反应产物用1%琼脂糖凝胶进行电泳,分别回收MeGalt1-1和MeGalt1-3目的片段和pCAMBIA1300r载体片段,用T4连接酶将目的基因片段和植物表达载体片段进行连接,16 ℃过夜反应;将连接产物转化大肠杆菌TOP10,筛选阳性克隆;进行PCR及双酶切验证,测序,构建植物表达载体pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3.
2 结果与分析
2.1 木薯块根采后不同时间点PPD观察
SC9木薯块根置于26 ℃恒温箱,分别在第0、3、6、9 d取样观察,其表型如图1所示,采后第0天,木薯块根水分含量充足有光泽,没有PPD现象;采后第3天,块根出现轻微变质,横切面上外围出现了黑色斑块;采后第6天,块根出现了较大面积变质,面积约占横切面的1/3;采后第9天,块根整个横切大部分均出现PPD变质现象,且块根出现了裂缝.
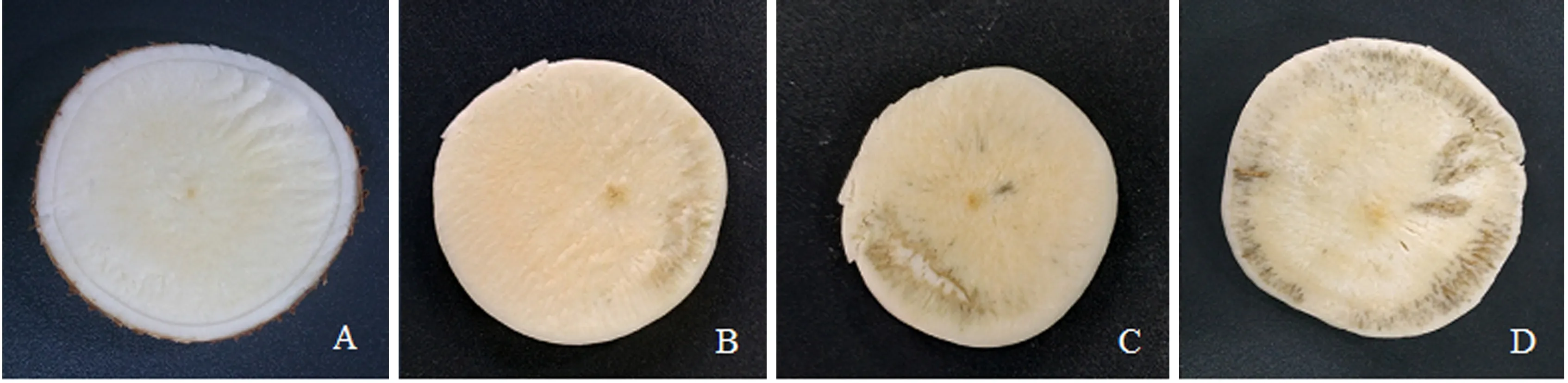
A:0 d;B:3 d;C:6 d;D:9 d.图1 SC9采后常温不同时间点PPD情况Fig.1 PPD of cassava SC9 at different time periods
2.2 木薯MeGalt1基因的克隆
以拟南芥AtGalt1序列(At1g26810)为基础,在木薯数据库中寻找与其同源的序列(Manes.01G091600, Manes.01G036300, Manes.05G102300),分别命名为MeGalt1-1、MeGalt1-2、MeGalt1-3.设计特异性引物,以木薯TMS 60444块根cDNA为模板,进行PCR扩增,经1%琼脂糖凝胶电泳检测,获得1条约2 000 bp的单一条带(图2).回收PCR产物连接Blunt Zero载体,测序比对后发现MeGalt1-1与Phytozome数据库木薯基因组(栽培品种:AM560)公布的Manes.01G091600序列一致,MeGalt1-2与Manes.01G036300有6个碱基的差异,同源性高达 99.7%,MeGalt1-3与Manes.05G102300只有1个碱基的差异,同源性高达99.9%.其编码的氨基酸、预测的蛋白质分子质量及理论等电点如表2所示.UniProt数据库显示MeGalt1-1、MeGalt1-2和MeGalt1-3编码的蛋白均含有半乳糖基转移酶的保守结构域(PF01762),这进一步表明克隆到的基因为MeGalt1基因.
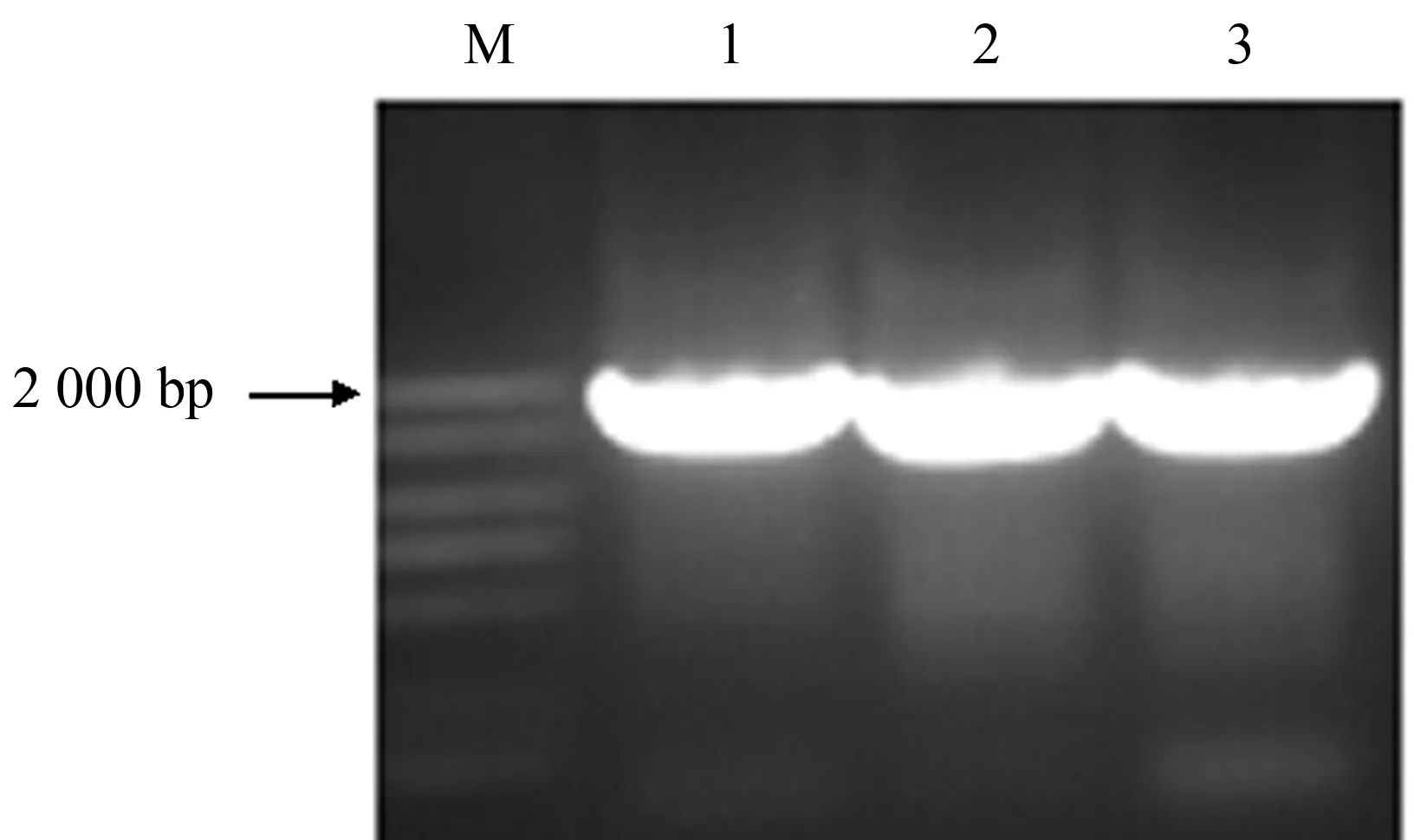
M:DL2000 marker;1:MeGalt1-1基因;2:MeGalt1-2基因;3:MeGalt1-3基因.图2 MeGalt1基因PCR电泳结果Fig.2 Electrophoresis of PCR products of the MeGalt1 gene

表2 木薯MeGalt1的基本信息Table 2 Basic information of the MeGalt1 gene
2.3 基因MeGalt进化分析
以拟南芥中6个编码Galt的蛋白序列为参考,在Phytozome木薯数据库中进行比对,得到9个MeGalt基因,将其氨基酸序列与拟南芥编码Galt的序列进行比对并进行进化分析(图3).图中可以看出在木薯中编码MeGalt1的有3个基因(MeGalt1-1、MeGalt1-2、MeGalt1-3),根据拟南芥中AtGalt1的功能,可推测木薯中这3个基因与蛋白质N-糖基化修饰中Lewis a结构形成密切相关.

◆木薯中编码MeGalt1的3个基因.图3 MeGalt1基因系统进化分析Fig.3 Phylogenetic tree of the MeGalt1 gene
2.4 MeGalt1在木薯PPD过程中的表达分析
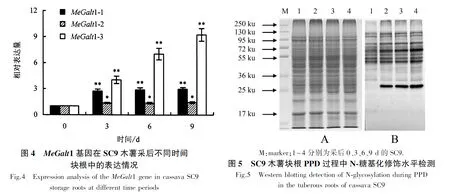
利用RT-PCR技术对MeGalt1基因在木薯块根PPD过程中的表达情况进行分析(图4).随着时间的推移,MeGalt1-2基因无显著变化,MeGalt1-1及MeGalt1-3基因表达显著增强,且MeGalt1-3基因表达变化最显著.基于上述结果,推测参与木薯块根PPD调控过程的基因为MeGalt1-1和MeGalt1-3.
2.5 木薯块根PPD过程中蛋白质的N-糖基化修饰水平检测
为进一步检测木薯块根PPD过程中蛋白质是否存在N-糖基化修饰水平的变化,利用专一性识别糖基化蛋白的抗体JIM84检测SC9木薯采后不同时间(0、3、6、9 d)块根中N-糖基化修饰水平情况(图5).在采后3~9 d,约25和35 ku的蛋白质发生明显的N-糖基化修饰,证明木薯块根PPD过程受到蛋白质N-糖基化修饰的调控.本研究结果可为开展后续研究提供依据.
2.6 木薯MeGalt1表达载体的构建
用限制性内切酶KpnⅠ、SpeⅠ分别对含有目的基因MeGalt1-1和MeGalt1-3的重组质粒和植物表达载体pCAMBIA1300r质粒进行双酶切反应,连接后转化大肠杆菌TOP10感受态细胞,提取质粒经PCR检测,电泳获得约2 000 bp的条带.同时,提取质粒并进行双酶切反应,分别获得约10 000 bp的载体和约2 000 bp的条带(图6),2种验证方法都获得与目的基因片段长度一致的条带.经进一步测序验证,明确为MeGalt1-1和MeGalt1-3基因,表明已成功构建pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3植物过表达载体.
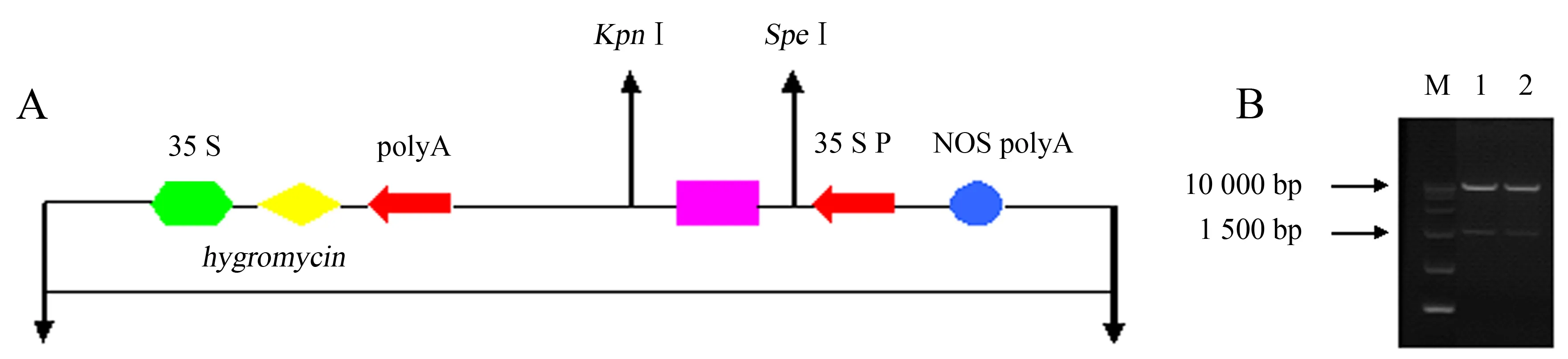
M:DL15000 marker;1:pCAMBIA1300r-MeGalt1-1双酶切;2:pCAMBIA1300r-MeGalt1-3双酶切.图6 植物表达载体pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3示意图(A)及双酶切验证(B)Fig.6 Schematic diagram of pCAMBIA1300r-MeGalt1-1 and pCAMBIA1300r-MeGalt1-3 (A) and verification by restriction enzyme digestion (B)
3 讨论
β-1,3-半乳糖基转移酶(Galt)是参与N-聚糖加工及蛋白质糖基化修饰的关键酶.目前已经从多个物种中克隆了Galt基因[20,21],然而在热带作物木薯中还没有关于Galt基因克隆的报道.本研究从木薯TMS 60444中克隆了3个Galt1基因MeGalt1-1,MeGalt1-2和MeGalt1-3,分别具有1 890、1 893和1 902 bp的开放阅读框,编码629、629和633个氨基酸,与其他物种中的Galt1大小基本一致.
构建植物表达载体是基因功能验证的主要手段之一.通过构建N-糖基化修饰过程中不同基因的植物表达载体,可验证这些基因的生物学功能.Strasser et al[18]通过构建AtGalt1过表达载体,验证AtGalt1与N-糖中Lewis a结构形成密切相关.Ghosh et al[22]与Meli et al[23]通过构建RNAi干扰载体,验证抑制N-糖加工酶活性可延缓果实成熟.Liebminger et al[24]研究表明,N-聚糖加工酶MNS在拟南芥根系形成发育过程中起到重要作用[24].
木薯PPD现象是一种生理性病害,其产生是一个复杂的生物学过程,涉及到多个代谢通路[10].利用转基因技术过量表达活性氧清除基因MeCu/ZnSOD和MeCAT1,转基因植株块根的丙二醛、叶绿素降解、脂质过氧化和H2O2积累水平与对照相比显著降低,达到延缓PPD超过10 d的效果[25].Zidenga et al[26]采用转基因方法过量表达AOX1A基因,显示转基因植株活性氧积累水平比对照降低10倍,从而使采后块根的PPD发生延缓了14~21 d.Vanderschuren et al[13]通过转基因方法过量表达胞质谷胱甘肽过氧化物酶基因,发现转基因植株块根能延缓PPD产生,减少脂质过氧化和H2O2积累.Beyene et al[27]通过DXS和crtB共表达提高β-胡萝卜素在木薯块根的积累,与非转基因植株对照相比,置于常温10 d没有PPD现象,而对照腐烂变质程度达到50%.前期研究表明N-聚糖加工酶α-甘露糖苷酶(MeMNSs)与木薯PPD过程存在相关性[15],且N-糖基化修饰参与了木薯PPD调控过程,但其具体的分子调控机理尚待进一步明确.我们前期研究发现,随着木薯块根腐烂加重,Galt活性随之增高.本研究表明MeGalt1-1及MeGalt1-3基因表达随着采后生理腐烂程度的加深而显著增强,进一步证实MeGalt表达与木薯PPD过程存在相关性.在此基础上成功构建木薯Galt1-1和Galt1-3基因表达载体pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3,为进一步研究该基因以及蛋白质N-糖基化修饰在木薯采后生理腐烂过程中的生物学功能奠定了基础.

