甘草缓大黄峻烈之性的研究进展
赵 琦,陈艳琰,徐顶巧,乐世俊,张 桥,付瑞嘉,唐于平
甘草缓大黄峻烈之性的研究进展
赵 琦,陈艳琰*,徐顶巧,乐世俊,张 桥,付瑞嘉,唐于平*
陕西中医药大学 陕西省中医药管理局中药配伍重点研究室,陕西 咸阳 712046
药性理论是中医药理论体系的核心组成部分,也是指导临床使用中药和阐释中药作用机制的重要依据。有着“国老”美誉的甘草,因其药性和缓,是中医方剂中发挥调和作用的首选药物;而素有“将军”之称的大黄,其药性峻烈,虽为泻下良药,使用不当却会对机体造成损伤。大黄-甘草临床配伍应用已有数千年历史,甘草以其“调和”之性缓大黄峻烈之力,不仅可缓和大黄的泻下作用,还能减轻其不良反应。基于药性理论阐释了甘草缓大黄峻烈之性的传统认识,综述了大黄-甘草配伍后的物质基础、药物代谢、肠道动力、水液代谢、肠道菌群及免疫调控的现代研究进展,以期为甘草缓大黄峻烈之性的深入研究提供依据,同时为阐明甘草“调和”之性的科学内涵提供研究思路。
甘草;大黄;药性;配伍;物质基础;药物代谢
中药药性理论是指导中医临床遣药组方的基本理论之一,也是中药配伍的重要原则[1]。药物虽有个性之长,但使用单味中药治疗疾病往往存在一定的局限性,同时也不能满足复杂病情的需要。中药需要通过合理的配伍应用来调其偏性、制其毒性,可最大限度避免不良反应,使其发挥最佳疗效。因此,基于药性理论开展配伍研究,对深入揭示中药配伍科学内涵具有重要意义,同时也为更安全有效地指导中医临床用药提供重要依据[2]。
甘草是中药在临床中应用最为广泛、使用频次最高的一味药物[3]。《神农本草经》将甘草列为上品,曰:“甘草,味甘,平”。《本草纲目》云:“诸药中甘草为君,治七十二种乳石毒,解一千二百草木毒,调和众药有功,故有‘国老’之号”[4]。陶弘景称:“此药最为众生之主,经方少有不用者也”,故有“十方九草”之说。甘草缓急止痛,调和诸药,其药性和缓,可与多种中药配伍应用,既可通过发挥解毒的作用来降低某些药物的毒性,也可通过“调和”功效与寒热补泻各类药物通用来发挥最佳疗效[5]。大黄是传统泻下类中药的典型代表,性味苦寒,始载于《神农本草经》,列为下品。《药品化义》曰:“大黄气味重浊,直降下行,走而不守,有斩关夺门之力,故号‘将军’”[6]。《历代本草药性汇解》亦云:“大黄气味大苦大寒……虽应天顺人,救民水火,然亦不免于未尽善之仪矣……故伤寒家”。《本草蒙荃》又记载:“勿服太过,下多亡阴”。大黄作用峻猛,用之不当则易致肠腑津液损伤,且多易伤正,故临床常配伍使用。
大黄-甘草配伍临床应用已有数千年的历史,甘草甘平,以其调和之性缓大黄峻烈之力,使大黄攻下而不伤正气。现代研究也表明大黄-甘草配伍后,甘草一方面能够缓和大黄的峻下作用,另一方面则能减弱大黄峻烈之性导致的不良反应[7]。尽管大黄-甘草配伍在泻下攻积方面显示出明显的临床益处,但其相互作用机制并未得到充分阐释。中药配伍前后的变化体现在多方面,本文基于药性理论阐释了甘草缓大黄峻烈之性的传统认识,并从大黄与甘草配伍后物质基础、体内过程、生物效应等方面综述了甘草缓大黄峻烈之性的现代研究进展,以期为其作用机制的深入探究提供科学依据及参考。
1 甘草缓大黄峻烈之性的传统认识
1.1 大黄峻烈之性的传统认识
《神农本草经》记载大黄:“气味苦寒,主下淤血,血闭,寒热,破癥瘕积聚,留饮,宿食,荡涤肠胃,推陈致新,通利水谷,调中化食,安和五脏”。《本草正义》云:“迅速善走,直达下焦,无坚不破,有犁庭扫穴之功……迅如走丸,一过不留”。《名医别录》又云“此药乃除实热燥结,下有形积滞之要品”。均提示大黄为泻下通降之要药,正常情况下机体摄入的饮食水谷可布散全身,营养五脏六腑及组织相互为用,浊毒腐秽之物则从下焦排出。而实热壅滞者,浊毒之物停留于消化道,久留则必化毒以为害,积滞之积聚非峻猛急下不足以开通闭塞。张仲景在《伤寒杂病论》中开峻下法之先河,是指用峻烈泻下药攻逐里实的方法,多治疗实热壅滞的阳明腑实证[8]。大黄苦寒沉降,气味俱厚,其性猛利,善下泄,故凡里、实、热、阳均为其适应证。大黄攻积导滞,不仅善通有形之实邪,促进胃肠运动及水谷糟粕下行,使积蓄的肠道内容物迅速排出;还可通无形之邪气阻滞,通降胃肠等六腑之气,以达调畅五脏气机。
《药性通考》记载:“况用大黄以祛除,未免损伤肠胃之气”。《本草新编》记载:“此药有勇往直前之迅利,有推坚荡积之神功……但用之必须看症甚清,而后下药甚效,否则,杀人于眉睫也”。可见大黄药性峻烈,使用不当轻则“损伤肠胃之气”,重则“杀人于眉睫”[9]。提示大黄在峻下的同时易产生不良反应,大黄峻下攻积,力量峻猛,起效迅速,但味至苦、气大寒,苦能燥湿,易伤胃阴,寒能胜热,易伤中阳,造成亡阴亡阳之变,则正气易损。中医认为“苦寒败胃”,古代医家所指胃不仅是解剖意义上的胃,还涉及胃、小肠、大肠、肝脏等消化系统的多个脏器。现代研究也表明大黄久用或多用确实会产生腹胀、腹痛、腹泻等消化道刺激甚至导致胃肠和肝肾毒性,但若用量合理、配伍得当,可使其发挥较好的临床疗效。
1.2 甘草缓大黄峻烈之性的传统认识
甘草味甘性平,长于调和诸药,能够调和药物的毒性和偏性,在方剂中一般作为佐使药[10]。如《本草证》中记载:“甘草,味至甘,得中和之性,有调补之功,故毒药得之解其毒,刚药得之和其性,表药得之助其外,下药得之缓其速”。《本草发挥》亦云:“甘草性平,……凡用纯寒纯热之药,必用甘草,以缓其力也。寒热相杂药,亦用甘草,调和其性也”。甘味在五行属土,土能生养万物,对人体具有补养作用,故能“和”、能“缓”、能“补”,正如《医学衷中参西录》曰:“……味至甘,得土气最全,万物由土而生,复归土而化,故能解一切毒性。甘者主和,故有调和脾胃之功;甘者主缓,故虽补脾胃而实非峻补”。甘草在药物配伍中具有与众不同的调和之性[11],其实质包括缓急、缓药及解毒。缓急体现的是甘草的自身药理作用,一是缓解形体之拘急,二是缓解情绪之急躁,如缓急止痛、缓急舒筋、缓急安神等。缓药是指调和药物的性能,主要体现在能与咸苦辛酸味及寒热温凉性药皆可相伍。解毒则是缓解和消除药物引起的不良反应,使之安全有效。
大黄性味大苦大寒,功效峻猛,配伍是缓和大黄峻烈之性的有效手段。《金匮要略》中所载大黄甘草汤,仅由大黄、甘草组成,两药合用虽属下法,但并非大黄之峻下,而是取缓下之效。方中大黄为君,荡涤肠胃浊气宿结,推陈致新,但峻烈攻下易伤正气;甘草调和缓急,以防峻下伐正,使攻下而不伤正气,清热而胃气和降。两药配伍,相使为用,一攻一补,一速一缓,不仅可以发挥大黄泻下的作用,而且不伤胃气,药简力专,直达病所。《绛雪园古方选注》云:“调胃承气者,以甘草缓大黄、芒硝留中泄热,故曰调胃……泄尽胃中无形结热,而阴气亦得上承,故亦曰承气”[12]。调胃承气汤中用大黄、芒硝攻下里实,同时又配甘草和中,使黄、硝泻下去腑实而不伤胃气,具有调和肠胃,缓下热结之功效。《本草新编》亦记载:“大黄性甚速,走而不守,……欲其少留,用甘草能缓也”。可见中医常将大黄与甘草配伍来更好地发挥泻下功效。陈嘉倩等[13]对中医方剂数据库内以大黄发挥泻下作用的常见配伍药物进行统计,发现配伍频率最高的是甘草,占26.21%,这为大黄-甘草泻下药对的科学研究提供了数据支撑。古代医家将大黄与甘草配伍,苦寒与甘平相结合,以甘草调和之性缓大黄峻下之力,发挥配伍优势。
2 甘草缓大黄峻烈之性的现代研究
2.1 大黄峻下作用及不良反应研究现状
大黄为蓼科植物掌叶大黄L.、唐古特大黄Maxim. ex Balf.或药用大黄Baill.的干燥根和根茎,其主要化学成分包括蒽醌类、蒽酮类、二苯乙烯类、苯丁酮类、色原酮类、鞣质类、多糖类等[14]。大黄的泻下有效成分主要为蒽醌类及其衍生物,其中,以结合蒽醌(如番泻苷A)泻下效力较强,游离蒽酮(如番泻苷元A)较弱,游离蒽醌(如大黄素、大黄酸、大黄酚、芦荟大黄素、大黄素甲醚)更弱[15]。结合型蒽醌在小肠不易被吸收,能够顺利进入结肠,故被认为是泻下作用的主要成分,而游离蒽醌易在小肠吸收,经肝肠循环吸收入血,不能到达结肠故被认为泻下活性较低。但现代研究已经证实,大黄中番泻苷A和大黄酸苷是一种无活性的糖苷,本身不具有泻下作用,在结肠内会被双歧杆菌产生的β-葡萄糖苷酶代谢转化为真正的泻下活性成分-大黄酸蒽酮、大黄酸[16],这些游离蒽醌才是大黄发挥泻下作用的最终物质,其代谢过程见图1。
大黄主要作用于结肠以发挥其泻下作用,机制是增加肠张力,加快肠蠕动,刺激肠黏膜,促进水和电解质向结肠腔内分泌,从而促进排便[17]。游离型蒽醌易被小肠吸收,不能到达大肠发挥作用,但可通过抑制钠,钾-三磷酸腺苷酶(Na+, K+-adenosine triphosphatase,Na+, K+-ATP酶),增加肠腔内水分,从而促进蠕动而排便;而结合型蒽醌中的糖苷能够保护苷元不在小肠中被水解和氧化,在刺激肠道和导泻中发挥重要作用[14]。另外,大黄促使水通道蛋白(aquaporins,AQPs)在结肠表达的改变,也是其发挥泻下作用的重要机制之一。
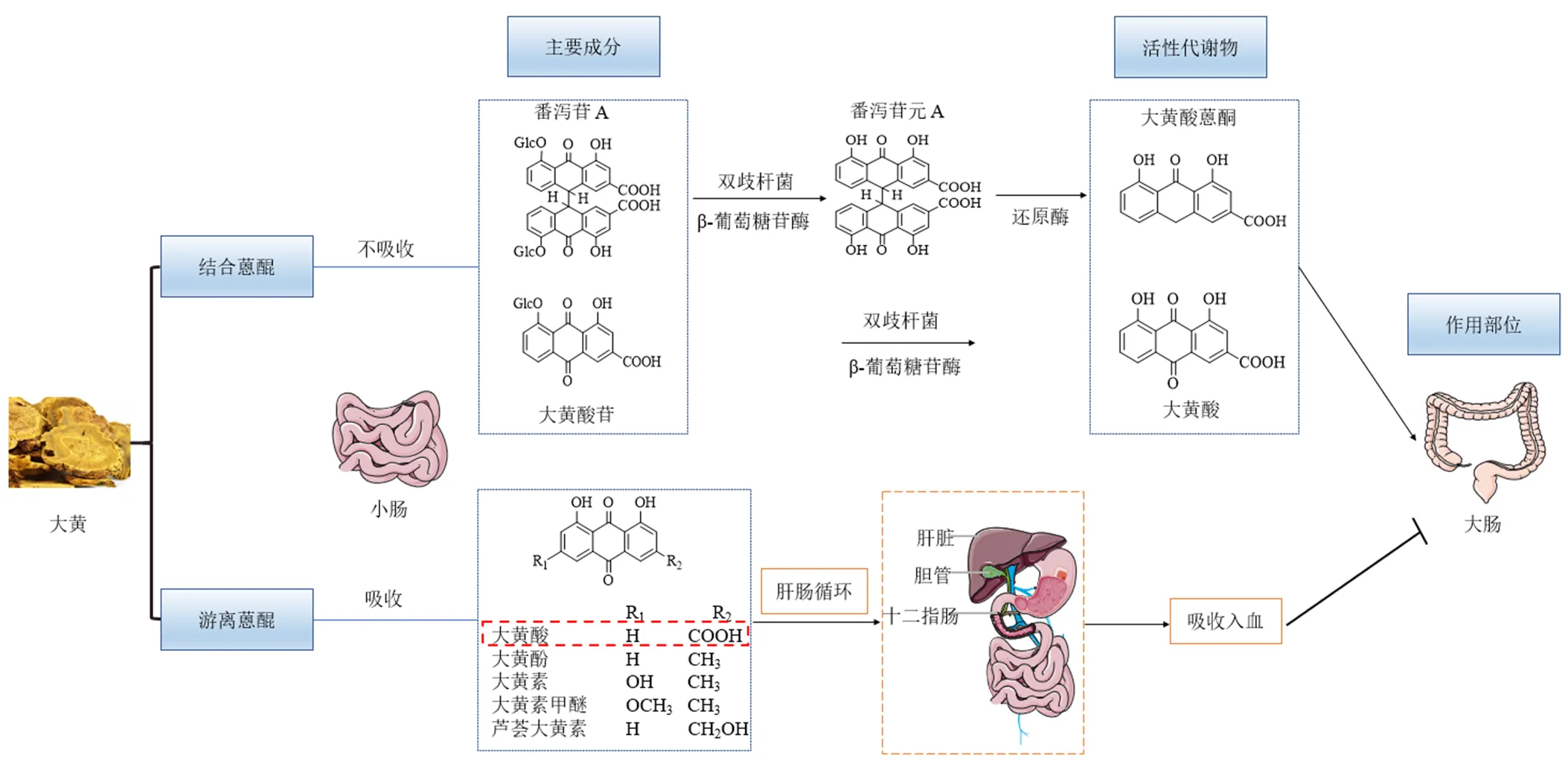
图1 大黄中蒽醌的体内代谢过程
现代研究表明大黄在发挥泻下作用的同时对胃肠道黏膜有较强的刺激作用(恶心、呕吐、腹痛、腹胀),可导致肠动力障碍、肠道菌群紊乱、肠道屏障功能失调和机体免疫降低,也会引起水液代谢紊乱造成剧烈腹泻等。且长期服用会产生耐药性从而降低疗效,甚至与结肠黑变病形成、结肠癌风险增加等一系列肠道不良反应有关[18]。值得注意的是,大黄还具有抑制和兴奋肠道蠕动的双向调节功能,体现为泻下和止泻的双重功效[19]。其所含鞣质类成分具有收敛止泻作用,可抑制胃肠道蠕动,长期低剂量服用反而会引起停药后的继发性便秘。除影响胃肠功能外,大黄的肝肾毒性也备受关注,研究主要集中在蒽醌类化合物。大黄酸在肠道中的代谢积累与结肠黑变病的发生有关,其诱导的细胞凋亡和自噬可能是大黄酸毒性的机制[20]。芦荟大黄素的毒性作用机制是通过诱导跨膜蛋白死亡因子、线粒体和内质网应激触发的细胞凋亡通路[21]。大黄素通过激活半胱氨酸蛋白酶3依赖途径和线粒体途径诱导细胞凋亡而表现出肝肾毒性,此外,还涉及谷胱甘肽代谢和脂肪酸代谢途径[22]。也有关于大黄的遗传毒性、生殖毒性、致癌作用和胚胎发育毒性的报道。可见,大黄在发挥治疗作用的同时会产生不良反应,影响其临床使用。
2.2 甘草缓和大黄峻下之性及不良反应
大黄-甘草配伍在泻下攻积方面显示出明显的临床益处。现代临床上应用大黄甘草汤治疗便秘有较好的疗效,邵景贤[23]应用大黄甘草汤治疗抗精神药物引起的便秘113例,总有效率为90%,疗效显著且作用缓和,除少数有轻微腹痛外,无其他不良反应。刘宝忠等[24]用大黄甘草汤治疗精神病患者便秘163例,总有效率为85.27%,疗效可靠,仅18例出现轻微腹痛。大黄作用峻猛,故年老体虚、脾胃虚弱者应慎用。董素琴[25]运用大黄甘草汤治疗老年人便秘,效果良好。可见,临床上大黄与甘草配伍使用可更好地发挥大黄泻下作用并缓和其不良反应。
甘草为豆科植物甘草Fisch.、胀果甘草Bat.、或光果甘草L.的干燥根和根茎。其主要化学成分包括三萜皂苷类、黄酮类、香豆素类、生物碱类、糖类等[26]。其中甘草调和诸药的活性成分为三萜皂苷类(甘草酸、甘草次酸)、黄酮类(甘草苷、甘草素)等,主要与配伍前后体外化学成分改变、体内代谢以及甘草本身的药理作用有关:(1)与药物共煎发生沉淀或络合反应使有效成分发生相关变化或降低毒性成分含量[27-28];(2)甘草的肾上腺皮质激素样作用可提高机体对毒物的耐受性;(3)调节肝脏细胞色素P450(cytochrome P450,CYP450)酶系,尤其是CYP3A酶,上调外排转运蛋白的表达和功能,主要包括P-糖蛋白(P-glycoprotein,P-gp)、乳腺癌耐药蛋白(breast cancer resistant protein,BCRP)、多药耐药蛋白,延缓毒性成分的吸收和分布,促进其代谢和排泄从而降低毒性[29-30];(4)增加肠道有益菌(如乳酸菌、双歧杆菌等)的数量和种类并影响肠道菌代谢来发挥其调节作用[31];(5)通过其解痉、抗心律失常和神经保护等药理作用来减轻药物的不良反应;(6)甘草中的生物大分子甘草蛋白类可经自组装形成纳米颗粒,与其解毒作用有关[32];(7)甘草及其有效成分具有抗炎和抗过敏活性,其主要通过白细胞介素-10、12等免疫分子来发挥作用,抑制免疫损伤[33]。甘草可以有效地缓和大黄的峻下作用并减轻其不良反应[34],临床上常通过将大黄和甘草配伍使用,来达到减轻呕吐、恶心、腹痛及腹泻等不良反应,降低肝肠毒性等[35]。本文主要从配伍前后体内外化学成分、肠道动力、水液代谢、肠道菌群等方面进行了阐述,见图2。
2.2.1 大黄配伍甘草后对化学成分的影响 对于大黄-甘草配伍前后化学成分变化的研究报道较多,目前尚未见到大黄-甘草配伍后有新化学成分生成的报道,仅是在化学成分含量上发生了改变[36],大多数文献研究结果表明,二者配伍后,甘草可增加大黄中游离蒽醌的提取率,降低结合蒽醌的提取率[37]。比较大黄-甘草合煎液与单煎液中甘草酸的含量变化,发现甘草酸在合煎液中含量明显高于单煎液,表明二者合煎有利于甘草酸的溶出[38]。甘草酸是甘草中最主要的活性成分,属于天然的表面活性剂,这可能是导致游离蒽醌溶出增加的原因。大黄-甘草配伍后结合蒽醌类成分溶出率较单味大黄低,可能是配伍后药效缓和的主要原因。推测其原因是大黄-甘草配伍增加了甘草酸含量,且甘草酸可与生物碱、蒽醌、金属离子等结合产生沉淀或生成极性较大且难以被胃肠吸收的大分子络合物,通过发挥其沉淀作用从而降低结合蒽醌的含量。
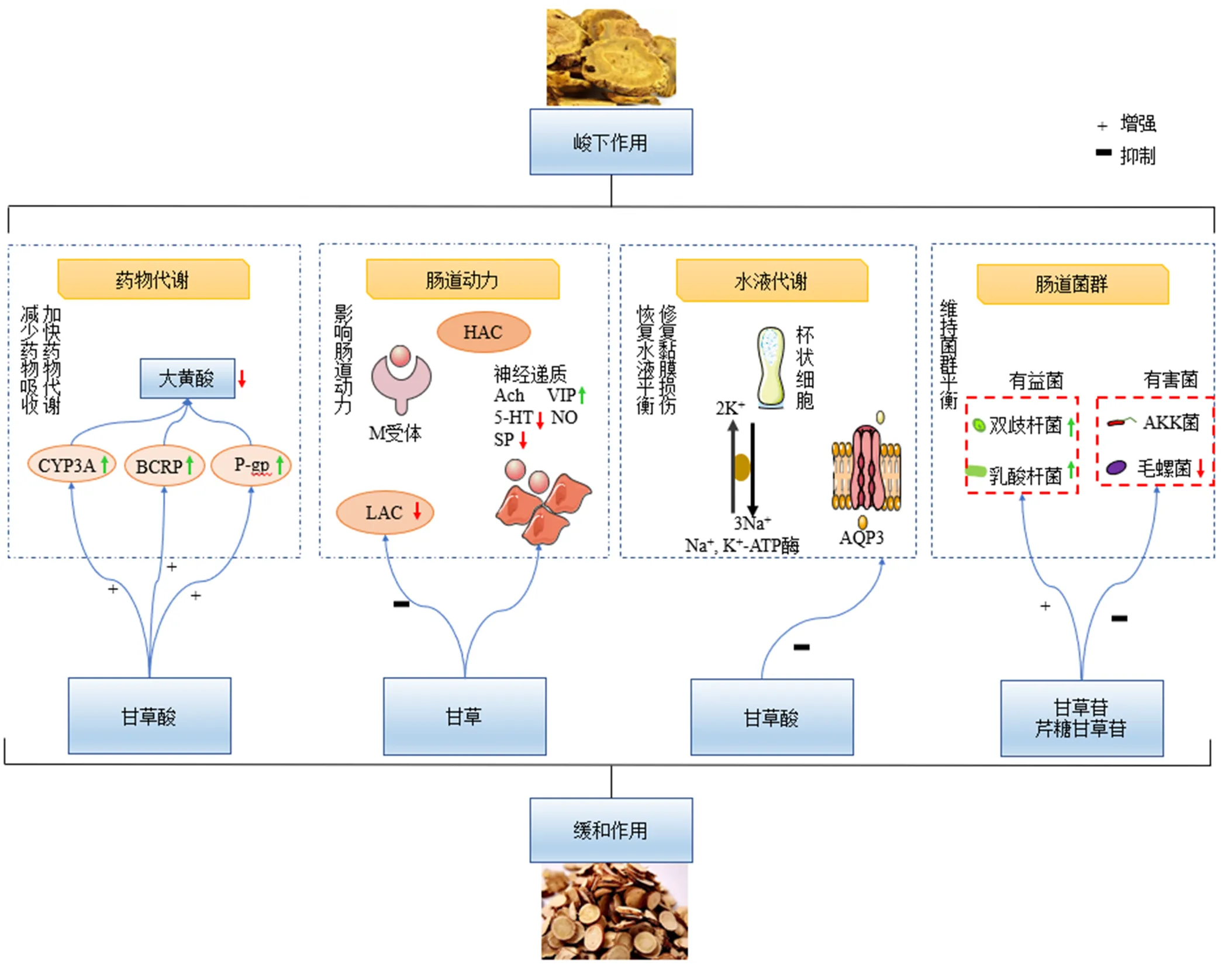
图2 甘草缓和大黄峻下之性的作用机制
2.2.2 大黄配伍甘草后对药物代谢的影响 大黄酸是大黄中主要的游离蒽醌成分,同时也是结合蒽醌代谢的主要产物。在小肠中被吸收的大黄酸,主要分布在肝脏中代谢,经胆汁排泄进入肝肠循环增加其被人体吸收的机率,能够迅速吸收入血[39]。大黄中蒽醌类物质体内药动学研究表明,大黄酸的血药浓度在口服后存在“双峰”现象,分别是在小肠吸收很少的大黄酸苷被肠道菌群水解为大黄酸,以及大黄素、大黄酚、芦荟大黄素在体内代谢为大黄酸所造成的,且大黄酸含量与肝损伤程度呈正比,故大黄酸被认为是大黄的主要有效成分和毒性成分[40]。
甘草与药物配伍后,可对与其配伍的药物代谢产生影响,延缓和减少药物吸收。大黄酸和甘草酸体内血药浓度较其他成分高说明二者在药物代谢中起主要作用[41]。甘草酸可诱导CYP450活性,加快药物在体内代谢,致使入血成分的血药浓度降低[42]。大鼠ig大黄和大黄甘草汤后,大黄酸血浆浓度-时间曲线均符合二房室模型,单服大黄和服用大黄甘草汤后大黄酸药动学参数均有显著差异,配伍甘草可降低大黄酸在大鼠体内的血药浓度,加快大黄酸的清除率,加快机体对大黄酸的代谢[43]。大黄酸血药浓度的降低可能是其不良反应减轻的原因,作用机制可能为甘草酸可诱导大黄酸CYP3A酶的表达,加快大黄酸代谢,减轻肝脏损伤[44]。转运蛋白BCRP是有效外排载体,主要参与了大黄酸的外排转运。体外细胞实验表明,甘草可通过增强BCRP活性,上调BCRP的转运水平来降低大黄酸在结肠腺癌Caco-2细胞中的吸收,提高大黄酸的外排率[45]。P-gp广泛存在于肠上皮细胞顶膜上,可促进药物和毒物从肠上皮细胞中排泄进入肠腔,并限制药物从肠腔进入血液的转运。大黄-甘草配伍能够显著抑制ATP酶的活性,但是其抑制强度要小于大黄[46],这可能是因为大黄-甘草的抑制作用主要是由大黄发挥主体作用,而甘草及其主要成分甘草酸可增强P-gp的功能和表达[47]。甘草减少药物吸收、改变药物分布可减少非靶部位的药物量,从而可以缓和药物带来的不良反应。
2.2.3 大黄配伍甘草后对肠道动力的影响 大黄通过促进肠道动力来发挥泻下作用,其作用机制为明显减少肠道收缩次数并增加高幅收缩和低幅收缩[48]。番泻苷A可明显促进近端结肠转运[49],其代谢产物大黄酸蒽酮具有胆碱样作用,可作用于肠平滑肌上的M受体刺激胃壁神经及黏膜下神经丛,促进肠道蠕动来增强胃肠动力,从而促进粪便的排出[50]。大黄还可通过介导多种胃肠神经递质来调节胃肠运动,包括乙酰胆碱、5-羟色胺、P物质、一氧化氮和血管活性肠肽等[51]。乙酰胆碱和5-羟色胺可明显兴奋胃肠道平滑肌,使其收缩幅度、张力、蠕动增加,并可促进胃肠分泌[52-53];而血管活性肠肽和一氧化氮属于抑制性神经递质,可抑制肠道环形肌收缩,使肠道长时间处于舒张状态[54]。大黄通过促进乙酰胆碱、5-羟色胺并抑制血管活性肠肽、一氧化氮的释放,从而达到加速转运,促进排便的目的[55]。
大黄作用猛烈,长期服用可损伤肠神经系统,阻碍神经递质的产生及传递,使结肠壁肌间神经丛和肌肉受到损伤,影响肠道传输功能,导致结肠动力障碍[56]。且急速的胃肠蠕动会刺激肠黏膜,导致结肠壁损伤,引起稀便甚至腹泻,同时会带来恶心、腹痛等不良反应。甘草有抑制胃排空及肠道平滑肌运动的功能,配伍大黄后较单用大黄低幅收缩减少,使肠蠕动的幅度和频率均降低[49]。甘草可通过影响胃黏膜及肌间神经丛中5-羟色胺、P物质、血管活性肠肽的分泌来抑制胃肠运动,这表明甘草可调节神经递质来恢复肠道动力[57]。甘草还具有抑制胃酸分泌,缓解胃肠平滑肌痉挛及镇痛作用,甘草酸的抗炎作用可以减轻由大黄带来的结肠炎症反应(排便疼痛或腹痛)[58]。且甘草酸和甘草苷还可协同抑制大黄引起的结肠环形肌的强刺激作用[57],减少对肠黏膜刺激,缓和大黄腹泻引起的剧烈腹痛,这与甘草“解痉缓急”作用一致。由此认为大黄对胃肠运动有过度兴奋作用,而甘草有抑制作用,二者配伍相对减少了大黄的用量,有较为缓和的兴奋肠道动力的作用。
2.2.4 大黄配伍甘草后对水液代谢的影响 结肠水分吸收是体内肠道水液吸收的最终环节,大黄泻下功能与结肠中水分转运密切相关。传统研究认为,大黄通过抑制肠上皮细胞膜上Na+, K+-ATP酶活性,抑制Na+转运,升高肠腔渗透压,抑制水和电解质在肠道中的重吸收,使水分滞留于肠腔而促进排便[59]。《景岳全书》中记载大黄“通水道”,而现代研究表明,水分子通过AQPs中的水孔进出细胞,可实现水在细胞内外的大量快速转运,提示AQPs跨细胞途径的水分吸收可能与肠道液体转运密切相关。在大黄的通便过程中,AQPs在肠道吸收、分泌和水液代谢调节中发挥着重要作用。Kon等[60]研究证实,番泻苷A在结肠中代谢形成大黄酸蒽酮后,通过激活结肠中的巨噬细胞来增加前列腺素E2(prostaglandin E2,PGE2)的分泌,PGE2充当旁分泌因子降低AQP3的表达,减少肠道水分吸收,从而发挥通便作用。大黄及其有效成分还可下调AQP4在便秘模型结肠黏膜层的表达来调节水在肠道的转运和吸收,从而增加粪便含水量[61-62]。结肠上含有大量的杯状细胞,可分泌一定量的黏液,起到润滑和保护肠道并促进粪便排出的作用。大黄还通过促进肠道黏蛋白的大量分泌,从而加速润滑肠道发挥通便作用[63]。
大黄调节肠道中水液代谢而发挥泻下作用,但其性甚速,走而不守,下之太过,容易导致肠液失衡,致泻的同时大量水液冲刷会导致肠黏液层变薄,破坏肠道屏障,影响肠道正常生理功能。Dufour等[64]证实,长期服用蒽醌类药物后可损坏肠黏膜,肌层神经元的损伤可能会影响肠道的协同推进活动,从而延缓肠道内容物的转运,降低药物的通便功效。甘草守而不走,与大黄相伍,动静结合,调控水液代谢从而缓和泻下作用。甘草可能对异常的AQPs基因及蛋白表达、分布产生调节作用,使水液代谢恢复正常[65]。研究证实,甘草酸可抑制大黄酸蒽酮引起的巨噬细胞的活化来降低AQP3表达,二者联合使用可缓和大黄的通便作用并减轻炎症反应[31]。故甘草可能通过对肠道AQPs的调控修复大黄泻下峻猛所致肠黏膜损伤,但其作用机制仍有待进一步研究。
2.2.5 大黄配伍甘草后对肠道菌群的影响 肠道中的微生物区系可将大黄中不被吸收的番泻苷A转化为真正的泻下活性成分-大黄酸蒽酮来发挥泻下作用。健康的肠道菌群有利于维持肠道正常功能并且调节机体代谢,在给予抗生素干扰后,由于肠道内菌群失调,小鼠口服番泻苷A后无泻下作用[66],可见肠道菌群对大黄中番泻苷A的生物利用起着至关重要的作用。但是,大黄的峻猛作用也可能导致肠道细菌在数量上发生变化。双歧杆菌、乳酸杆菌是肠道正常菌群的优势菌,能够与肠黏膜细胞连接形成生物膜,维系着肠道微生态平衡。毛螺菌科细菌能促进对肠道病原体的定植抵抗,影响宿主健康[67]。大鼠连续ig大黄7 d,可使乳酸杆菌科、双歧杆菌科、拟杆菌科在肠道菌群中占比降低,而毛螺菌科丰度有所升高[31]。艾克曼菌是与黏液层密切相关的肠道细菌,长期服用番泻苷A可促进其优势生长,使得黏液屏障的完整性受损[68]。大黄发挥泻下作用的同时容易引起菌群失调,这会使肠道屏障稳态失衡,导致肠道中潜在病原体的入侵和定植,引发炎症反应加剧,进而引起一系列不良反应。
维持肠道菌群的活力是发挥大黄泻下作用不可缺少的环节,但大黄对肠道菌群的破坏又会反过来影响其泻下活性。大黄配伍甘草后,双歧杆菌活性的增加能促进番泻苷A在肠道菌群中的代谢,且番泻苷A与甘草苷、芹糖甘草苷的含量呈剂量相关性;而甘草酸对番泻苷A的代谢率没有影响[69]。大鼠连续ig大黄7 d后毛螺菌科丰度显著增加,乳酸杆菌科丰度显著减少;而ig大黄甘草汤后并未见到这种变化[31]。这可能是由于甘草抑制了大黄增加毛螺菌科丰度、减少乳酸杆菌科丰度所致。此外,大黄素、大黄酸、芦荟大黄素对肠道细菌有一定的抑制作用[70],大黄-甘草配伍能够缓和大黄的峻下作用还可能与二者游离蒽醌溶出的增加有关。大黄-甘草配伍保持了肠道菌群的动态平衡[31],通过甘草调节大黄所致的肠道菌群紊乱可更好的发挥大黄的泻下作用并降低大黄的毒性。
2.2.6 大黄配伍甘草后对免疫调控的影响 大黄峻下作用可促使炎症细胞因子合成和分泌,引起机体炎症反应。Kon等[60]研究发现,大黄在发挥泻下作用的同时会诱发结肠炎症,其机制为番泻苷A经肠道菌代谢为大黄酸蒽酮,该代谢物激活结肠巨噬细胞,引起炎症反应。肿瘤坏死因子-α、白细胞介素-8等促炎因子的应答与组织损伤有关,能够介导细胞免疫反应。长期服用大黄会导致结肠黑变病,Chen等[71]对其分子机制进行研究,发现大黄可破坏肠黏膜屏障,增加肿瘤坏死因子-α的释放,导致结肠上皮细胞凋亡。巨噬细胞可识别并吞噬凋亡细胞,从而在结肠固有层形成棕色色素,最终导致结肠黑变病。甘草及其有效成分对炎症因子及免疫因子有调节作用[72]。甘草可通过增加5-羟色胺和前列腺素的分泌来减轻胃肠炎症[73]。大黄与甘草合用可降低肠衰竭模型大鼠的肿瘤坏死因子-α和白细胞介素-6、8的表达水平,增强抗炎作用[74]。甘草可有效抑制炎症反应,增强免疫功能,这可能是大黄与甘草配伍减轻肠道炎症的机制之一。
3 结语与展望
甘草配伍大黄缓其峻烈之性的研究主要集中在:在化学成分上,甘草可改变大黄中蒽醌类物质的含量,体现在游离蒽醌溶出增加和结合蒽醌溶出降低。但是游离蒽醌及结合蒽醌的变化比较复杂,对于大黄-甘草配伍前后化学成分含量变化的研究结果并不统一,还有待进一步研究。在体内研究上:(1)甘草可加快蒽醌类成分在各组织的清除速率并减少毒性成分的吸收,缓和大黄的不良反应。更深入的机制研究可进一步认识甘草的缓和作用,仍需更多的研究来阐释二者配伍在药物代谢方面的科学内涵。(2)甘草可调节神经递质恢复大黄所致的肠动力障碍,缓和大黄腹泻引起的剧烈腹痛。其缓和作用已明确,但物质基础仍缺少深入研究。(3)甘草通过抑制AQP3的表达来调节水液代谢并减轻炎症反应。肠道中AQPs分布较多,但目前大量研究主要围绕AQP3开展,其余类型AQPs是否对大黄的水液代谢有调控,目前尚不明确。(4)甘草可增强双歧杆菌和乳酸杆菌等有益菌丰度并降低毛螺菌丰度,恢复菌群紊乱,保持动态平衡,但是甘草如何调控肠道菌群丰度和组成有待进一步的阐释。(5)甘草可通过调节炎症因子与免疫因子来减轻大黄所致的肠道炎症反应,增强免疫功能,但是二者配伍后发挥免疫调控的作用机制有待进一步探索。
大黄-甘草是经典的泻下药对,大黄苦寒,荡涤肠胃,推陈致新;甘草甘平,缓急止痛,调和诸药,二药相伍,能下、能通,解毒而不伤正。甘草通过改变大黄中化学成分溶出、影响大黄中活性成分代谢、抑制大黄对胃肠动力的过度兴奋、修复大黄泻下引起的水液代谢失衡、恢复大黄所致的肠道菌群紊乱以及抑制大黄引起的炎症反应等起到缓和药性的作用。中药多成分、多靶点、多途径的作用特点也决定了中药配伍研究的复杂性。综上所述,大黄的泻下作用与配伍前后化学成分、药物代谢、肠道动力、水液代谢、肠道菌群以及免疫调控变化密切相关,且许多方面仍有空白,更不能独立地通过各部分来对配伍甘草后作用机制得到肯定的结论,需要对配伍甘草后相互作用机制做更深入的研究。目前大黄-甘草临床应用仍较广泛,故基于药性理论来认识甘草缓大黄峻烈之性的本质,研究甘草缓大黄的作用及机制具有重要意义,也可为甘草“调和”之性的科学内涵提供研究思路。
利益冲突 所有作者均声明不存在利益冲突
[1] 李彦奇, 赵华叶, 闫沛沛, 等. 浅谈中药药性理论对于临床用药的指导 [J]. 世界中西医结合杂志, 2014, 9(3): 309-311.
[2] 范欣生, 段金廒, 华浩明, 等. 中药配伍禁忌理论探索研究 [J]. 中国中药杂志, 2015, 40(8): 1630-1634.
[3] 曹玉洁, 唐于平, 沈娟, 等. 基于数据挖掘分析甘草药对配伍应用规律 [J]. 中草药, 2017, 48(21): 4552-4559.
[4] 刘萍. 甘草功效和临床用量的本草考证 [J]. 中华中医药杂志, 2020, 35(1): 73-77.
[5] 杨柏灿, 潘颖宜. 甘草在调和药效中的应用: 甘草“调和”实质探析之二 [J]. 中药与临床, 2012, 3(2): 45-47.
[6] 逄冰, 穆兰澄, 王涵, 等. 中药药性的双向及多向性探讨 [J]. 中医杂志, 2015, 56(13): 1085-1088.
[7] 陈艳琰, 曹玉洁, 唐于平, 等. 甘草调和大黄“泻下攻积”作用的量-毒-效关系研究 [J]. 中国中药杂志, 2019, 44(10): 2131-2138.
[8] 李富汉, 汤宝玉. 论仲景运用峻下及对后世的影响 [J]. 国医论坛, 1991, 6(2): 6-9.
[9] 李果, 肖小河, 金城, 等. 大黄不良反应古今论 [J]. 中华中医药杂志, 2007, 22(7): 439-442.
[10] 罗子宸, 张雯, 杨瑞, 等. 甘草“调和诸药”生物药剂学机制的研究进展[J]. 中草药, 2021, 52(1): 267-277.
[11] 杨柏灿, 方瑜. 甘草在调和药物性能中的应用 [J]. 上海中医药杂志, 2012, 46(6): 91-94.
[12] 王子接. 绛雪园古方选注 [M]. 北京: 中国中医药出版社, 2010: 31.
[13] 陈嘉倩, 陈艳琰, 唐于平, 等. 大黄不同功效的古今用药规律分析 [J]. 中草药, 2019, 50(6): 1485-1492.
[14] Cao Y J, Pu Z J, Tang Y P,. Advances in bio-active constituents, pharmacology and clinical applications of rhubarb [J]., 2017, 12: 36.
[15] 哈飞, 李瑞明, 张兰兰, 等. 大黄中4个番泻苷类成分受热条件下转化关系的研究 [J]. 中成药, 2012, 34(11): 2169-2173.
[16] 苏彬, 李晓波. 配伍甘草对大黄泻下作用影响的研究进展 [J]. 中国中药杂志, 2015, 40(4): 577-581.
[17] Zheng Y F, Liu C F, Lai W F,. The laxative effect of emodin is attributable to increased aquaporin 3 expression in the colon of mice and HT-29 cells [J]., 2014, 96: 25-32.
[18] 朱元民. 蒽醌类泻药与大肠黑变病 [J]. 中华消化杂志, 2004, 24(5): 314-315.
[19] 刘春芳, 郑燕芳, 王慧, 等. 不同因素对大黄泻下与止泻双向调节效应的影响 [J]. 世界中医药, 2015, 10(6): 882-886,890.
[20] Cheng Y, Zhang H Q, Qu L J,. Identification of rhein as the metabolite responsible for toxicity of rhubarb anthraquinones [J]., 2020, 331: 127363.
[21] Dong X, Zeng Y W, Liu Y,. Aloe-emodin: A review of its pharmacology, toxicity, and pharmacokinetics [J]., 2020, 34(2): 270-281.
[22] Dong X, Fu J, Yin X B,. Emodin: A review of its pharmacology, toxicity and pharmacokinetics [J]., 2016, 30(8): 1207-1218.
[23] 邵景贤. 大黄甘草汤治疗抗精神病药物引起的便秘113例 [J]. 陕西中医, 2001, 22(7): 393.
[24] 刘宝忠, 张健. 大黄甘草汤治疗精神病患者便秘163例疗效观察 [J]. 山东医药, 2010, 50(52): 31.
[25] 董素琴. 大黄甘草汤临证治验举隅 [J]. 中医研究, 2003, 16(1): 63-65.
[26] Bode A M, Dong Z. Chemopreventive effects of licorice and its components [J]., 2015, 1(1): 60-71.
[27] 李文, 杨晓琴, 章津铭, 等. 附子配伍甘草后对附子生物碱类成分大鼠在体肠吸收特性的影响 [J]. 中国实验方剂学杂志, 2018, 24(22): 11-16.
[28] 郭玉岩, 马文保, 肖洪彬, 等. 基于UPLC-MS技术分析马钱子-甘草药对配伍汤液不同相态中毒效物质的变化规律 [J]. 中草药, 2017, 48(23): 4880-4884.
[29] Lu Y, Xie T, Zhang Y J,. Triptolide Induces hepatotoxicity via inhibition of CYP450s in rat liver microsomes [J]., 2017, 17(1): 15.
[30] He Y F, Ci X Y, Xie Y,. Potential detoxification effect of active ingredients in liquorice by upregulating efflux transporter [J]., 2019, 56: 175-182.
[31] Kon R, Yamamura M, Matsunaga Y,. Laxative effect of repeated Daiokanzoto is attributable to decrease in aquaporin-3 expression in the colon [J]., 2018, 72(2): 493-502.
[32] 贺小燕. 甘草蛋白自组装行为研究 [D]. 福州: 福州大学, 2013.
[33] Sultan M T, Butt M S, Qayyum M M,. Immunity: plants as effective mediators [J]., 2014, 54(10): 1298-1308.
[34] Matsui E, Takayama K, Sato E,. The influence ofand antibiotics on the purgative action of sennoside a from Daiokanzoto in mice [J]., 2011, 34(9): 1438-1442.
[35] Takayama K, Takahara C, Tabuchi N,. Daiokanzoto (Da-Huang-Gan-Cao-Tang) is an effective laxative in gut microbiota associated with constipation [J]., 2019, 9(1): 3833.
[36] 陈艳琰, 曹玉洁, 唐于平, 等. 基于化学成分相互作用研究大黄-甘草配伍应用的物质基础 [J]. 世界科学技术—中医药现代化, 2019, 21(11): 2443-2450.
[37] 韩刚, 金光灿, 叶小舟, 等. 大黄甘草汤中甘草酸对蒽醌类化合物提取率的影响 [J]. 时珍国医国药, 2009, 20(3): 704-705.
[38] 王彬, 韩刚, 张学俊, 等. 大黄甘草汤单煎液与合煎液中蒽醌类化合物和甘草酸煎出量的变化 [J]. 中成药, 2010, 32(10): 1794-1796.
[39] Lee J H, Kim J M, Kim C. Pharmacokinetic analysis of rhein inL. [J]., 2003, 84(1): 5-9.
[40] 王磊, 张静泽, 高文远. 大黄活性成分药代动力学研究进展 [J]. 中成药, 2011, 33(9): 1571-1574.
[41] Chen Y Y, Cao Y J, Tang Y P,. Comparative pharmacodynamic, pharmacokinetic and tissue distribution of Dahuang-Gancao decoction in normal and experimental constipation mice [J]., 2019, 17(11): 871-880.
[42] 韩刚, 王彦雪, 康欣, 等. 18β-甘草酸对大黄酸在大鼠体内药物动力学的影响 [J]. 中药新药与临床药理, 2010, 21(3): 273-275.
[43] 韩刚, 康欣, 翟冠钰, 等. 甘草与大黄配伍对大黄酸在大鼠体内药动学的影响 [J]. 中国实验方剂学杂志, 2010, 16(9): 72-74.
[44] 王文永, 刘莉, 刘东新, 等. 调胃承气汤中大黄酸在大鼠体内的药动学研究 [J]. 中药药理与临床, 2011, 27(5): 8-10.
[45] 范敏. 基于大黄蒽醌类成分的胃肠道代谢、转运研究调胃承气汤中甘草配伍解毒的本质 [D]. 上海: 上海交通大学, 2017.
[46] Watanabe Y, Ikarashi N, Satoh T,. Inhibitory effects of daiokanzoto (da-Huang-Gan-Cao-Tang) on p-glycoprotein [J]., 2012, 2012: 361516.
[47] Hou Y C, Lin S P, Chao P D. Liquorice reduced cyclosporine bioavailability by activating P-glycoprotein and CYP 3A [J]., 2012, 135(4): 2307-2312.
[48] 史青. 大黄甘草汤中甘草对清醒大鼠结肠环肌运动的影响 [J]. 国外医学: 中医中药分册, 2003, 25(1): 38-39.
[49] Staumont G, Fioramonti J, Frexinos J,. Changes in colonic motility induced by sennosides in dogs: Evidence of a prostaglandin mediation [J]., 1988, 29(9): 1180-1187.
[50] 罗培, 徐象珍, 谭正怀. 大黄游离蒽醌致泻作用机制研究 [J]. 中药药理与临床, 2013, 29(3): 88-90.
[51] 占煜, 申旭龙, 徐红, 等. 大黄对洛哌丁胺便秘模型大鼠结肠水通道蛋白3表达及肠动力的作用研究 [J]. 中华中医药学刊, 2016, 34(10): 2315-2320.
[52] Yajima T, Inoue R, Matsumoto M,. Non-neuronal release of ACh plays a key role in secretory response to luminal propionate in rat colon [J]., 2011, 589(pt 4): 953-962.
[53] 赵燕玲, 张仲海, 王宗仁, 等. 大黄的泻下作用与肠道5-HT及其受体的关系 [J]. 云南中医学院学报, 2002, 25(1): 1-3.
[54] Mourad F H, Nassar C F. Effect of vasoactive intestinal polypeptide (VIP) antagonism on rat jejunal fluid and electrolyte secretion induced by cholera andenterotoxins [J]., 2000, 47(3): 382-386.
[55] 吴晓青, 胡昌江, 赵玲, 等. 生、熟大黄泻下作用及其机制研究 [J]. 中药材, 2014, 37(9): 1562-1565.
[56] 张燕, 李红岩. 便秘大鼠结肠超微结构的改变 [J]. 北京中医药大学学报, 2005, 28(2): 63-65.
[57] 寻庆英, 王翠芬, 魏义全, 等. 甘草对大鼠胃动力功能影响的实验研究 [J]. 东南大学学报: 医学版, 2005, 24(4): 226-229.
[58] Kon R, Yamamura M, Fujikawa T,. Laxative action of sennoside A, which causes decreased colonic aquaporin-3 expression, is controlled by the anti-inflammatory effect of glycyrrhizin [J]., 2018, 5(1): 45-50.
[59] 宁成, 徐秀蓉, 胡耀. 大黄总蒽醌对结肠和肾脏水通道蛋白表达调节效应研究 [J]. 亚太传统医药, 2015, 11(10): 16-17.
[60] Kon R, Ikarashi N, Nagoya C,. Rheinanthrone, a metabolite of sennoside A, triggers macrophage activation to decrease aquaporin-3 expression in the colon, causing the laxative effect of rhubarb extract [J]., 2014, 152(1): 190-200.
[61] 杜丽娟, 占煜, 吴至久, 等. 大黄对便秘大鼠肠动力及结肠水通道蛋白3表达的调节作用 [J]. 中华中医药学刊, 2017, 35(4): 873-875.
[62] 张文生, 李锋, 鲍军强, 等. 大黄蒽醌衍生物对大鼠结肠及LoVo细胞水通道蛋白4表达的调节效应 [J]. 中国中西医结合杂志, 2008, 28(9): 818-823.
[63] 吴迪. 大黄提取液对大鼠结肠粘液分泌的影响及机制研究 [D]. 北京: 首都医科大学, 2016.
[64] Dufour P, Gendre P. Ultrastructure of mouse intestinal mucosa and changes observed after long term anthraquinone administration [J]., 1984, 25(12): 1358-1363.
[65] Portincasa P, Calamita G. Phytocompounds modulating Aquaporins: Clinical benefits are anticipated [J]., 2019, 274: 642-650.
[66] Takayama K, Tabuchi N, Fukunaga M,. Rhein 8--β--glucopyranoside elicited the purgative action of daiokanzoto (da-Huang-Gan-Cao-Tang), despite dysbiosis by ampicillin [J]., 2016, 39(3): 378-383.
[67] Sorbara M T, Littmann E R, Fontana E,. Functional and genomic variation between human-derived isolates of Lachnospiraceae reveals inter- and intra-species diversity [J]., 2020, 28(1): 134-146.e4.
[68] 韦忠红. Sennoside A影响肠道微生物的组成平衡损伤结肠黏膜屏障促进结肠癌发展 [D]. 南京: 南京中医药大学, 2019.
[69] Takayama K, Matsui E, Kobayashi T,. High-performance liquid chromatographic determination and metabolic study of sennoside a in daiokanzoto by mouse intestinal bacteria [J]., 2011, 59(9): 1106-1109.
[70] 李远, 王伽伯, 陈玮娜, 等. 小鼠对大黄泻下作用产生耐受性与肠道蒽醌变化关系的量-时-效关系研究 [J]. 辽宁中医杂志, 2010, 37(12): 2444-2447.
[71] Chen J Y, Pan F, Zhang T,. Experimental study on the molecular mechanism of anthraquinone cathartics in inducing melanosis coli [J]., 2011, 17(7): 525-530.
[72] Tu C, Gao D, Li X F,. Inflammatory stress potentiates emodin-induced liver injury in rats [J]., 2015, 6: 233.
[73] Bahmani M, Rafieian-Kopaei M, Jeloudari M,. A review of the health effects and uses of drugs of plant licorice (L.) in Iran [J]., 2014, 4: S847-S849.
[74] 徐鑫, 孟柠, 俞毅君, 等. 大黄与甘草合用对肠功能衰竭大鼠炎性因子的影响研究 [J]. 中国全科医学, 2016, 19(15): 1824-1827.
Research progress onetalleviating drastic purgation ofet
ZHAO Qi, CHEN Yan-yan, XU Ding-qiao, YUE Shi-jun, ZHANG Qiao, FU Rui-jia, TANG Yu-ping
Key Laboratory of Shaanxi Administration of Traditional Chinese Medicine for TCM Compatibility, Shaanxi University of Chinese Medicine, Xianyang 712046, China
The theory of drug property is a central component of the theoretical system of traditional Chinese medicine (TCM), as well as an essential reference for guiding the clinical application of TCM and dissecting the action and mechanism of TCM.et(GRR),known as “prime minister”, plays a conciliatory role due to its moderate property.et(RRR) is well-known as “general” with significant purgation effect in TCM. However, the improper use will cause certain damage to the human body for its drastic purgation. GRR-RRR, as a classic purgation herb pair, has been practiced clinically for thousands of years. GRR can alleviate the drastic property of RRR with its powerful “harmony”, which not only alleviate the purgation of RRR, but also reduce its side effects. Based on the property theory of TCM, this paper elucidated the traditional understanding of GRR on alleviating drastic property of RRR. Furthermore, research progress on modern research of material basis, drug metabolism, intestinal motility, water metabolism, intestinal flora and immunoregulatory of the combination of RRR and GRR are summarized to provide scientific basis for the in-depth study of GRR alleviating the drastic purgation of RRR, as well as provide insights for the scientific connotation of “harmony” of GRR.
et;et; property of Chinese materia medica; compatibility; material basis; drug metabolism
R282.710.5
A
0253 - 2670(2021)07 - 2134 - 10
10.7501/j.issn.0253-2670.2021.07.030
2020-09-01
国家自然科学基金资助项目(81974525);2021年陕西省青年科技新星培育计划项目;2020年陕西高校青年创新团队;陕西中医药大学学科创新团队项目(2019-YL10)
赵 琦(1996—),女,硕士研究生,研究方向为中药配伍关系。Tel: (029)38185183 E-mail: zq15735641514@163.com
陈艳琰,副教授,主要从事中药配伍关系研究。E-mail: chenyanyan59@163.com
唐于平,教授,主要从事中药配伍效应与物质基础研究。E-mail: yupingtang@sntcm.edu.cn
[责任编辑 崔艳丽]

