中药有效成分调节线粒体保护骨关节炎软骨的研究进展
杨 波,周明旺,吉 星,李盛华*,肖 振,王 玉,胡星荣,苏耀辉,徐 斌,王 雷
中药有效成分调节线粒体保护骨关节炎软骨的研究进展
杨 波1,周明旺2,吉 星2,李盛华2*,肖 振1,王 玉1,胡星荣1,苏耀辉1,徐 斌1,王 雷1
1. 甘肃中医药大学,甘肃 兰州 730000 2. 甘肃省中医院,甘肃 兰州 730000
关节软骨退变在骨关节炎发病之初便出现,继而影响关节其他组织出现病理改变,关节软骨常被作为骨关节炎病理机制和药物治疗机制研究的组织之一。关节软骨退变与线粒体形态结构和功能障碍相关,所以在预防软骨退变中保护线粒体的形态和功能成为一个新的研究方向。中药在骨关节炎治疗中有着悠久的历史,针对中药有效成分能调节线粒体,进而延缓关节软骨退变的作用机制已开展了相关研究。将中药有效成分(黄酮类、多酚类、生物碱类、皂苷类等)调节线粒体延缓关节软骨退变的分子机制关系进行综述,为骨关节炎关节软骨退变的防治提出新的目标。
中药有效成分;黄酮类;多酚类;生物碱类;皂苷类;骨关节炎;软骨;线粒体
骨关节炎是关节组织损伤和修复之间不平衡导致的一种不可逆的退行性病变。骨关节炎发病之初,关节软骨退变引起软骨基质降解,从而分泌促炎介质而影响滑膜、软骨下骨等组织,最终导致关节组织结构破坏,引起患者的关节周围疼痛和活动受限[1]。保护关节软骨对于预防和延缓骨关节炎疾病进程具有重要的意义。
骨关节炎关节软骨退变与线粒体相关[2-3],线粒体作为唯一具有自身DNA的细胞器,是细胞内能量产生、信号传导、细胞内稳态和细胞死亡方式多层面的调节因子[4-5]。人骨关节炎软骨细胞中线粒体呼吸链功能障碍引起线粒体结构和形态的改变,继而使软骨细胞内三磷酸腺苷(adenosine triphosphate,ATP)生成减少,影响软骨细胞正常的生理活动,分泌Ⅱ型胶原的能力下降,从而促进软骨退变;线粒体产生活性氧增多,线粒体抗氧化酶水平降低,细胞内氧化应激增强,线粒体DNA(mitochondrial DNA,mtDNA)持续损伤,诱导基质金属蛋白酶(matrix metalloproteinase,MMP)释放,降解软骨细胞外基质(extracellular matrix,ECM);促使炎性因子的释放,促进软骨ECM的降解;线粒体膜电位(mitochondrial membrane potential,Δφm)下降,膜通透性增加,向细胞质内释放细胞色素C(cytochrome C,Cyt C),引起细胞凋亡的发生[3,6-11]。而在线粒体呼吸链功能障碍后,线粒体分裂和融合的平衡对于维持线粒体结构和形态及线粒体稳态,防止线粒体的损伤和氧化应激的增加及促进软骨细胞的存活具有重要桥接作用[12],通过激活线粒体自噬通路蛋白,如磷酸腺苷活化蛋白激酶(adenosine phosphate activated protein kinases,AMPK)、sirtuin 1(SIRT 1)和sirtuin 3(SIRT 3)蛋白等,将线粒体分裂相关蛋白线粒体动力蛋白1(dynamin-relatedprotein 1,DRP1)和线粒体分裂蛋白1(mitochondrial fission protein 1,FIS1)定位于受损线粒体,分离受损线粒体,并通过线粒体自噬清除,减少活性氧产生,增加ATP合成,保障了线粒体的质量控制,减少了软骨细胞的凋亡[12-14]。人骨关节炎软骨细胞的线粒体生物合成能力不足,不仅降低骨关节炎软骨细胞的线粒体的质量控制和功能,而且可能增加软骨细胞的分解代谢前反应。所以,通过上调线粒体生物合成主要调节因子过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)、促进转录因子核呼吸因子1(nuclear respiratory factor 1,NRF-1)、核呼吸因子2(nuclear respiratory factor 2,NRF-2)表达增加,上调线粒体转录因子A(transcription factor A,mitochondrial,TFAM),增加mtDNA的转录和复制,保持mtDNA的完整性。此外,通过上调线粒体融合蛋白2,促进线粒体融合,提高了线粒体的质量控制,减少活性氧产生,增加ATP合成,减少软骨细胞的凋亡[15-20],而AMPK、SIRT-1、SIRT-3和PGC1-α调节软骨退变中线粒体自噬和线粒体生物合成[13]。所以在线粒体呼吸链功能障碍后线粒体的分裂和融合、自噬、生物合成3者相互协调对于调节线粒体稳态和质量控制,促进线粒体功能正常,减少软骨细胞凋亡具有重要的作用,骨关节炎软骨凋亡与线粒体的关系见图1。

“+”表示增加,“−”表示减少,“→”表示促进,“┤”表示抑制,下图同
目前,最新骨关节炎指南推荐的高级别证据治疗药物为非甾体类抗炎药[21],但患者服用后易发生不良反应。Ramachandran等[22]发现非甾体类抗炎药中对乙酰氨基酚使肝细胞线粒体功能障碍成为其诱导肝细胞死亡的关键。而近年来,中药治疗骨关节炎取得了一定进展,在相关的荟萃分析中发现,中药可改善膝骨关节炎患者的疼痛和关节活动度[23],且不良反应发生率低于西药组[24]。此外,单味中药如乳香[25]、姜黄[26]、虎杖[27]中的有效成分可缓解骨关节炎的临床症状。本文通过检索中药有效成分调节线粒体治疗骨关节炎文献,将文献中中药有效成分进行分类(黄酮类、多酚类、生物碱类、皂苷类、其他类),对单味中药有效成分调节线粒体延缓骨关节炎关节软骨退变的研究进展进行归纳与总结,以便明确其作用机制,并从中发现新的思路和目标。中药有效成分调节线粒体质量控制延缓关节软骨退变的信号通路见图2,调节线粒体抑制关节软骨凋亡发生的信号通路见图3。
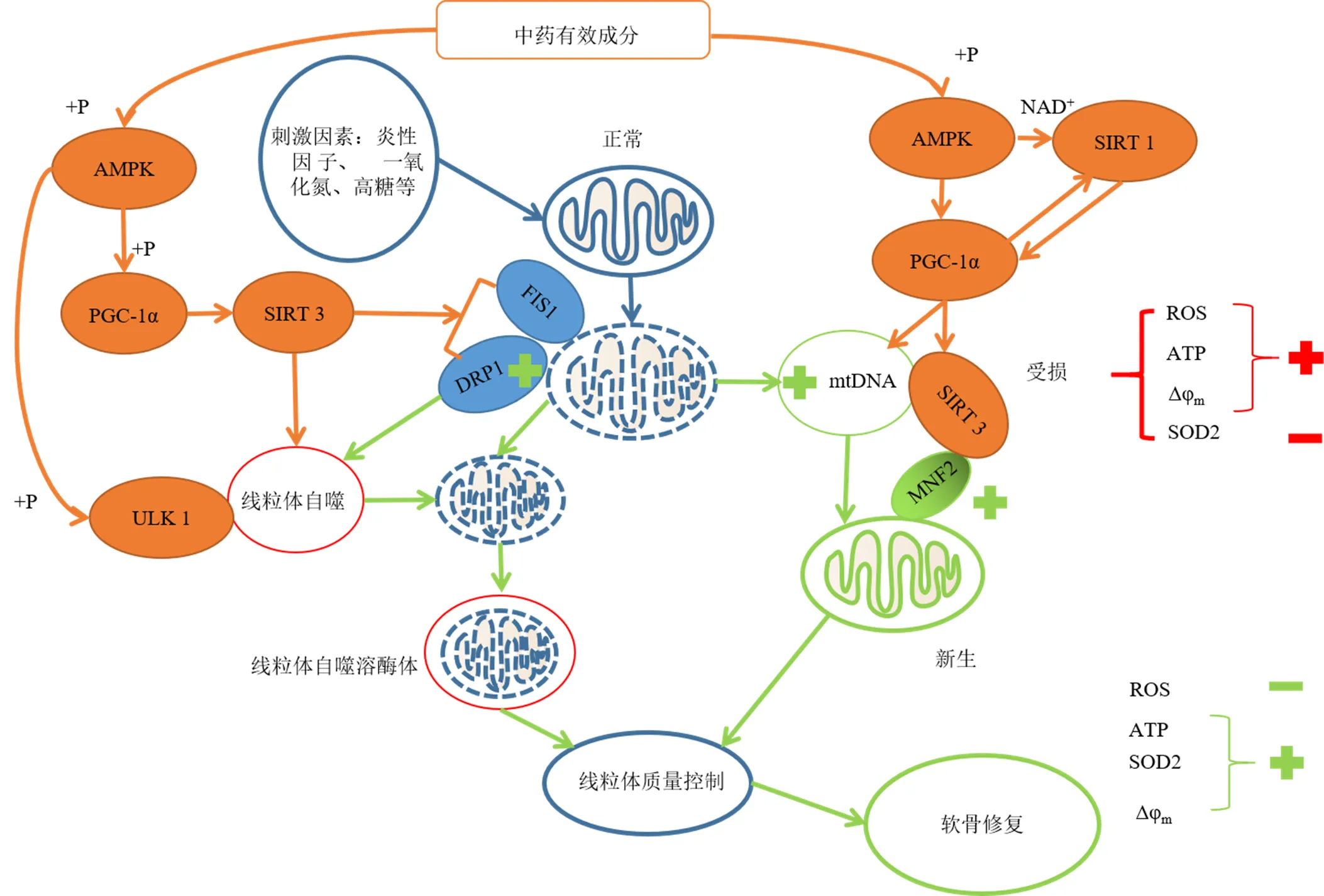
图2 中药有效成分调节线粒体质量控制延缓关节软骨退变的信号通路
1 黄酮类
1.1 葛根素
葛根素主要来源于豆科植物野葛(Wild.) Ohwi的干燥根茎或甘葛藤Benth.根中提取的异黄酮化合物[28-29],化学结构见图4。骨关节炎关节软骨退变的延缓可通过调节线粒体生物合成来达到[19]。葛根素可调节线粒体稳态来预防高脂高糖饮食诱导的非酒精性脂肪肝[30],上调线粒体生物发生改善糖尿病大鼠肌肉中的线粒体功能[31]。在骨关节炎中,0、25、50、100 nmol/L葛根素培养软骨细胞24 h,发现均可促进细胞增殖,且50 nmol/L葛根素的促进效果最好,可以显著减少小鼠骨关节炎模型中关节炎症和软骨的退变[32]。此外,葛根素可激活AMPK-PGC-1α信号通路上调磷酸化AMPK(p-AMPK)和SIRT 1水平[33],使PGC-1α的表达上调,乙酰化水平降低,上调转录因子NRF-1、NRF-2表达,使TFAM表达上调,增加mtDNA复制和转录,线粒体的生物合成和线粒体呼吸链复合物Ⅰ~Ⅳ的表达增多,ATP的生成增多,从而减少了软骨细胞的损伤。
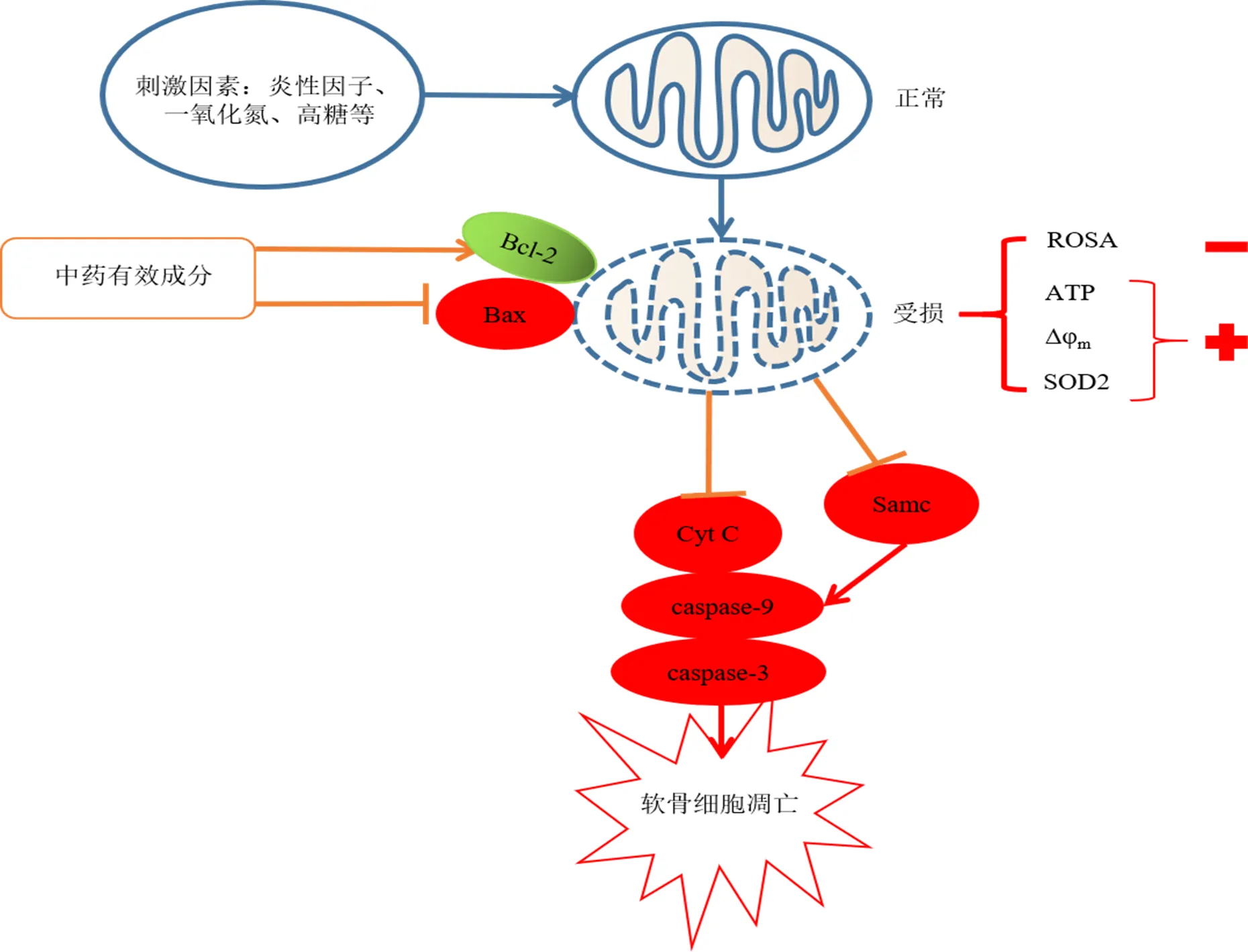
图3 中药有效成分调节线粒体抑制关节软骨凋亡发生信号通路
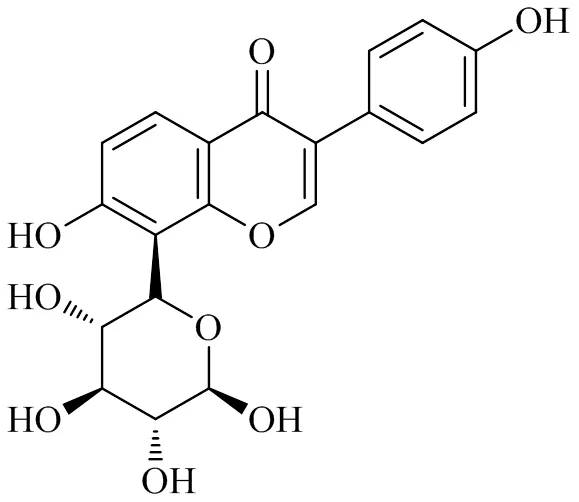
图4 葛根素的化学结构
1.2 槲皮素
槲皮素是一种天然黄酮类化合物[34],广泛存在与水果和蔬菜中,如洋葱、苹果[35],具有抗炎和抗氧化作用[36-37],化学结构见图5。骨关节炎中关节软骨细胞中线粒体生物合成促进线粒体功能的修复,减少软骨基质的降解[3,19]。槲皮素通过调节线粒体Δφm、ATP合成代谢、线粒体生物合成,使线粒体内的氧化还原状态处于平衡状态,减少对细胞的损伤[38]。同时,槲皮素上调超氧化物歧化酶(superoxidedismutase,SOD)和金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase 1,TIMP-1),下调基质金属蛋白酶-13(matrix metalloproteinase 13,MMP-13),减弱氧化应激状态,抑制软骨ECM的降解来改善骨关节炎软骨退变[39]。

图5 槲皮素的化学结构
25 μmol/L槲皮素作用大鼠软骨细胞24、48、72 h,无明显细胞毒性,且细胞活力较高,通过SIRT1-AMPK通路抑制软骨细胞内质网氧化应激,减少软骨细胞凋亡的发生[40]。此外,在大鼠骨关节炎模型中,槲皮素可激活AMPK-SIRT1通路增加了软骨细胞中线粒体生物合成主要调节因子PGC-1α表达[41],使线粒体生物合成过程中主要转录因子NRF-1、NRF-2和TFAM表达增多,mtDNA拷贝数增加,维持了线粒体内稳态,减轻了氧化应激下线粒体功能障碍,增强了线粒体氧化磷酸化能力,使线粒体Δφm升高,增加耗氧量和ATP产生,减少线粒体活性氧产生引起抗氧化系统失衡和氧化应激[42],恢复了抗氧化酶谷胱甘肽(glutathione,GSH)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)水平,从而为降低大鼠骨关节炎模型中MMP-3和MMP-13的水平和减少软骨退变提供一个稳定的内环境。
1.3 二氢杨梅素
二氢杨梅素(图6)广泛存在于葡萄科蛇葡萄属植物显齿蛇葡萄(Hand.-Mazz.) W. T. Wang中,并可从藤茶中分离出来,具有抗氧化、抗炎作用[43]。AMPK、PGC-1α、SIRT3调节骨关节炎软骨细胞中线粒体自噬发生,延缓关节软骨ECM降解[13]。
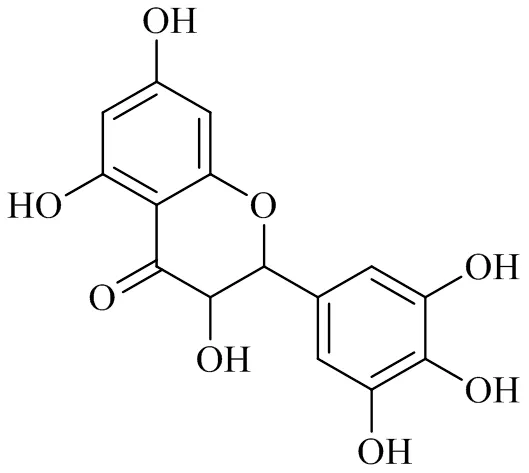
图6 二氢杨梅素的化学结构
二氢杨梅素是线粒体脱乙酰基酶SIRT3激动剂[44],SIRT3可介导线粒体的自噬上调促进线粒体融合,抑制线粒体分裂,从而提高线粒体质量,减少了软骨细胞的凋亡[45],而SIRT3则受PGC-1α调节[46],p-AMPK调节PGC-1α表达[47]。二氢杨梅素在刺激原代关节软骨细胞24 h后发现,二氢杨梅素浓度小于200 µmol/L时对软骨细胞没有细胞毒性,在此浓度范围内可通过AMPK-PGC-1α-SIRT3通路增强肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)诱导的炎症环境下大鼠软骨细胞中SIRT3表达,促进线粒体锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)在乙酰化位点K68处的去乙酰化,增强MnSOD表达,发挥抗氧化作用,调节炎性环境中线粒体融合和分裂的失衡,上调线粒体分裂相关蛋白DRP1、FIS1水平,促进线粒体自噬受体蛋白Nix和Bcl-2结合蛋白蛋白3(Bcl-2 interacting protein 3,BNIP3)上调,通过线粒体自噬清除在炎性环境下受损的线粒体,通过线粒体融合蛋白2(mitochondrial fusion related protein mitofusin 2,MFN2)表达增多、保持线粒体内的稳态,最终上调合成代谢蛋白多聚蛋白多糖和Ⅱ型胶原蛋白的水平,下调分解代谢标记物MMP-13和含血小板结合蛋白基序的解聚蛋白样金属蛋白酶-5(a disintegrin and metalloprotease with thrombospondin motifs-5,ADAMTS-5)表达,延缓了软骨的退变[48]。
黄酮类中药有效成分对线粒体及相关通路和软骨退变的影响见表1。

表1 黄酮类中药有效成分对线粒体及相关通路和软骨退变的影响
2 多酚类
2.1 白藜芦醇
白藜芦醇是一种天然多酚化合物,化学结构见图7,20世纪70年代首次发现在葡萄属植物中,广泛存在于多种天然植物中,可从来源于34科69属100种植物的根、茎、叶、花、果实和种子中提取得到,毛茛科芍药属紫斑牡丹种子中含量最高,达870.0 μg/g,虎杖根中质量分数为420.9 μg/g[49],具有抗炎、免疫调节和抗氧化的作用[50-51]。

图7 白藜芦醇的化学结构
研究发现,在骨关节炎软骨细胞中,线粒体是促炎细胞因子毒性的重要靶点,炎性因子使线粒体功能障碍,活性氧生成增多,ATP生成减少,mtDNA持续损伤,氧化应激增强,线粒体的生物合成减少,加速了软骨细胞的退变[15-16,52]。反之,线粒体功能障碍会诱导促炎性因子的释放和募集,加速了软骨细胞凋亡的发生[11]。50 µmol/L白藜芦醇可显著降低10 ng/mL白细胞介素(interleukin,IL)-1β引起的人原代关节软骨细胞毒性[53],也可抑制人原代软骨细胞中线粒体呼吸链功能障碍引起的活性氧的产生和核因子-κB(nuclear factor kappa-B,NF-κB)的激活导致炎性因子诱导的IL-8、环氧化酶-2(cyclooxygenase-2,COX-2)和前列腺素E2(prostaglandin E2,PGE2)表达增多,减少人软骨细胞线粒体肿胀和凋亡发生[10,27],使因炎性因子表达增多导致的促软骨ECM分解代谢和合成代谢之间的关系趋于平衡,延缓关节软骨退变[54-55]。白藜芦醇阻断了骨关节炎软骨和IL-1β诱导人正常人软骨细胞线粒体膜去极化,线粒体质量下降和ATP消耗,减少活性氧的产生,抑制了凋亡途径caspase-3活化及对DNA修复酶多聚二磷酸腺苷核糖聚合酶的切割,对软骨细胞具有抗凋亡作用[56]。总之,白藜芦醇可通过对线粒体形态和功能的调节,减少软骨细胞内炎性刺激,活性氧生成,增加ATP生成,起到减少软骨细胞凋亡的作用。
2.2 姜黄素
姜黄素(图8)是姜科植物姜黄L.根茎中提取的一种多酚化合物,具有抗炎、抗氧化作用[57-58]。骨关节炎关节软骨中线粒体形态和结构异常,进而导致线粒体功能障碍,引起细胞内氧化应激增加,线粒体抗氧化酶活性降低[3,46]。研究表明,姜黄素能够保护线粒体结构稳定,减少因线粒体结构异常导致的功能障碍而引起细胞凋亡的发生[59]。此外,在姜黄素治疗骨关节炎的相关荟萃分析中发现,口服姜黄素在缓解疼痛、改善功能、提高生活质量方面均有益处,且服药后不良事件发生率低于非甾体类抗炎药[60-61]。20 μmol/L姜黄素对大鼠原代软骨干预24、48、72 h未发现明显细胞毒性,并可延缓氧化应激下大鼠骨关节炎进展[62]。

图8 姜黄素的化学结构
Liu等[3]发现骨关节炎中线粒体形态缺陷与线粒体呼吸链复合物酶活性降低有关,线粒体呼吸链抑制剂鱼藤酮加重了骨关节炎软骨细胞的凋亡和线粒体形态和功能的改变。姜黄素可改善线粒体肿胀,外膜电子密度不均匀,嵴的排列紊乱或消失,嵴数目减少的情况,恢复线粒体Δφm,缓解鱼藤酮诱导的线粒体损伤和功能障碍引起的氧化应激反应,增加病理状态下软骨基质的修复,Ⅱ型胶原浓度升高,降低细胞凋亡的发生,对骨关节炎软骨具有保护作用。李旭升等[63]发现姜黄素可通过JAK2-STAT3信号通路,提高C57BL/6J小鼠骨关节炎模型中提取的软骨细胞中线粒体琥珀酸脱氢酶(succinate dehydrogenase,SDH)、Cyt C氧化酶(cytochrome coxidase,COX)表达水平,提高了线粒体抗氧化应激能力,减少了软骨细胞凋亡的发生。
2.3 苹果多酚
苹果多酚是是蔷薇科苹果亚科苹果属Mill.中提取的多酚化合物,具有抗氧化、保护线粒体功能的作用[64-66]。《名医别录》中提出苹果具有药用价值。
在骨关节炎中,SOD2缺失引起线粒体膜电位下降而损害软骨细胞基质稳态,造成合成代谢基因(包括、和)被显著下调,而分解代谢基因(包括、、)被显著上调[6],线粒生物合成减少也会引起线粒体功能障碍和软骨退变[19]。Masuda等[67]发现,在SOD2敲除的C57BL/6NCrSlc小鼠中提取的原代软骨细胞中,10~100 μg/mL苹果多酚对原代软骨细胞无毒性,且显著增加了线粒体脱氢酶活性、线粒体生物合成调节因子PGC-1α上调,mtDNA的拷贝数增加,改善了因SOD2缺失而引起的线粒体去极化,上调了线粒体Δφm。此外,苹果多酚还通过影响线粒体超氧化物基因表达增加,刺激线粒体生物合成。苹果多酚通过对线粒体的调节,使软骨合成代谢基因表达上调,下调了分解代谢基因和表达,促进原代软骨细胞中蛋白聚糖的合成,表明苹果多酚可保护由软骨细胞线粒体功能障碍引起的软骨变性。
多酚类中药有效成分对线粒体及相关通路和软骨退变的影响见表2。

表2 多酚类中药有效成分对线粒体及相关通路和软骨退变的影响
3 生物碱类
3.1 川芎嗪
川芎嗪(图9)是伞形科藁本属植物川芎Hort.根茎中的活性成分,属生物碱类[68]。川芎嗪可减轻关节软骨退变,抑制软骨细胞凋亡的发生[69-70]。凋亡的线粒体途径影响骨关节炎关节软骨退变[71]。川芎嗪可通过激活凋亡的线粒体途径抑制癌细胞增殖[72]。而洪昆达[73]发现,50 μg/L川芎嗪干预第3代兔原代软骨细胞72 h可增强软骨细胞活性,可下调硝普钠诱导的兔原代软骨细胞中与线粒体相关的促凋亡因子基因及蛋白表达、上调抗调亡因子基因及蛋白表达,抑制caspase-9、caspase-3的激活,抑制了凋亡的线粒体途径的激活,提高软骨细胞活性,降低软骨细胞凋亡率及软骨细胞凋亡的超微结构的改变。

图9 川芎嗪的化学结构
3.2 甲基莲心碱
甲基莲心碱(图10)是从睡莲科莲属植物中提取的有效成分,属生物碱类[74]。炎性因子调节关节软骨线粒体活性,诱导与凋亡的线粒体途径标志物表达[50]。甲基莲心碱可以保护线粒体形态和膜电位稳定来预防缺血性脑卒中的发生[75],也可以通过凋亡的线粒体途径增强顺铂的抗肿瘤作用。在骨关节炎中,甲基莲心碱通过抑制IL-1β诱导的大鼠软骨细胞炎性和分解代谢因子的过量产生,减少软骨ECM的降解[76]。张宇标等[77]研究发现,在TNF-α诱导的SD大鼠原代软骨细胞凋亡中,10 µmol/L甲基莲心碱对原代软骨细胞无毒性,且恢复了线粒体膜电位水平,使线粒体通透性转换孔开放率降低。同时,降低了凋亡的线粒体途径相关的促凋亡因子基因及蛋白表达、上调抗调亡因子基因及蛋白表达,抑制caspase-9、caspase-3的激活,通过抑制凋亡的线粒体途径抑制了软骨细胞的凋亡和退变。

图10 甲基莲心碱的化学结构
3.3 马钱子碱
马钱子碱(图11)是马钱科植物马钱L.的干燥成熟种子中的主要成分,同时也是其主要毒性成分,属生物碱类[78]。骨关节炎中软骨细胞凋亡与凋亡的线粒体途径相关[71]。在骨关节炎治疗中,0.5、0.125 mg/L马钱子碱抑制体外培养48 h后人软骨细胞的增殖,而0.25 mg/L马钱子碱促进软骨细胞增殖,抑制一氧化氮对软骨细胞的损伤[79]。马钱子碱也可调节线粒体活性达到抗肿瘤作用[80],高萌萌[81]通过对硝普钠诱导的SD大鼠原代软骨细胞的凋亡的研究中发现,马钱子碱在250~500 mg/L,随着剂量的增大,可明显抑制软骨细胞中线粒体释放Cyt C和线粒体中促caspases活化的激活蛋白Smac释放受到细胞质中,通过凋亡的线粒体途径降低了软骨细胞的凋亡率。
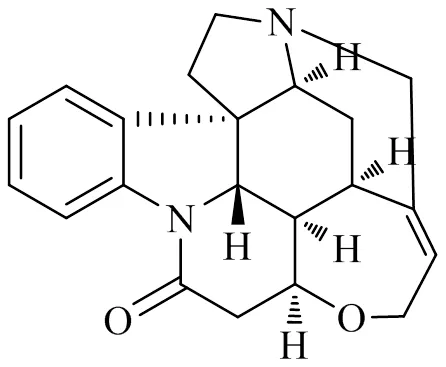
图11 马钱子碱的化学结构
生物碱类中药有效成分对线粒体及相关通路和软骨退变的影响见表3。
4 皂苷类
4.1 人参皂苷
人参皂苷(图12)是五加科(Araliaceae)人参属植物人参C. A. Meyer干燥根中的主要有效成分[82]。骨关节炎中软骨细胞凋亡与线粒体形态结构异常和凋亡的线粒体途径相关[3,71]。人参皂苷Rb1、Rg1可抑制促炎细胞因子的产生并调节炎症相关信号通路的活性[83-84],人参皂苷Rb1通过提高线粒体膜电位的并抑制凋亡诱导因子(apoptosis-inducing factor,AIF)和Cyt C释放或抑制线粒体通透性过渡孔的开放减少细胞凋亡的发生[85-86],人参皂苷Rg1通过抑制线粒体损伤,保持线粒体外膜的完整性,阻止Cyt C移位进入胞浆,阻断凋亡的线粒体通路,达到保护神经元细胞的目的[87]。

表3 生物碱类中药有效成分对线粒体及相关通路和软骨退变的影响
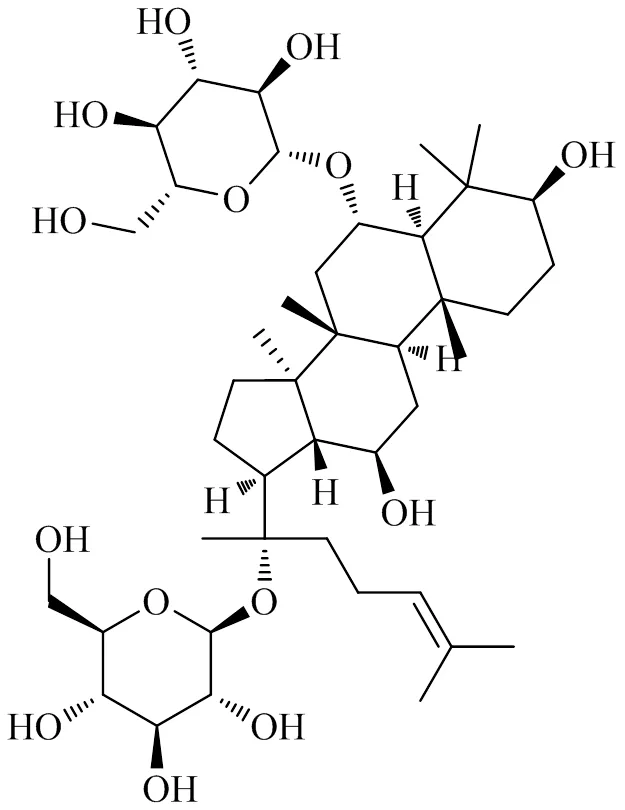
图12 人参皂苷的化学结构
在骨关节炎中,人参皂苷Rg1和Rb1对于延缓骨关节炎关节软骨退变具有一定的作用[88-89]。研究发现,0.001、0.01、0.1、1、10、100 μg/mL人参皂苷Rg1培养大鼠原代软骨细胞72 h,未发现细胞毒性作用,10 μg/mL人参皂苷Rg1可激活磷脂酰肌醇- 3-激酶-蛋白激酶B(phosphatidylinositide 3-kinases-protein kinase B,PI3K-Akt)通路,使IL-1β诱导的SD大鼠软骨细胞中线粒体凋亡标志物Bcl-2/Bax比值增加,抑制Cyt C从线粒体向细胞内释放,降低凋亡蛋白caspase-3的活性,表明人参皂苷Rg1可能降低软骨细胞线粒体通透性,通过抑制凋亡的线粒体途径,上调TIMP-1表达,抑制MMP-13合成,减少软骨细胞凋亡的发生[90]。此外,0~400 µmol/L人参皂苷Rb1干预原代软骨细胞24 h,未发现明显毒性,100 µmol/L人参皂苷Rb1可增强过氧化氢(hydrogen peroxide,H2O2)诱导的SD大鼠软骨细胞凋亡中线粒体的活性,抑制线粒体通透性转换孔的开放和促凋亡蛋白caspase-3活性,保护软骨细胞免受H2O2诱导的凋亡发生[91]。
4.2 齐墩果酸
齐墩果酸(图13)是广泛存在于各种植物中的1种五环三萜类化合物,如女贞子W. T. Aiton、夏枯草L.、山楂Bge.等,具有抗氧化、抗炎作用[92-94]。线粒体功能障碍可促进软骨细胞中炎性因子表达和ECM降解,促使骨关节炎的发生[8,10]。

图13 齐墩果酸的化学结构
齐墩果酸具有上调线粒体膜电位和血清中抗氧化酶水平,抑制凋亡的线粒体途径[95-97]。在骨关节炎关节软骨的退变的防治中,齐墩果酸的半最大效应浓度值为10.93 μmol/L,在此浓度下可抑制软骨ECM的降解和细胞凋亡的发生[98]。此外,齐墩果酸可激活PPARγ-SOD2通路,上调线粒体SOD2,抑制了C57BL/6J小鼠原代细胞在高糖刺激下线粒体膜电位的下降,促进ATP的产生,使凋亡蛋白caspase-9表达下降[99]。齐墩果酸可使Ⅱ型胶原的表达上调,MMP-13表达下降,下调作为另一种胶原酶的炎性细胞因子PGE2、IL-6的表达[100],减少了软骨ECM的降解和细胞凋亡。
4.3 威灵仙中富含的皂苷成分
威灵仙Osbeck.是毛茛科(Ranunculaceae)铁线莲属植物[101]。骨关节炎中线粒体膜电位下降,导致软骨细胞凋亡增多[3]。50、100、200 mg/kg威灵仙中富含皂苷的有效成分可改善碘乙酸单钠诱导的大鼠骨关节炎的关节破坏和软骨侵蚀,并且通过防止ECM降解和软骨细胞损伤来保护关节软骨[102]。研究发现,300、1000 μg/mL威灵仙中富含皂苷的有效成分则显著逆转了硝普钠诱导兔软骨细胞的凋亡,逆转了线粒体膜电位下降,凋亡蛋白caspase-3活性受到抑制,逆转了硝普钠刺激下软细胞凋亡形态的改变,软骨细胞的凋亡率下降[103]。
4.4 薯蓣皂苷元
薯蓣皂苷元(图14)属于薯蓣科薯蓣属植物中的有效成分,全球有多达9个属650个品种的薯蓣科植物,薯蓣属品种多达600种。盾叶薯蓣C. H. Wright作为其中之一,是目前所知薯蓣皂苷元含量最高的品种[104-105]。骨关节炎关节软骨退变与线粒体抗氧化酶活性降低,细胞内氧化应激增加相关[48]。10~100 μg/mL薯蓣皂苷元对人骨关节炎软骨细胞没有细胞毒性作用,抑制了软骨细胞ECM的降解[106]。刘军等[107-108]发现薯蓣皂苷元可通过JAK2-STAT3或SIRT1信号通路,提高C57BL/6J小鼠骨关节炎模型中提取的软骨细胞中线粒体抗氧化酶SDH、COX、SOD的表达水平,增强了线粒体抗氧化应激能力,维持软骨细胞正常形态,减少软骨细胞凋亡发生。
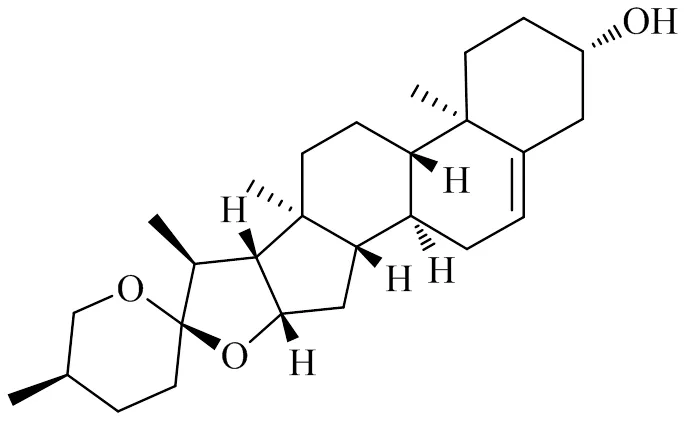
图14 薯蓣皂苷元的化学结构
皂苷类中药有效成分对线粒体及相关通路和软骨退变的影响见表4。

表4 皂苷类中药有效成分对线粒体及相关通路和软骨退变的影响
5 其他
5.1 二烯丙基二硫化物
二烯丙基二硫化物(图15)是衍生自百合科(Liliaceae)葱属L.植物大蒜L.的鳞茎部的化合物,主要为油溶性有机硫成分[109]。炎性因子调节关节软骨细胞凋亡的线粒体途径标志物表达[52]。二烯丙基二硫化物可以通过抑制凋亡的线粒体途径改善心功能障碍[110]。在骨关节炎中,二烯丙基二硫化物可减少软骨基质降解[111]。1、5、10、25 µmol/L二烯丙基二硫化物干预人软骨C28I2细胞24 h后未发现细胞毒作用,1、5、10 µmol/L二烯丙基二硫化物干预C28I2细胞24 h后细胞活力高于98%。所以,在C28I细胞中加入IL-1β后,1、5、10 µmol/L二烯丙基二硫化物降低了活性氧的生成,降低了凋亡的线粒体途径标志物Bax/Bcl-2的值,抑制了caspase-3的激活。通过抑制凋亡的线粒体途径减少了细胞凋亡的发生,提升了细胞的活力[112]。

图15 二烯丙基二硫化物的化学结构
5.2 海藻糖
海藻糖(图16)是一种非还原性二糖,存在于许多生物中,包括细菌、真菌、植物和无脊椎动物[113]。在骨关节炎中,凋亡发生的同时伴有线粒体自噬的发生,激活线粒体自噬可清除受损线粒体,恢复线粒体功能障碍,促进ATP产生,减少氧化应激引起的细胞凋亡[114]。已有研究表明,海藻糖具有诱导自噬的发生和抗氧化的作用[115],可激活线粒自噬,清除受损的线粒体,恢复线粒体膜电位及ATP的生成,减少自噬降解蛋白p62的积累,恢复自噬通量,激活自噬和凋亡的线粒体途径从而减少细胞凋亡的发生[116-117]。

图16 海藻糖的化学结构
在海藻糖干预人骨关节炎软骨细胞的体外研究中发现,海藻糖对软骨细胞凋亡的保护作用与线粒体功能障碍的减轻和诱导线粒体自噬的发生有关[118]。0~100 mmol/L海藻糖对人软骨细胞无明显毒性,且细胞活力较高,100 mmol/L海藻糖可激活AMPK-ULK1途径,抑制线粒体功能障碍标志物Cyt C的表达,使线体膜电位下降受到抑制,ATP、SOD2生成增多。抑制线粒体分裂蛋白Drp-1向线粒体易位与线粒体标记蛋白Tom20共定位,诱导线粒体分裂,通过降低自噬通量相关蛋白p62水平,增强自噬通量,使自噬相关蛋白LC3与线粒体标记蛋白Tom20共定位,上调线粒体自噬受体BNIP3、与LC3有高亲和力的线粒体局部磷酸酶PGAM5水平,诱导线粒体自噬发生,清除受损线粒体,保护了线粒体的功能。抑制氧化应激诱导的软骨细胞凋亡,调节了凋亡线粒体途径相关标志物的表达,下调了Bax、Cyt C的表达,上调了Bcl-2的表达。
5.3 锯齿马尾藻乙醇提取物
锯齿马尾藻C. Agardh是一种具有药食同源的马尾藻属类海洋植物[119]。骨关节炎软骨的凋亡与线粒体膜电位下降,通透性增加,凋亡的线粒体途径标志物Bax/Bcl-2值改变相关[120]。研究发现,锯齿马尾藻乙醇提取物具有抗氧化作用[121],可以抑制MMP-1、MMP-3和MMP-13的表达[122],保护氧化应激下软骨的退变,可用于骨关节炎的预防和治疗[123]。
400 μg/mL锯齿马尾藻乙醇提取物未对人SW1353软骨细胞产生细胞毒性,可激活调节细胞内氧化稳态、线粒体活性、与骨关节炎相关Nrf2-HO-1通路,逆转了线粒体功能障碍和细胞凋亡的线粒体途径的激活,保护了关节软骨的损伤[124-129]。400 μg/mL锯齿马尾藻乙醇提取物使H2O2诱导的氧化应激下凋亡的SW1353软骨细胞中线粒体膜电位下降,活性氧生成减少,线粒体膜通透性降低,凋亡的线粒体途径相关蛋白Bax/Bcl-2值增加,有助于线粒体生物合成和抗细胞凋亡细胞的pro-caspase-3的表达明显上调,使凋亡的细胞形态典型特征染色质浓缩和DNA断裂减少,减少了软骨细胞凋亡的发生[130-131]。
5.4 生姜提取物
生姜是姜科植物姜Rosc.的根茎[132],可抑制细胞凋亡的线粒体途径[133]。骨关节炎关节软骨细胞在炎性刺激下发生凋亡的同时伴有凋亡的线粒体途径标志物Bax/Bcl-2值增加[120]。在一项荟萃分析中发现,生姜骨关节炎的治疗适度有效且相当安全[134],实验研究发现,0.01、0.5、1、5、10、25、50、100 μg/mL生姜提取物对C28I2软骨细胞无毒性,5、25 μg/mL生姜提取物能减少活性氧的产生,上调抗氧化酶、、和的基因表达,减少氧化应激下凋亡的线粒体途径标志物Bax/Bcl-2值降低,抑制了caspase-3激活,使凋亡的线粒体途径信号受到抑制,减少IL-1β刺激下人C28I2软骨细胞凋亡的发生[135]。
其他类中药有效成分对线粒体及相关通路和软骨退变的影响见表5。
6 结语
目前,针对骨关节炎的治疗提倡早期预防关节软骨退变,可延缓疾病的进程和提高患者生活质量。选用合适的药物受到了广泛的关注,中药作为传统治疗药物,在骨关节炎治疗中拥有巨大的潜力[136],依据现有研究可以发现,中药中黄酮类、多酚类、生物碱类、皂苷类、其他类中的二烯丙基二硫化物等,可通过AMPK、PGC-1α、SIRT 3、SIRT 1、ULK1、PI3K、Akt、Nrf2、HO-1、JAK2、STAT 3等蛋白组成的通路调节线粒体形态和功能,延缓软骨细胞凋亡,通过凋亡的外在途径或线粒体途径延缓软骨退变。其中,黄酮类可调节AMPK、PGC-1α、SIRT 3、SIRT 1信号通路,调节线粒体基本功能,减少活性氧生成和增加ATP生成,激活软骨细胞线粒体生物合成和线粒体自噬,达到软骨细胞内线粒体的质量控制,通过调节线粒体稳态来促进细胞内稳态的目标。多酚类、生物碱类、皂苷类、其他类中的有效成分也通过不同途径,改善了线粒体形态结构,调节了线粒体的基本功能、生物合成和自噬,通过凋亡的外源性途径及内在的线粒体途径调节了延缓了软骨细胞的退变。目前所进行的相关研究只是探讨了部分中药有效成分对对线粒体基本功能和活性的调节对延缓软骨退变的作用。但是,不同中药有效成分对线粒体的调节方向有不同点和相同点,这是否与中药的功效或四气五味相关,在今后值得深入探究其中的关系。此外,中药的种类、中药复方、经方、验方是多种多样的,其中的有效成分也是多种多样的,具有多靶点、多途径的特点。细胞活性和生理功能的正常维持是靠细胞内外多条信号通路之间相互协作达到的。针对中药调节线粒体延缓骨关节炎软骨退变的机制还需要更深入的探讨,不仅需要发现更多的可以用来调节线粒体和骨关节炎的中药及复方,还要通过不同技术手段、不同信号转导途径探究中药在调节线粒体延缓关节软骨退变的作用机制,使中药的活性成分被充分的挖掘,为提供新药研发和促进中药现代化研究提供坚实的平台,造福于全人类。

表5 其他类中药有效成分对线粒体及相关通路和软骨退变的影响
利益冲突 所有作者均声明不存在利益冲突
[1] Barnett R. Osteoarthritis [J]., 2018, 391(10134): 1985.
[2] Rego-Pérez I, Durán-Sotuela A, Ramos-Louro P,. Mitochondrial genetics and epigenetics in osteoarthritis [J]., 2019, 10: 1335.
[3] Liu H, Li Z Y, Cao Y P,. Effect of chondrocyte mitochondrial dysfunction on cartilage degeneration: A possible pathway for osteoarthritis pathology at the subcellular level [J]., 2019, 20(4): 3308-3316.
[4] Bock F J, Tait S W G. Mitochondria as multifaceted regulators of cell death [J]., 2020, 21(2): 85-100.
[5] Nunnari J, Suomalainen A. Mitochondria: In sickness and in health [J]., 2012, 148(6): 1145-1159.
[6] Koike M, Nojiri H, Ozawa Y,. Mechanical overloading causes mitochondrial superoxide and SOD2 imbalance in chondrocytes resulting in cartilage degeneration [J]., 2015, 5: 11722.
[7] Maneiro E, Martín M A, de Andres M C,. Mitochondrial respiratory activity is altered in osteoarthritic human articular chondrocytes [J]., 2003, 48(3): 700-708.
[8] Cillero-Pastor B, Rego-Pérez I, Oreiro N,. Mitochondrial respiratory chain dysfunction modulates metalloproteases -1, -3 and -13 in human normal chondrocytes in culture [J]., 2013, 14: 235.
[9] Reed K N, Wilson G, Pearsall A,. The role of mitochondrial reactive oxygen species in cartilage matrix destruction [J]., 2014, 397(1/2): 195-201.
[10] Vaamonde-García C, Riveiro-Naveira R R, Valcárcel-Ares M N,. Mitochondrial dysfunction increases inflammatoryresponsiveness to cytokines in normal human chondrocytes [J]., 2012, 64(9): 2927-2936.
[11] Cillero-Pastor B, Caramés B, Lires-Deán M,. Mitochondrial dysfunction activates cyclooxygenase 2 expression in cultured normal human chondrocytes [J]., 2008, 58(8): 2409-2419.
[12] Schapira A H. Mitochondrial diseases [J]., 2012, 379(9828): 1825-1834.
[13] Blanco F J, Rego-Pérez I. Mitochondria and mitophagy: Biosensors for cartilage degradation and osteoarthritis [J]., 2018, 26(8): 989-991.
[14] Cho H M, Ryu J R, Jo Y,. Drp1-Zip1 interaction regulates mitochondrial quality surveillance system [J]., 2019, 73(2): 364-376.e8.
[15] Kim J, Xu M, Xo R,. Mitochondrial DNA damage is involved in apoptosis caused by pro-inflammatory cytokines in human oa chondrocytes [J]., 2010, 18(3): 424-432.
[16] Ko J Y, Sun Y C, Li W C,. Chaperonin 60 regulation of SOX9 ubiquitination mitigates the development of knee osteoarthritis [J]., 2016, 94(7): 755-769.
[17] Farnaghi S, Prasadam I, Cai G P,. Protective effects of mitochondria-targeted antioxidants and statins on cholesterol-induced osteoarthritis [J]., 2017, 31(1): 356-367.
[18] Zhou S, Lu W L, Chen L,. AMPK deficiency in chondrocytes accelerated the progression of instability-induced and ageing-associated osteoarthritis in adult mice [J]., 2017, 7: 43245.
[19] Wang Y, Zhao X L, Lotz M,. Mitochondrial biogenesis is impaired in osteoarthritis chondrocytes but reversible via peroxisome proliferator-activated receptor γ coactivator 1α [J]., 2015, 67(8): 2141-2153.
[20] Deng Z, Li Y, Liu H,. The role of sirtuin 1 and its activator, resveratrol in osteoarthritis [J]., 2019, 39(5): BSR20190189.
[21] Bannuru R R, Osani M C, Vaysbrot E E,. oaRSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis [J]., 2019, 27(11): 1578-1589.
[22] Ramachandran A, Visschers R G J, Duan L Q,. Mitochondrial dysfunction as a mechanism of drug-induced hepatotoxicity: Current understanding and future perspectives [J]., 2018, 4(1): 75-100.
[23] Cameron M, Chrubasik S. Oral herbal therapies for treating osteoarthritis [J]., 2014(5): CD002947.
[24] Chen B, Zhan H, Marszalek J,. Traditional Chinese medications for knee osteoarthritis pain: A meta-analysis of randomized controlled trials [J]., 2016, 44(4): 677-703.
[25] Kimmatkar N, Thawani V, Hingorani L,. Efficacy and tolerability ofextract in treatment of osteoarthritis of knee: A randomized double blind placebo controlled trial [J]., 2003, 10(1): 3-7.
[26] Kuptniratsaikul V, Dajpratham P, Taechaarpornkul W,. Efficacy and safety ofextracts compared with ibuprofen in patients with knee osteoarthritis: A multicenter study [J]., 2014, 9: 451-458.
[27] Csaki C, Keshishzadeh N, Fischer K,. Regulation of inflammation signalling by resveratrol in human chondrocytes[J]., 2008, 75(3): 677-687.
[28] Zhou Y X, Zhang H, Peng C. Puerarin: A review of pharmacological effects [J]., 2014, 28(7): 961-975.
[29] 汪群红, 章灵芝, 徐文伟, 等. 葛根素的药理作用与不良反应分析 [J]. 中华中医药学刊, 2015, 33(5): 1185-1187.
[30] Wang S, Yang F J, Shang L C,. Puerarin protects against high-fat high-sucrose diet-induced non-alcoholic fatty liver disease by modulating PARP-1/PI3K/AKT signaling pathway and facilitating mitochondrial homeostasis [J]., 2019, 33(9): 2347-2359.
[31] Chen X F, Wang L, Wu Y Z,. Effect of puerarin in promoting fatty acid oxidation by increasing mitochondrial oxidative capacity and biogenesis in skeletal muscle in diabetic rats [J]., 2018, 8(1): 1.
[32] Peng L B, Xie Z K, Pei J,. Puerarin alters the function of monocytes/macrophages and exhibits chondroprotection in mice [J]., 2019, 19(4): 2876-2882.
[33] Wang L Y, Shan H J, Wang B,. Puerarin attenuates osteoarthritis via upregulating AMP-activated protein kinase/proliferator-activated receptor-γ coactivator-1 signaling pathway in osteoarthritis rats [J]., 2018, 102(3/4): 117-125.
[34] Darband S G, Kaviani M, Yousefi B,. Quercetin: A functional dietary flavonoid with potential chemo-preventive properties in colorectal cancer [J]., 2018, 233(9): 6544-6560.
[35] Andres S, Pevny S, Ziegenhagen R,. Safety aspects of the use of quercetin as a dietary supplement [J]., 2018, 62(1), doi:10.1002/mnfr.201700447.
[36] Li Y, Yao J Y, Han C Y,. Quercetin, inflammation and immunity [J]., 2016, 8(3): 167.
[37] Xu D, Hu M J, Wang Y Q,. Antioxidant activities of quercetin and its complexes for medicinal application [J]., 2019, 24(6): 1123.
[38] de Oliveira M R, Nabavi S M, Braidy N,. Quercetin and the mitochondria: A mechanistic view [J]., 2016, 34(5): 532-549.
[39] Wei B, Zhang Y, Tang L X,. Protective effects of quercetin against inflammation and oxidative stress in a rabbit model of knee osteoarthritis [J]., 2019, 80(3): 360-367.
[40] Feng K, Chen Z X, Pengcheng L,. Quercetin attenuates oxidative stress-induced apoptosis via SIRT1/ AMPK-mediated inhibition of ER stress in rat chondrocytes and prevents the progression of osteoarthritis in a rat model [J]., 2019, 234(10): 18192-18205.
[41] Qiu L, Luo Y, Chen X. Quercetin attenuates mitochondrial dysfunction and biogenesis via upregulated AMPK/SIRT1 signaling pathway in oa rats [J]., 2018, 103: 1585-1591.
[42] Munro D, Treberg J R. A radical shift in perspective: Mitochondria as regulators of reactive oxygen species [J]., 2017, 220(Pt 7): 1170-1180.
[43] Zhang J Y, Chen Y, Luo H Q,. Recent update on the pharmacological effects and mechanisms of dihydromyricetin [J]., 2018, 9: 1204.
[44] Wei L P, Sun X S, Qi X,. Dihydromyricetin ameliorates cardiac ischemia/reperfusion injury through Sirt3 activation [J]., 2019, 2019: 6803943.
[45] He Y Z, Wu Z P, Xu L H,. The role of SIRT3-mediated mitochondrial homeostasis in osteoarthritis [J]., 2020, 77(19): 3729-3743.
[46] Li L L, Zhang P, Bao Z X,. PGC-1α promotes ureagenesis in mouse periportal hepatocytes through SIRT3 and SIRT5 in response to glucagon [J]., 2016, 6: 24156.
[47] Ruderman N B, Xu X J, Nelson L,. AMPK and SIRT1: A long-standing partnership? [J]., 2010, 298(4): E751-E760.
[48] Wang J L, Wang K, Huang C,. SIRT3 activation by dihydromyricetin suppresses chondrocytes degeneration via maintaining mitochondrial homeostasis [J]., 2018, 14(13): 1873-1882.
[49] 李先宽, 李赫宇, 李帅, 等. 白藜芦醇研究进展 [J]. 中草药, 2016, 47(14): 2568-2578.
[50] Pannu N, Bhatnagar A. Resveratrol: From enhanced biosynthesis and bioavailability to multitargeting chronic diseases [J]., 2019, 109: 2237-2251.
[51] Raal A, Pokk P, Arend A,. Trans-resveratrol alone and hydroxystilbenes of rhubarb (L.) root reduce liver damage induced by chronic ethanol administration: A comparative study in mice [J]., 2009, 23(4): 525-532.
[52] López-Armada M J, Caramés B, Martín M A,. Mitochondrial activity is modulated by TNFalpha and IL-1beta in normal human chondrocyte cells [J]., 2006, 14(10): 1011-1022.
[53] Csaki C, Mobasheri A, Shakibaei M. Synergistic chondroprotective effects of curcumin and resveratrol in human articular chondrocytes: Inhibition of IL-1beta-induced NF-kappaB-mediated inflammation and apoptosis [J]., 2009, 11(6): R165.
[54] Fu Y H, Lei J L, Zhuang Y,. Overexpression of HMGB1 A-box reduced IL-1β-induced MMP expression and the production of inflammatory mediators in human chondrocytes [J]., 2016, 349(1): 184-190.
[55] Ma Z Q, Piao T K, Wang Y L,. Astragalin inhibits IL-1β-induced inflammatory mediators production in human osteoarthritis chondrocyte by inhibiting NF-κB and MAPK activation [J]., 2015, 25(1): 83-87.
[56] Dave M, Attur M, Palmer G,. The antioxidant resveratrol protects against chondrocyte apoptosis via effects on mitochondrial polarization and ATP production [J]., 2008, 58(9): 2786-2797.
[57] 李军, 熊琨, 龚元, 等. 基于信号转导通路的姜黄素抗氧化机制研究进展 [J]. 中草药, 2016, 47(13): 2373-2380.
[58] 余美荣, 蒋福升, 丁志山. 姜黄素的研究进展 [J]. 中草药, 2009, 40(5): 828-831.
[59] Wang L, Lv Y, Yao H X,. Curcumin prevents the non-alcoholic fatty hepatitis via mitochondria protection and apoptosis reduction [J]., 2015, 8(9): 11503-11509.
[60] Bannuru R R, Osani M C, Al-Eid F,. Efficacy of curcumin andfor knee osteoarthritis: Systematic review and meta-analysis [J]., 2018, 48(3): 416-429.
[61] Onakpoya I J, Spencer E A, Perera R,. Effectiveness of curcuminoids in the treatment of knee osteoarthritis: A systematic review and meta-analysis of randomized clinical trials [J]., 2017, 20(4): 420-433.
[62] Feng K, Ge Y W, Chen Z X,. Curcumin inhibits the PERK-eIF2-CHOP pathway through promoting SIRT1 expression in oxidative stress-induced rat chondrocytes and ameliorates osteoarthritis progression in a rat model [J]., 2019, 2019: 8574386.
[63] 李旭升, 陈慧, 甄平, 等. JAK2/STAT3信号通路介导姜黄素在骨性关节炎软骨细胞代谢中的影响 [J]. 中国骨伤, 2016, 29(12): 1104-1109.
[64] Wojdyło A, Oszmiański J. Antioxidant activity modulated by polyphenol contents in apple and leaves during fruit development and ripening [J]., 2020, 9(7): 567.
[65] Carrasco-Pozo C, Gotteland M, Speisky H. Protection by apple peel polyphenols against indometacin-induced oxidative stress, mitochondrial damage and cytotoxicity in Caco-2 cells [J]., 2010, 62(7): 943-950.
[66] Yeganeh P R, Leahy J, Spahis S,. Apple peel polyphenols reduce mitochondrial dysfunction in mice with DSS-induced ulcerative colitis [J]., 2018, 57: 56-66.
[67] Masuda I, Koike M, Nakashima S,. Apple procyanidins promote mitochondrial biogenesis and proteoglycan biosynthesis in chondrocytes [J]., 2018, 8(1): 7229.
[68] 谭妍, 庄笑梅, 沈国林, 等. 川芎嗪的肝微粒体代谢动力学及代谢表型研究 [J]. 药学学报, 2014, 49(3): 374-379.
[69] 李飞龙, 谢平金, 柴生颋, 等. 川芎嗪对膝骨性关节炎大鼠软骨VEGF表达的影响 [J]. 中国骨质疏松杂志, 2018, 24(7): 904-909.
[70] 朱海泉, 刘子敏, 孟祥圣, 等. 川芎嗪抑制NF-κB P65磷酸化对LPS诱导的骨关节炎软骨细胞凋亡和炎症反应的调节作用 [J]. 中国免疫学杂志, 2019, 35(2): 181-185.
[71] Musumeci G, Castrogiovanni P, Trovato F M,. Biomarkers of chondrocyte apoptosis and autophagy in osteoarthritis [J]., 2015, 16(9): 20560-20575.
[72] 冯全服, 毕蕾, 颜晓静, 等. 川芎嗪抑制肝癌HepG2细胞增殖及对线粒体凋亡途径的影响 [J]. 中国药科大学学报, 2015, 46(3): 350-354.
[73] 洪昆达. 川芎嗪治疗膝骨性关节炎的临床观察及对兔关节软骨细胞增殖与凋亡的影响 [D]. 福州: 福建中医药大学, 2013.
[74] 李琦玮, 张甘霖, 孙旭, 等. 甲基莲心碱抗肿瘤药理作用及其分子机制研究进展 [J]. 中国药房, 2019, 30(8): 1134-1138.
[75] Wu C H, Chen J X, Yang R C,. Mitochondrial protective effect of neferine through the modulation of nuclear factor erythroid 2-related factor 2 signalling in ischaemic stroke [J]., 2019, 176(3): 400-415.
[76] Ni B W, Huang X J, Xi Y,. Neferine inhibits expression of inflammatory mediators and matrix degrading enzymes in IL-1β-treated rat chondrocytes via suppressing MAPK and NF-κB signaling pathways [J]., 2020, 43(4): 1209-1221.
[77] 张宇标, 韩广弢, 蔡伟松, 等. 甲基莲心碱抑制骨关节炎软骨细胞凋亡和衰老 [J]. 武汉大学学报: 医学版, 2019, 40(6): 861-866.
[78] Lu L, Huang R, Wu Y,. Brucine: A review of phytochemistry, pharmacology, and toxicology [J]., 2020, 11: 377.
[79] 宋晓亮. 马钱子碱对体外培养的人软骨细胞增殖的影响 [D]. 太原: 山西医科大学, 2013.
[80] 贺佳玉, 吴丽, 王建春, 等. 马钱子碱新型壳聚糖纳米粒的体外抗肿瘤活性研究 [J]. 药学学报, 2016, 51(4): 650-656.
[81] 高萌萌. 马钱子碱对体外软骨细胞凋亡线粒体途径的研究 [D]. 合肥: 安徽医科大学, 2008.
[82] 韩冬, 张铁军, 唐铖, 等. 人参皂苷的药动学研究进展 [J]. 中草药, 2009, 40(2): 333-335.
[83] Kim J H, Yi Y S, Kim M Y,. Role of ginsenosides, the main active components of, in inflammatory responses and diseases [J]., 2017, 41(4): 435-443.
[84] Im D S. Pro-resolving effect of ginsenosides as an anti-inflammatory mechanism of[J]., 2020, 10(3): E444.
[85] Liang J M, Yu Y, Wang B Y,. Ginsenoside Rb1attenuates oxygen-glucose deprivation-induced apoptosis in SH-SY5Y cells via protection of mitochondria and inhibition of AIF and cytochrome c release [J]., 2013, 18(10): 12777-12792.
[86] Kong H L, Li Z Q, Zhao Y J,. Ginsenoside Rb1protects cardiomyocytes against CoCl2-induced apoptosis in neonatal rats by inhibiting mitochondria permeability transition pore opening [J]., 2010, 31(6): 687-695.
[87] 叶劲涛, 李锋涛, 宋焕瑾, 等. 人参皂苷Rg1通过改善氧化应激、线粒体损伤及炎症反应对大鼠脊髓缺血再灌注损伤的保护作用研究 [J]. 中国康复医学杂志, 2019, 34(9): 1021-1027.
[88] 张业勇, 程文丹, 陈哲峰, 等. 人参皂苷Rg1对软骨细胞Ⅱ型胶原表达的影响 [J]. 中国组织工程研究, 2013, 17(11): 1917-1924.
[89] 王维. 人参皂苷Rb1通过Notch信号通路调控基质金属蛋白酶-13防治oa的实验研究 [D]. 重庆: 重庆医科大学, 2015.
[90] Huang Y M, Wu D Y, Fan W M. Protection of ginsenoside Rg1on chondrocyte from IL-1β-induced mitochondria-activated apoptosis through PI3K/Akt signaling [J]., 2014, 392(1/2): 249-257.
[91] Na J Y, Kim S, Song K,. Anti-apoptotic activity of ginsenoside Rb1in hydrogen peroxide-treated chondrocytes: Stabilization of mitochondria and the inhibition of caspase-3 [J]., 2012, 36(3): 242-247.
[92] 刘慧妍, 黄馨慧, 张艳海. HPLC法快速测定8种中药中齐墩果酸和熊果酸 [J]. 中草药, 2017, 48(10): 1998-2001.
[93] Wang X, Ye X L, Liu R,. Antioxidant activities of oleanolic acid: Possible role of Nrf2 and MAP kinases [J]., 2010, 184(3): 328-337.
[94] Wang X, Liu R, Zhang W,. Oleanolic acid improves hepatic insulin resistance via antioxidant, hypolipidemic and anti-inflammatory effects [J]., 2013, 376(1/2): 70-80.
[95] Li H F, Wang X, Xiang S S,. Oleanolic acid induces mitochondrial-dependent apoptosis and G0/G1phase arrest in gallbladder cancer cells [J]., 2015, 9: 3017-3030.
[96] Tang X H, Gao J, Fang F,. Hepatoprotection of oleanolic acid is related to its inhibition on mitochondrial permeability transition [J]., 2005, 33(4): 627-637.
[97] Wang S, Du L B, Jin L,. Nano-oleanolic acid alleviates metabolic dysfunctions in rats with high fat and fructose diet [J]., 2018, 108: 1181-1187.
[98] Li Y L, Nie J L, Jiang P. Oleanolic acid mitigates interleukin-1β-induced chondrocyte dysfunction by regulating miR-148-3p-modulated FGF2expression [J]., 2020, 22(5): e3169.
[99] Kang X, Yang Z K, Sheng J,. Oleanolic acid prevents cartilage degeneration in diabetic mice via PPARγ associated mitochondrial stabilization [J]., 2017, 490(3): 834-840.
[100]Mateen S, Zafar A, Moin S,. Understanding the role of cytokines in the pathogenesis of rheumatoid arthritis [J]., 2016, 455: 161-171.
[101]傅瑶, 李颜, 霍炎, 等. 铁线莲属植物中挥发性成分的研究进展 [J]. 中国药房, 2013, 24(11): 1047-1049.
[102]Wu W J, Xu X X, Dai Y,. Therapeutic effect of the saponin fraction fromOsbeck roots on osteoarthritis induced by monosodium iodoacetate through protecting articular cartilage [J]., 2010, 24(4): 538-546.
[103]Wu W J, Gao X H, Xu X X,. Saponin-rich fraction fromOsbeck roots protects rabbit chondrocytes against nitric oxide-induced apoptosis via preventing mitochondria impairment and caspase-3 activation [J]., 2013, 65(2): 287-295.
[104]杨鹏飞, 朱烨婷, 方旭, 等. 加压提取法制备盾叶薯蓣根茎中薯蓣皂苷元 [J]. 中成药, 2019, 41(11): 2745-2747.
[105]龙香丽, 梁清延, 高宏, 等. 穿龙薯蓣根茎中薯蓣皂苷元的制备 [J]. 中成药, 2020, 42(7): 1874-1877.
[106]Wang L S, Ma T, Zheng Y P,. Diosgenin inhibits IL-1β-induced expression of inflammatory mediators in human osteoarthritis chondrocytes [J]., 2015, 8(5): 4830-4836.
[107]刘军, 何晓乐, 甄平, 等. SIRT1信号通路介导薯蓣皂苷元在骨性关节炎软骨细胞代谢中的作用机制 [J]. 中南大学学报: 医学版, 2017, 42(2): 121-127.
[108]刘军, 何晓乐, 甄平, 等. JAK2/STAT3信号通路介导薯蓣皂苷元对骨性关节炎软骨细胞代谢的影响 [J]. 浙江大学学报: 医学版, 2016, 45(5): 452-459.
[109]郑永军. 基于分子印迹技术的大蒜功能成分的分离提取及药理活性研究 [D]. 青岛: 中国海洋大学, 2012.
[110]Huang Y T, Yao C H, Way C L,. Diallyl trisulfide and diallyl disulfide ameliorate cardiac dysfunction by suppressing apoptotic and enhancing survival pathways in experimental diabetic rats [J]., 2013, 114(3): 402-410.
[111]Williams F M, Skinner J, Spector T D,. Dietary garlic and hip osteoarthritis: Evidence of a protective effect and putative mechanism of action [J]., 2010, 11: 280.
[112]Hosseinzadeh A, Jafari D, Kamarul T,. Evaluating the protective effects and mechanisms of diallyl disulfide on interlukin-1β-induced oxidative stress and mitochondrial apoptotic signaling pathways in cultured chondrocytes [J]., 2017, 118(7): 1879-1888.
[113]Argüelles J C. Physiological roles of trehalose in bacteria and yeasts: A comparative analysis [J]., 2000, 174(4): 217-224.
[114]Ansari M Y, Khan N M, Ahmad I,. Parkin clearance of dysfunctional mitochondria regulates ROS levels and increases survival of human chondrocytes [J]., 2018, 26(8): 1087-1097.
[115]Hosseinpour-Moghaddam K, Caraglia M, Sahebkar A. Autophagy induction by trehalose: Molecular mechanisms and therapeutic impacts [J]., 2018, 233(9): 6524-6543.
[116]Liu K, Jing M J, Liu C,. Effect of trehalose on manganese-induced mitochondrial dysfunction and neuronal cell damage in mice [J]., 2019, 125(6): 536-547.
[117]Sciarretta S, Yee D, Nagarajan N,. Trehalose-induced activation of autophagy improves cardiac remodeling after myocardial infarction [J]., 2018, 71(18): 1999-2010.
[118]Tang Q, Zheng G, Feng Z H,. Trehalose ameliorates oxidative stress-mediated mitochondrial dysfunction and ER stress via selective autophagy stimulation and autophagic flux restoration in osteoarthritis development [J]., 2017, 8(10): e3081.
[119]Vadalà M, Palmieri B. From algae to “functional foods” [J]., 2015, 166(4): e281-e300.
[120]Lee S W, Lee H J, Chung W T,. TRAIL induces apoptosis of chondrocytes and influences the pathogenesis of experimentally induced rat osteoarthritis [J]., 2004, 50(2): 534-542.
[121]Lim S, Choi A H, Kwon M,. Evaluation of antioxidant activities of various solvent extract fromand its major antioxidant components [J]., 2019, 278: 178-184.
[122]Gwon W G, Lee S G, Kim J I,. Hexane fraction from the ethanolic extract ofsuppresses cell adhesion molecules via regulation of NF-κB and Nrf2 pathway in human umbilical vein endothelial cells [J]., 2019, 22(1): 1-10.
[123]Park C, Jeong J W, Lee D S,.extract attenuates interleukin-1β-induced oxidative stress and inflammatory response in chondrocytes by suppressing the activation of NF-κB, p38 MAPK, and PI3K/Akt [J]., 2018, 19(8): E2308.
[124]Holmström K M, Kostov R V, Dinkova-Kostova A T. The multifaceted role of Nrf2 in mitochondrial function [J]., 2016, 1: 80-91.
[125]Park C, Hong S H, Shin S S,. Activation of the Nrf2/HO-1 signaling pathway contributes to the protective effects ofextract against oxidative stress-induced DNA damage and apoptosis in SW1353 human chondrocytes [J]., 2018, 15(6): E1173.
[126]Hayes J D, Dinkova-Kostova A T. The Nrf2 regulatory network provides an interface between redox and intermediary metabolism [J]., 2014, 39(4): 199-218.
[127]Shan Y L, Wei Z H, Tao L,. Prophylaxis of diallyl disulfide on skin carcinogenic model via p21-dependent Nrf2 stabilization [J]., 2016, 6: 35676.
[128]Sun K, Luo J H, Jing X Z,. Astaxanthin protects against osteoarthritis via Nrf2: A guardian of cartilage homeostasis [J]., 2019, 11(22): 10513-10531.
[129]Pan X X, Chen T T, Zhang Z J,. Activation of Nrf2/HO-1 signal with Myricetin for attenuating ECM degradation in human chondrocytes and ameliorating the murine osteoarthritis [J]., 2019, 75: 105742.
[130]Brentnall M, Weir D B, Rongvaux A,. Procaspase-3 regulates fibronectin secretion and influences adhesion, migration and survival independently of catalytic function [J]., 2014, 127(Pt 10): 2217-2226.
[131]Yokosawa T, Yamada M, Noguchi T,. Pro-caspase-3 protects cells from polymyxin B-induced cytotoxicity by preventing ROS accumulation [J]., 2019, 72(11): 848-852.
[132]苏曼, 陈军, 高洁, 等. 生姜炮制成干姜前后挥发油透皮吸收促进作用的比较研究[J]. 中草药, 2019, 50(24): 5988-5994.
[133]王晓丽, 张薇, 张雪侠, 等. 生姜挥发油对脑缺血再灌注大鼠溶酶体-线粒体途径凋亡的影响 [J]. 中药新药与临床药理, 2020, 31(10): 1153-1157.
[134]Bartels E M, Folmer V N, Bliddal H,. Efficacy and safety of ginger in osteoarthritis patients: A meta-analysis of randomized placebo-controlled trials [J]., 2015, 23(1): 13-21.
[135] Li Z, Cheng J Q, Liu J X. Baicalin protects human oa chondrocytes against IL-1β-induced apoptosis and ECM degradation by activating autophagy via MiR-766-3p/ AIFM1 axis [J]., 2020, 14: 2645-2655.
[136]陈志清, 刘智, 田永刚, 等. 祖师麻片联合尼美舒利治疗骨关节炎的临床研究[J]. 现代药物与临床, 2019, 34(5): 1454-1457.
Research progress on active ingredients of traditional Chinese medicine regulating mitochondrion to protect osteoarthritis cartilage
YANG Bo1, ZHOU Ming-wang2, JI Xing2, LI Sheng-hua2, XIAO Zhen1, WANG Yu1, HU Xing-rong1, SU Yao-hui1, XU Bin1, WANG Lei1
1. Gansu University of Chinese Medicine, Lanzhou 730000, China 2. Gansu Provincial Hospital of Traditional Chinese Medicine, Lanzhou 730000, China
Articular cartilage degeneration occurs at the beginning of the onset of osteoarthritis and then affects the pathological changes of other joint tissues. It is often regarded as one of the tissues in the study of pathological mechanism and the mechanism of drug therapy of osteoarthritis. Articular cartilage degeneration is related to mitochondrial morphological structure and dysfunction, therefore protecting mitochondrial morphology and function has become a new research direction. Traditional Chinese medicine (TCM) has a long history in the treatment of osteoarthritis. Relevant studies have been carried out on mechanism of the effective components of TCM that can protect mitochondria and delay the degeneration of articular cartilage. In this paper, the molecular mechanism of effective components of TCM (flavonoids, polyphenols, alkaloids, saponins, etc.) is well stated to protect mitochondria from degeneration of articular cartilage, and a new target is proposed for the prevention and treatment of osteoarthritis articular cartilage degeneration.
active ingredients of traditional Chinese medicine; flavonoids; polyphenols; alkaloids; saponins; osteoarthritis; cartilage;mitochondria
R282.710.5
A
0253 - 2670(2021)07 - 2117 - 17
10.7501/j.issn.0253-2670.2021.07.029
2020-08-26
全国中医学术流派传承工作室第二轮建设项目(国中医人教函[2019]62号);中医药传承与创新“百千万”人才工程(岐黄工程)岐黄学者;甘肃省科技计划项目(18JR2FA009)
杨 波(1991—),男,陕西临潼人,博士研究生,研究方向为骨关节疾病中西医结合防治。E-mial: 413893835@qq.com
李盛华(1959—)男,山东菏泽人,主任医师,博士生导师。E-mial: lishenghua0619@126.com
[责任编辑 崔艳丽]

