基于整合药理学的柴胡不同部位抗癫痫作用研究
王 鹏,高晓霞,高 耀,许文倩,冯 彦,李震宇,秦雪梅
基于整合药理学的柴胡不同部位抗癫痫作用研究
王 鹏,高晓霞*,高 耀,许文倩,冯 彦,李震宇,秦雪梅*
山西大学 中医药现代研究中心,山西 太原 030006
研究柴胡的抗癫痫活性及其发挥药效的物质基础和潜在的分子作用机制。采用活性追踪的方法,考察柴胡低、中、高极性部位分别对戊四唑诱导的小鼠致癫痫模型的影响。并采用LC-MS技术对柴胡抗惊厥活性部位化学成分进行全面表征。通过整合药理学方法对柴胡抗癫痫活性部位潜在作用机制进行初步预测,并构建柴胡潜在靶标与癫痫疾病靶标相互作用网络。最后,对于其中重要的通路进行验证。通过小鼠造模剂量筛选,选择戊四唑55.18 mg/kg造模,发现柴胡高极性部位(20 g/kg)可以显著延长癫痫小鼠的阵挛潜伏期与强直潜伏期,并能显著减少惊厥次数。化学成分鉴定结果表明,在正、负离子模式下从柴胡抗惊厥活性部位共鉴定出32种化学成分,主要为柴胡皂苷类成分,还包括脂肪酸类、糖类和香豆素类等成分。通过整合药理学平台筛选出柴胡抗癫痫的关键靶标22个,其中疾病与药物共有主要靶点有10个,包括ATP5A1、ATP5B、ATP1A1、ATP5C1、PPP3CA、PTGS2、AR等;其富集的通路包括帕金森病、能量代谢、亨廷顿氏病、卵母细胞减数分裂、神经退行性疾病等。最终,验证了能量代谢中关键节点,结果发现柴胡高极性部位能明显回调癫痫小鼠海马和肝脏中三磷酸腺苷(adenosine triphosphate,ATP)含量。柴胡高极性部位具有显著抗惊厥活性,其主要通过调节能量代谢通路来抑制癫痫的发生,其中柴胡皂苷类成分主要调节能量代谢,并通过改善ATP含量水平起到抗癫痫的作用,这可能是柴胡治疗癫痫的主要机制。
柴胡;戊四唑;癫痫;整合药理学;能量代谢
癫痫是脑神经元同步异常化放电而导致暂时性神经功能障碍的一种慢性疾病,全球大约有5000万癫痫患者[1],据统计我国至少有900万癫痫患者,同时每年有40万左右新发癫痫患者。癫痫的发病机制十分复杂,中枢神经系统的兴奋性与抑制性失衡是发病的主要诱因,而且与神经递质失衡、离子通道、神经胶质细胞、遗传及免疫异常等密切相关[2]。目前,治疗癫痫的手段主要为化学药物治疗,包括苯妥英钠、丙戊酸钠、卡马西平等传统型抗癫痫药物,另有一些新型药物如拉莫三嗪、托吡酯、加巴喷丁等也被用于临床当中。尽管有20余种不同的抗癫痫药物被应用于临床,但仍至少有1/3患者会发展为难治性癫痫[3]。另一方面,药物的不良反应也十分严重,包括加重癫痫发作或引发新的癫痫类型。中医药疗法具有毒副作用小的优势,黄运生等[4]以中医理论为切入点,探寻了癫痫从肝论治的方法体系,自拟柴胡疏肝散用于癫痫的临床治疗效果良好。另外,经文献检索发现以柴胡为君药的复方如柴胡加龙骨牡蛎汤、柴胡桂枝汤和小柴胡汤[5-7]等治疗癫痫都具有显著的临床疗效。
柴胡为伞形科植物柴胡DC.或狭叶柴胡Willd.的干燥根,味辛、苦,性微寒,归肝、胆、肺经,具有疏散退热、舒肝解郁、升举阳气等作用。龚素珍等[8]以大鼠额叶皮层电惊厥阈值作为指标,发现柴胡具有抗癫痫活性。刘燕等[9-10]研究柴胡有效成分的抗癫痫作用,发现柴胡皂苷组分、挥发油均对最大电休克(maximal electroshock seizure,MES)模型有明显拮抗作用;高极性部位可有效对抗戊四唑(pentylenetetrazol)致癫痫模型,之后对其物质基础进行挖掘,推测亚油酸、丙三醇和木糖醇为主要抗癫痫活性成分。黄庆晖等[11]发现超临界CO2萃取的柴胡挥发油也具有抗惊厥作用。同时,谢炜[12]对柴胡皂苷类成分进行药效实验以及作用机制研究,发现柴胡总皂苷存在抗癫痫活性,其机制可能与抑制大鼠海马星形胶质细胞胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)的过度表达有关。可见,柴胡作为具有抗癫痫作用的单味药,其化学成分十分复杂,而现阶段对中药作用机制的研究认为,多成分、多靶点为其发挥药理作用的重要方式[13],因此,需要从多成分、整体性出发,研究柴胡治疗癫痫的重要机制。
中药整合药理学平台(https://www.tcmip.cn)是以中医药大数据为驱动,现代分析技术为手段的新兴平台[14],整合了中药材数据、中药方剂数据、中药成分数据、中药靶标数据与疾病相关分子数据资源,采用人工智能、数据挖掘、网络计算及可视化等方法和技术,开展中药(含方剂)靶标预测及功能分析、证候相关分子挖掘及功能分析等,建立“中药-成分-靶标-疾病”多维分析平台与多维度关联的网络关系,有效揭示了中药药效作用的分子机制[15-18]。
本研究基于活性筛选柴胡抗癫痫有效部位,明确柴胡有效部位成分,采用整合药理学方法与平台,从整体性的角度对柴胡抗癫痫有效部位的作用机制进行探讨,并对关键通路进行验证,为深入研究柴胡及含柴胡的中药复方的抗癫痫作用提供参考依据。
1 材料与仪器
1.1 材料
ICR小鼠,雄性,7~8周龄,体质量23~25 g,SPF级,中国食品药品检定研究院动物实验中心提供,动物许可证SCXK(京)2005-0004。动物实验经过山西大学动物实验伦理委员会批准(批准编号SXULL2019003)动物自然昼夜节律光照条件下,自由进食进水,饲养7 d适应环境,每天触摸动物以适应实验人员操作。柴胡购于山西省华阳药业有限公司,经山西大学中医药现代研究中心主任秦雪梅教授鉴定为伞形科植物柴胡DC.的干燥根,习称“北柴胡”。戊四唑购于上海依赫生物科技有限公司。
1.2 仪器
Dionex UltiMate 3000超高效液相色谱及四级杆-静电场轨道阱高分辨质谱联用仪;Xcalibur工作站(美国Thermo Fisher Scientific公司);电子分析天平BS210S(南京莱步科技实业有限公司);Scientz-12N真空冷冻干燥机(宁波新芝生物科技股份有限公司);超声清洗仪KQ2200DB(昆山市超声仪器有限公司);小鼠行为观测箱,自制,长×宽×高为80 cm×80 cm×50 cm。
2 方法
2.1 柴胡不同极性部位的制备
精密称取适量柴胡,8倍量95%乙醇浸泡12 h,回流提取3次,每次2 h。合并滤液,浓缩至无乙醇味,得到柴胡提取物并进行极性梯度萃取。首先加入等体积石油醚萃取,多次萃取至萃取液无色,回收石油醚,浓缩至浸膏,于真空干燥箱(60 ℃)中干燥,得柴胡低极性部位(出膏率约为2.13%);石油醚萃取后剩余部分,加入等体积醋酸乙酯萃取,多次萃取至萃取液无色,回收醋酸乙酯,浓缩至浸膏,于真空干燥箱(70 ℃)中干燥,得柴胡中极性部位(出膏率约为5.35%);萃取后剩余部位蒸干得到柴胡高极性部位(出膏率约为8.11%)。按照《中国药典》方法,以柴胡皂苷a和d为指标成分对柴胡不同提取部位进行质量控制,其中柴胡低极性部位柴胡皂苷a和d质量分数约为13.0、14.3 μg/g,柴胡醋酸酸乙酯部位约为1.095 0、0.775 5 mg/g,柴胡高极性部位约为231.0、104.3 μg/g。
2.2 模型动物的复制与给药
2.2.1 戊四唑致慢性惊厥小鼠模型剂量筛选 采用单位概率回归法[19],测定造模药物戊四唑的95%有效药物剂量(ED95)。通过文献检索得到戊四唑致癫痫模型的常用剂量32 mg/kg[20-22],分别取5个浓度(50、40、32、25.6、20.48 mg/kg)梯度(0.8倍梯度浓度)的溶液进行戊四唑ED95测定。
50只小鼠进行剂量筛选,第1只小鼠ip 40 mg/kg,观察小鼠行为10 min:若发生3级以上行为则认定模型成功,下一只小鼠选用下一梯度浓度即32 mg/kg戊四唑造模;若未出现3级以上行为则认为造模失败,下一只小鼠选用上一梯度浓度即50 mg/kg戊四唑造模。依次连续进行实验,每只小鼠均进行1次剂量筛选实验。结果采用Probit回归模型进行统计分析,最终ED95有效剂量则为本实验的造模剂量。
2.2.2 动物分组与给药 50只小鼠一次与ip 55.18 mg/kg(最佳造模剂量)戊四唑造模,观察小鼠行为10 min,若发生3级以上行为则认定小鼠能成功复制戊四唑致痫模型。经过筛选得到造模成功小鼠48只,并随机分为6组(=8),包括对照组、模型组、柴胡低极性部位组、柴胡中极性部位组、柴胡高极性部位组、阳性药地西泮(4 mg/kg)组。对照组小鼠安置在一个安静的房间中,该房间12 h明暗循环,并随意提供食物和水。除对照组外,其他组小鼠每2天进行1次造模(给药60 min后,1次ip戊四唑)。各给药组根据前期预实验结果确定了柴胡各部位给药剂量均为20 g/kg(按生药量计),对照组和模型组小鼠给予等体积药物溶剂。实验中药物均用含0.1%聚山梨酯-80水溶解,给药方式选择ip给药,剂量为0.1 mL/10 g体质量,每天1次,连续给药12 d。
2.2.3 柴胡不同部位对戊四唑致慢性惊厥小鼠的影响 每天记录各组小鼠体质量,利用活动仪记录小鼠的行为动作,连续记录10 min,记录小鼠阵发性痉挛潜伏期(即从ip戊四唑开始至相当于痫性分级1~3级发作的时间)、强直性惊厥潜伏期(即从ip戊四唑开始至相当于痫性分级5级发作的时间)、惊厥次数(10 min内小鼠发生痫性分级3~5级行为的次数)。
痫性发作分级:小鼠痫性发作分级采用Racine标准[23],0级:无发作反应;1级:节律性口角、耳或面部肌肉抽动阵挛;2级:点头并伴随更严重的面部肌肉抽动阵挛;3级:出现前肢阵挛但不伴随直立;4级:前肢阵挛伴随直立;5级:全身强直阵挛发作而跌倒。
2.2.4 样本的收集 经11 d实验结束后,各组小鼠脱颈椎处死,置于冰上快速解剖取出肝脏与海马,并放入液氮猝灭,后置于−80℃冰箱保存。
2.3 统计分析
2.4 柴胡有效部位化学成分分析
2.4.1 色谱条件 采用Waters Acquityuplc HSS T3色谱柱(100 mm×2.1 mm,1.7 μm),流动相为0.1%甲酸-水(A)和甲醇(B);梯度洗脱:0~2 min,30%~40% B;2~10 min,40%~50% B;10~20 min,50%~55% B;20~30 min,55%~65% B;30~40 min,65%~75% B;40~50 min,75%~95% B;50~55 min,95% B。进样量5 μL,体积流量0.2 mL/min,柱温40 ℃。
2.4.2 质谱条件 采用电喷雾离子源(ESI),同时进行正、负离子模式采集,扫描范围为/100~1500;喷雾电压3.5 kV(ESI+)和−2.5 kV(ESI−);毛细管温度为320 ℃;加热器温度为300 ℃;鞘气体积流量35 arb,辅助气体积流量10 arb;分辨率设定为MS full scan 35 000 FWHM以及MS/MS 17 500 FWHM,碰撞能量设定为12.5、25和37.5 eV。
2.4.3 化学成分检测与鉴定 取柴胡高极性部位0.5 g,加入5 mL蒸馏水超声溶解,12 000 r/min离心10 min,上清液用 0.22 μm 微孔滤膜滤过,即得柴胡高极性部位供试品溶液。取该供试品溶液进行检测,采集LC-MS色谱图,观察各色谱峰对应质谱图中的准分子离子峰及多级碎片等信息,通过与对照品比对、检索文献及相关的数据库进行成分鉴定指认,检测成分用于后续整合药理学分析。
2.5 整合药理学方法
2.5.1 癫痫疾病的候选靶标来源 整合药理学平台疾病/症状靶标数据库通过整合Drugbank数据库(https://go.drugbank.com/)、Online Mendelian Inheritance in Man数据库(OMIM,https://omim.org/)、Human Phenotype Ontology数据库(HPO,https://hpo.jax.org/)、Therapeutic Target Database(TTD,http://db.idrblab.net/ttd/)、京都基因和基因组百科全书数据库(Kyoto encyclopedia of genes and genomes,KEGG,https://www.kegg.jp/)等资源,提取治疗疾病或症状的药物靶标的基因和蛋白质相关信息[17-18]。在整合药理学平台疾病/证候靶标数据库,以“convulsions or eclampsia or convulsion or epilepsia or epilepsy or epileptic or hieronosus or falling sickness”作为疾病或症状关键词进行检索,勾选检索出来的所有靶标,作为候选的疾病靶标。
2.5.2 柴胡中化学成分的靶标预测 整合药理学平台的靶标预测和共性靶标分析基于化学信息学的药物靶标预测方法,分别为基于配体特征的预测、基于蛋白质结构特征的预测和基于数据挖掘方法的预测。采用二维结构相似性搜索,即采用分子ACCess系统(MACCS)分子指纹,使用开源软件Open Babel进行柴胡化学成分的化学指纹特征的提取,并采用Tanimoto系数定义的相似度计量方法,通过与FDA上市药物进行相似性打分(score>0.8),并提取作用靶标,最后获得中药化学成分的靶标预测结果。
2.5.3 柴胡治疗癫痫靶标间蛋白质-蛋白质相互作用(protein-protein interactions,PPI)网络构建与分析 柴胡作用的潜在靶标与癫痫疾病靶标之间PPI通过整合药理学平台的PPI数据库获得,该平台镶嵌了Human Annotated and Predicted Protein Interaction Database(HAPPI)、Reactome,Online Predicted Human Interaction Database(OPHID)、In Act、Human Protein Reference Database(HPRD)、Molecular interaction Database(MINT)和Database of Interacting Proteins(DIP)等数据库中PPI数据。通过整合药理学平台网络分析模块,针对柴胡作用的潜在靶标与惊厥疾病靶标之间的PPI计算网络特征值,以节点连接度(degree)的2倍中位数为卡值,选取中药靶标-疾病基因互作网络的核心节点(hubs);在此基础上,以degree、节点紧密度(closeness)和节点介度(betweenness)的中位数为卡值,选取同时满足3个卡值的节点为中药矫正疾病失衡网络的关键靶标网络。然后,对关键靶标网络进行通路富集分析,选取值前30的通路,构建“中药材-化学成分-核心靶标-关键通路”的多层次关联网络,并对关键靶标网络和多层次关联网络进行可视化。
2.5.4 基因功能和通路富集分析 基因功能和通路富集分析在整合药理学平台进行,相关信息来自于基因本体(gene ontology,GO)数据库(http:// www.geneontology.org)和KEGG通路数据库(http://www.genome.jp/kegg/)。
2.6 代谢通路的验证
根据整合药理学分析结果,筛选显著性较高的通路中关键节点进行验证,测定小鼠海马与肝脏中的三磷酸腺苷(adenosine triphosphate,ATP)含量。
ATP含量测定采用增强型ATP检测试剂盒(Beyotime),取冻存组织肝脏和海马样本约20 mg,加入20 μL裂解液,冰水浴匀浆后4 ℃、12 000×离心5 min,取上清进行测定。
将ATP标准溶液稀释为1×10−4、1×10−3、0.01、0.03、0.1、0.3、1、3、10 μmol/L浓度梯度。将100 μL ATP检测工作液加入到检测孔内,于室温放置3~5 min后,在检测孔内加入20 μL 不同浓度梯度的ATP标准品,并迅速用微量移液器混匀,用化学发光仪测定相对光单位(relative light unit,RLU)值。经回归分析后得到标准曲线(=57 103-36.654,²=0.996 6)。
3 结果
3.1 柴胡不同部位治疗癫痫药效研究
50只小鼠给予不同浓度梯度戊四唑造模结果如表1所示,基于Probit回归模型进行统计分析,得到其Probit模型,响应频率(P)=−11.486+3.274(变量使用底数为2.718的对数来转换)。最终ED95即造模剂量为55.18 mg/kg。
3.1.1 柴胡不同部位对戊四唑所致惊厥小鼠体质量的影响 如图1所示,与对照组相比,模型组小鼠体质量无显著变化(>0.05),柴胡不同部位给药组对小鼠体质量也无影响(>0.05)。而从第7天开始,地西泮组与对照组比较,小鼠体质量明显下降(<0.05),表明地西泮组对于模型小鼠的生长发育存在一定影响。

表1 戊四唑致癫痫模型剂量筛选

与对照组比较:#P<0.05
3.1.2 柴胡不同部位对戊四唑致惊厥小鼠阵挛潜伏期的影响 如图2所示,与对照组相比,模型组小鼠阵挛潜伏期极显著缩短(<0.001),阳性药地西泮组未发生惊厥,其阵挛潜伏期和对照组一致。与模型组相比,柴胡高极性部位组在给药第1天即可显著延长模型小鼠的阵挛潜伏期(<0.05),给药3~11 d维持极显著延长阵挛潜伏期的药效(<0.001),且随着给药时间的增长作用更加明显,呈时间相关性;柴胡中极性部位给药第11天模型小鼠阵挛潜伏期也有显著性延长(<0.05)。柴胡低极性部位无明显影响。
3.1.3 柴胡不同部位对戊四唑致惊厥小鼠强直性潜伏期的影响 如图3所示,模型组与对照组比较,模型小鼠强直性潜伏期显著缩短(<0.05),阳性药地西泮组未发生惊厥,其强直性潜伏期和对照组一致。与模型组相比,柴胡高极性部位组第5天起模型小鼠强直性潜伏期均显著延长(<0.05),随着给药时间的延长,强直性潜伏期的延长逐渐趋于稳定。柴胡其他部位给药组无明显影响。
3.1.4 柴胡不同部位对戊四唑致模型小鼠惊厥次数的影响 如图4所示,对照组与阳性药组由于没有出现惊厥,故惊厥次数均为0,未在图中显示。与模型组相比,柴胡高极性溶性部位组给药第1天,模型小鼠惊厥次数显著性下降(<0.05),给药3~11 d惊厥次数极显著的下降(<0.001);柴胡中极性部位组给药第7~11天,模型小鼠惊厥次数有明显下降趋势,但无显著差异。且随着给药时间的延长,柴胡高极性部位组模型小鼠惊厥次数下降明显,具有时间相关性,但仍不及地西泮组。
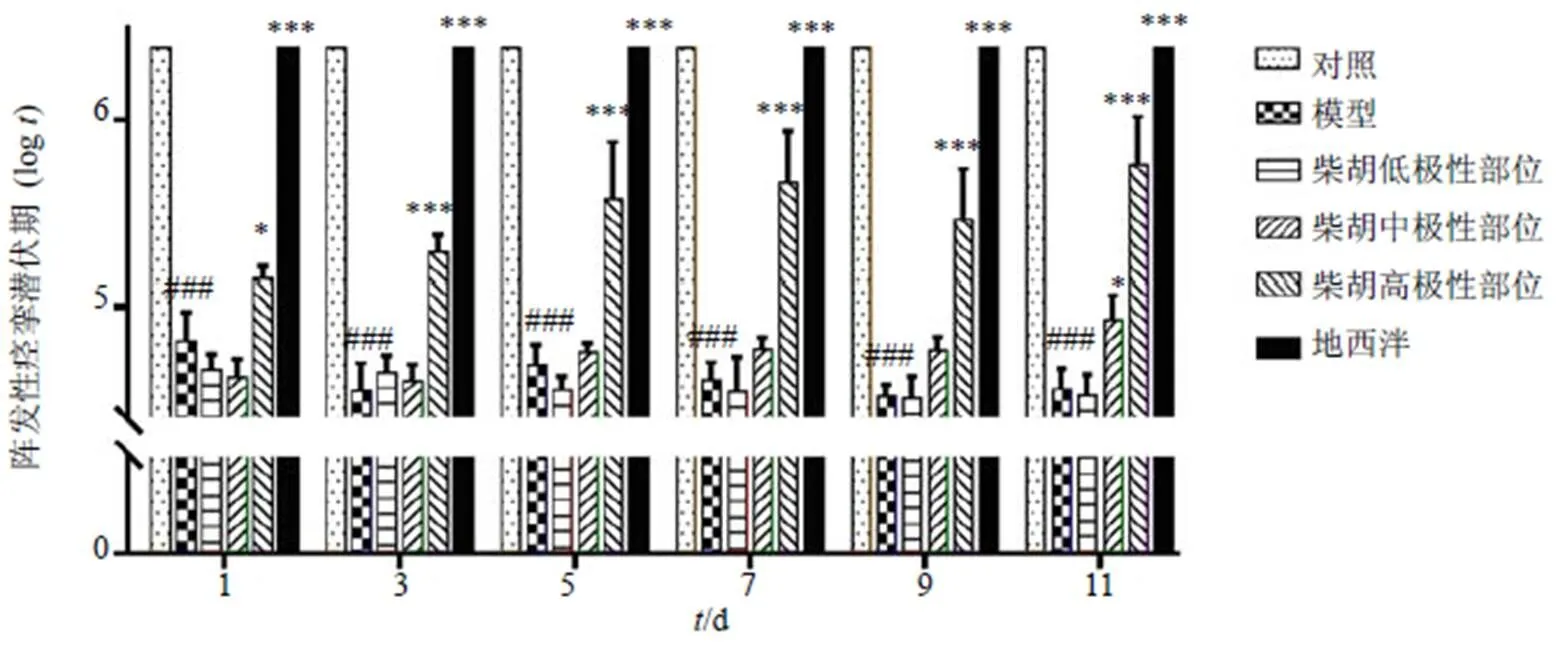
与对照组比较:###P<0.001;与模型组比较:*P<0.05 ***P<0.001

与对照组比较:#P<0.05;与模型组比较:*P<0.05
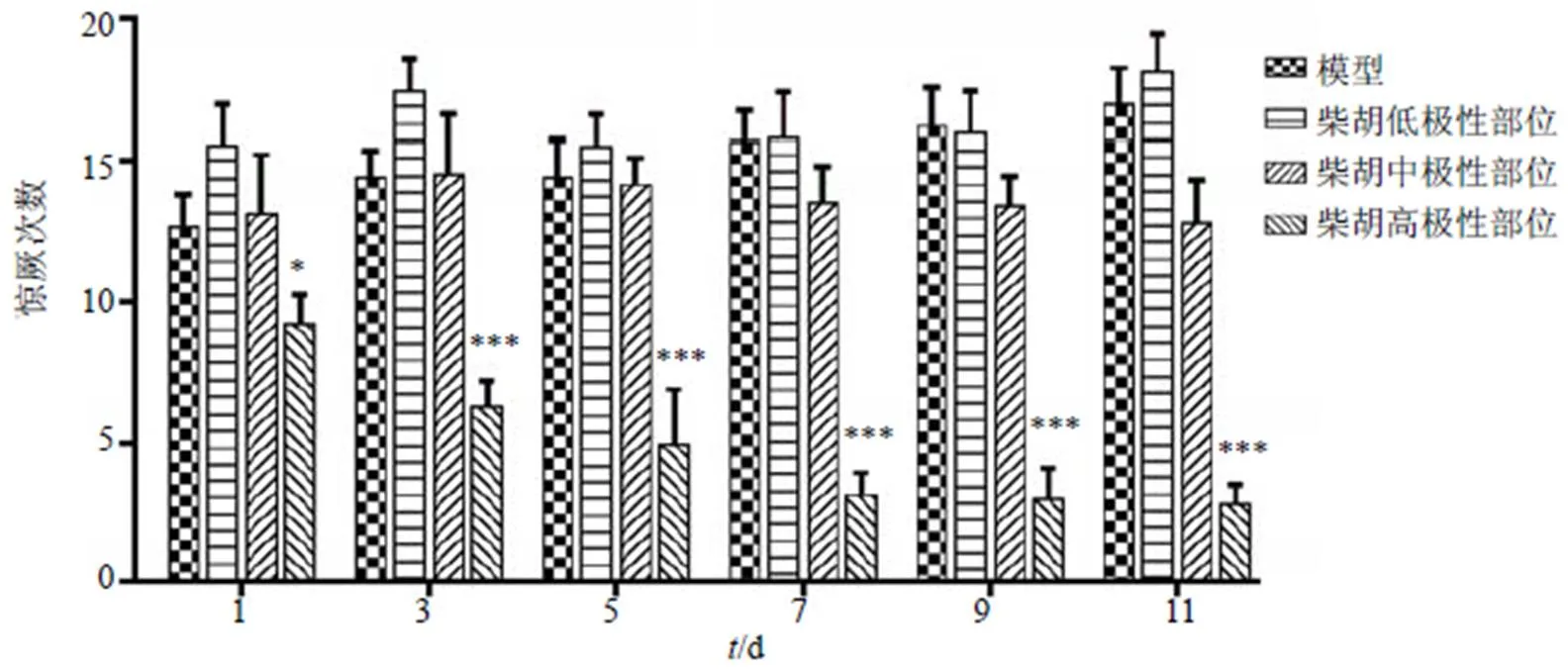
与模型组比较:*P<0.05 ***P<0.001
3.2 基于UPLC-MS的柴胡高极性部位化学成分分析
根据上述实验结果,发现柴胡高极性部位具有显著抗惊厥活性,需进一步对其物质基础进行分析。采用UPLC/Q-TOF-MS/MS技术的正、负离子模式分析柴胡高极性部位成分,其ESI-MS的质谱总离子流图(total ion chromatogram,TIC)如图5所示,通过检索国内外文献和Scifinder数据库、TCMID与TCMSP数据库,建立含有345个柴胡化学成分数据库,结合Xcalibur软件中Qual Browser功能对目标化合物进行了鉴定和确证。根据Xcalibur工作站给出的高分辨的精确相对分子质量、二级质谱碎片离子信息,结合文献报道的质谱裂解规律及在线数据库(HMBD、Pub Chem、Mass Bank、Chem Spider等)的检索,进行数据定性鉴定处理分析,共鉴定出32个化学成分,包括20个皂苷类成分、5个脂肪酸类成分、4个糖类成分、2个香豆素类成分和1个色原酮类成分,分析数据见表2。
3.3 基于整合药理学的柴胡有效部位治疗癫痫分子机制研究
3.3.1 柴胡化学成分靶标预测及分析 基于化学鉴定的32个成分,共预测出1384个靶标。将这些靶标进行基因分析,其基因功能主要涉及RNA聚合酶II启动子转录、RNA聚合酶II转录因子活性,配体激活的序列特异性DNA结合、脂质代谢过程等(表3)。对这些候选靶标进行通路富集分析可见,涉及的主要通路有脂质代谢、卵母细胞减数分裂、PPAR信号通路等(表4)。

图5 柴胡高极性部位正(B)、负(A) 离子模式总离子流图与各级提取离子离子流图(C~H)
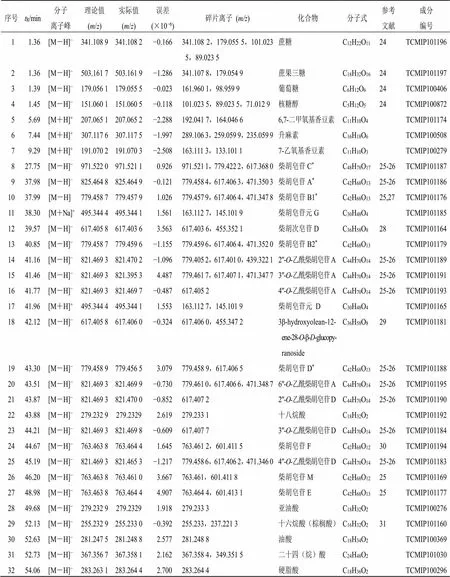
表2 柴胡高极性部位化学成分鉴定
*表示与对照品比对
*Indicates comparison with the reference substance

表3 柴胡的候选靶标功能信息
3.3.2 柴胡治疗癫痫的核心靶标网络、基因功能和通路富集分析 通过整合药理学的网络分析模块,基于PPI相互作用数据库,构建柴胡有效成分组合潜在靶标与疾病靶标相互作用网络。筛选关键靶标52个,根据degree显示前22个靶点,图中节点的大小与degree呈正比关系(图6)。
通过GO和KEGG数据库的基因和功能分析,柴胡治疗癫痫的关键靶标基因功能富集分析结果显示,基因功能包括线粒体ATP合成耦合质子运输、线粒体质子转运ATP合酶复合物、转运体活性和ATP生物合成过程等(表5)。靶标通路富集结果显示,柴胡治疗癫痫的通路包括帕金森氏综合症、能量代谢和亨廷顿疾病等(表6)。
3.3.3 柴胡治疗癫痫的“中药-成分-靶标-通路”多维网络分析 多层次关联网络显示了前30条的关键通路,这些通路主要有帕金森综合征、能量代谢、亨廷顿病、卵母细胞减数分裂、神经变性疾病等;根据degree仅显示了前10个核心靶标包括ATP5B、ATP5C1、ATP5A1、ATP1A1、AR、PTGS2、PGR、PPP3CA、YWHAE、MED1(图7);同时显示了与这些核心靶标相关联的柴胡高极性部位32个化学成分(表2)。
3.4 柴胡改善癫痫小鼠海马与肝脏组织中ATP含量
整合药理学结果表明,柴胡高极性部位能调节能量代谢,并通过介导ATP合成进而改善癫痫发作状态。因此,本研究测定了各组小鼠海马与肝脏组织中的ATP含量,结果(图8)表明,与对照组相比,模型组小鼠海马组织ATP含量显著降低(<0.05),而柴胡高极性部位ATP含量显著回调(<0.05)并趋近对照,表明柴胡高极性部位能通过调节小鼠海马组织中的ATP含量改善癫痫。在肝脏组织中,模型组与对照组ATP含量同样存在显著差异(<0.05),柴胡高极性部位同样存在回调现象,但无显著性差异。
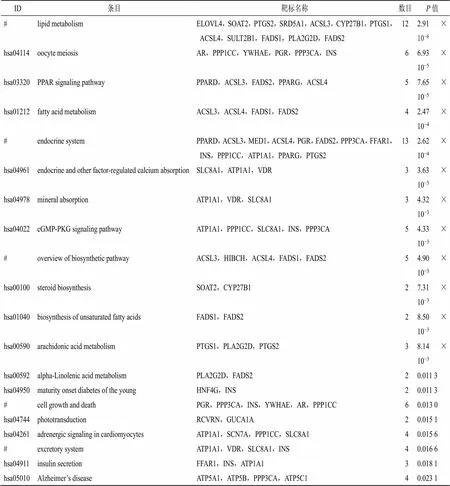
表4 柴胡候选靶标参与的通路信息
#表示大通路,表6同
#denotes a large path, same as table 6
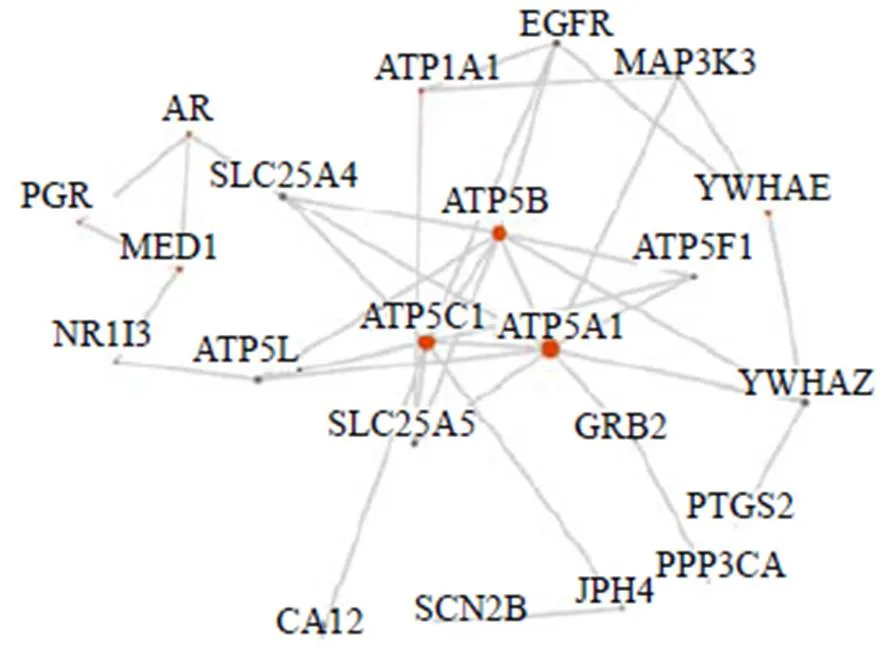
图6 柴胡潜在靶标与癫痫疾病靶标相互作用网络
4 讨论
柴胡在临床上应用十分广泛,对发热、消化系统疾病、抑郁症、癌症等多种疾病均有着十分显著的疗效[32]。本课题组致力于研究柴胡在精神疾病中的作用,对柴胡在抑郁症中的药效物质基础和作用机制做了大量研究,并发现了抗抑郁活性部位柴胡低极性部位[33-35]。根据化学致痫剂是作用于兴奋性和抑制性神经递质系统来复制癫痫模型的,故本实验采用了化学致痫剂进行造模,其中戊四唑为很强的致痫剂,其致痫模型被认为是理想的全身强直性惊厥发作模型之一。本研究结果表明柴胡低极性部位并未表现出抗惊厥活性,文献调研发现,柴胡低极性部位表现出抗癫痫活性主要集中于最大电休克致惊厥模型中[8,11]。因此,柴胡低极性部位是否具有抗癫痫活性需要采用其他模型进一步的验证。另外,前期预实验中还考察了柴胡各部位ig给药方式,但未发现明显抗癫痫活性。在本实验中,柴胡高极性部位表现出良好的抗惊厥活性,与文献报道的研究结果相一致[8]。通过整合药理学研究发现其作用机制和能量代谢密切相关。同时,其皂苷类成分可能是柴胡抗惊厥的主要的物质基础。
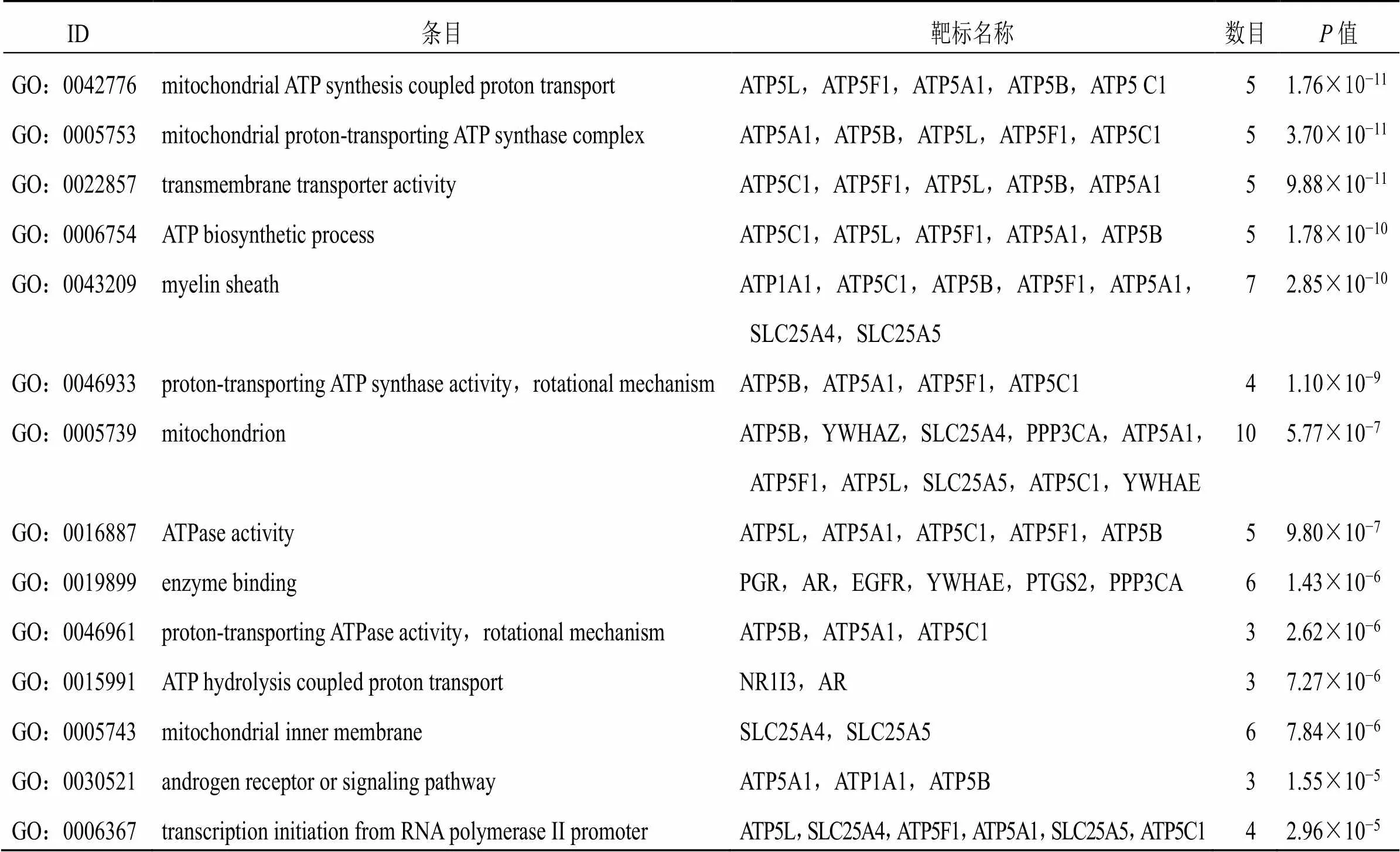
表5 柴胡治疗癫痫关键靶标基因功能信息

表6 柴胡治疗癫痫关键靶标通路信息
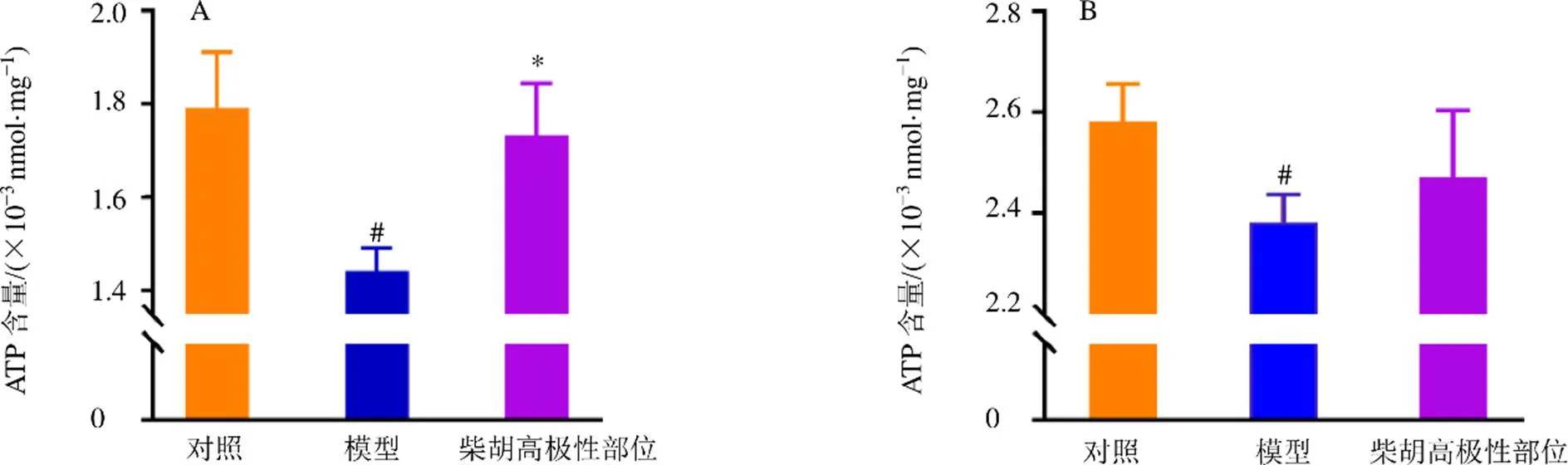
与对照组比较:#P<0.05;与模型组比较:*P<0.05
本实验中,地西泮表现出了良好的镇静效果,其抗惊厥指标均优于柴胡高极性部位。但在本研究中发现,戊四唑致痫模型以及柴胡各部位给药组对小鼠体质量并无明显影响,但是阳性药地西泮组小鼠体质量较对照组有显著下降趋势,体质量是反映动物生长发育水平的重要指标,另有文献报道地西泮会导致抑郁小鼠体质量下降[36],并减弱小鼠学习记忆能力与自主活动能力[37]。这可能也从一定程度上体现了中药不良反应小的优势。
中药整合药理学是多学科融合、多平台的整合,以中医药大数据为支撑,集成了靶标预测、数据挖掘、网络构建和分析、可视化等网络药理学模块,采取自助模式,集众家之所长,强调多层次、多环节的整合研究,适用于中药复杂体系作用机制的初步预测研究。方欢乐等[15]运用整合药理学平台构建了柴胡-黄芩改善COVID-19临床症状的“药对-活性成分-关键靶标-作用通路”多维网络,获得了112个化学成分并对应预测筛选了343个潜在靶标,表明柴胡-黄芩药通过调控白介素信号通路、C型凝集素域7家族成员A/炎症途径、免疫应激等相关信号通路,达到抑制活化的细胞因子、缓和过激的免疫反应、消除炎症、抗病毒等相关作用。于华芸等[17]运用中医药整合药理学平台构建了当归贝母苦参丸治疗前列腺疾病的“中药材-核心成分-关键靶标-主要通路”多维网络,获得了核心成分65个,并对应预测筛选了532个潜在靶标,发现当归贝母苦参丸是以多成分交互作用于多靶点,通过参与雌激素、凋亡、趋化因子等信号通路以调控良性前列腺增生症、前列腺癌等疾病发生发展过程。李晓宇等[18]、王玉等[16]以中医药整合药理学平台为方法深入挖掘了心可舒片干预动脉粥样硬化与大黄抗肝癌的网络作用机制。这些研究表明整合药理学平台适用于的中药药效成分以及分子机制的初步探索。本研究借助中药整合药理学计算平台,分析柴胡高极性提部位对癫痫发挥治疗作用的物质基础及其分子机制。在整合药理学平台中药材数据库,鉴定了柴胡高极性部位化学成分共32种,进行了潜在靶标预测;同时建立了“menstrual”的候选疾病靶标;基于PPI相互作用数据库,构建了柴胡潜在靶标与疾病靶标相互作用网络,筛选出关键靶标22个,疾病与药物共有靶点为ATP5A1、ATP5B、ATP1A1、ATP5C1、PPP3CA、AR、MED1、PGR、PTGS2、YWHAE;进一步进行了基因功能分析和通路富集分析,通路集中在帕金森病、能量代谢、亨廷顿氏病、卵母细胞减数分裂、神经退行性疾病等。
本研究发现柴胡改善痫性发作与能量代谢密切相关。研究结果也显示,ATP含量在癫痫小鼠海马中的含量显著降低,柴胡高极性部位能显著提高ATP含量,与文献报道一致。首先,线粒体功能障碍在癫痫的发生发展中占据重要作用,其中线粒体氧化呼吸链障碍是癫痫的重要诱因[38]。线粒体呼吸链是氧化磷酸化的场所,主要功能是完成电子传递过程,驱动氢离子移出内膜转变成跨膜的氢离子梯度,用于ATP的生物合成。因此,线粒体生物氧化呼吸链功能障碍可影响氧化磷酸化的功能,使ATP生成减少,若累及中枢神经系统,则导致癫病发作[39],同时有研究发现新生儿期癫痫患者脑组织中发现了线粒体氧化磷酸化抑制[40]。其中,ATP5B、ATP5C1和ATP5A1均为编码线粒体ATP合成酶的亚单位,线粒体ATP合成酶在氧化磷酸化过程中利用跨膜质子的电化学梯度催化ATP合成,柴胡可通过调节这些靶点影响ATP合成酶的生成,增加ATP的生成,从而改善癫痫状态。在“成分-靶标”的关联中(图7),柴胡高极性部位主要成分包括柴胡皂苷C、柴胡皂苷B2与葡萄糖等,这些成分通过影响ATP合成酶、增加ATP的生成最终达到抗癫痫的作用。其次,柴胡可能通过ATP1A1调节离子通道异常在癫痫发作中能量代谢方面发挥了重要作用。1950年至今,细胞外高钾离子浓度一直被认为会导致癫痫放电[41-43]。Na+, K+-ATP酶是一种完整的膜蛋白,负责建立和维持细胞膜上Na和K离子的电化学梯度。ATP1A1编码的蛋白属于P型阳离子转运ATP酶家族,属于Na+, K+-ATP酶亚家族。在本研究中,柴胡能作用于ATP1A1靶点,通过调节Na、K离子梯度,起到改善癫痫的作用。在“成分-靶标”的关联中(图7),柴胡高极性部位主要成分柴胡皂苷类,包括柴胡皂苷A[44]、柴胡皂苷M和柴胡苷元F等,通过影响Na+, K+-ATP酶起到细胞内外的钾钠离子的平衡,最终达到抗癫痫的作用。最后,本研究发现柴胡可能通过调节钙离子通路起到抗癫痫作用。最近研究表明,在癫痫患者中PPP3CA的突变,可能会删除自抑制自动抑制(auto-inhibition,AI)结构域,从而改变钙调磷酸酶(一种钙调节依赖的丝氨酸/苏氨酸蛋白磷酸酶)的活性[45-47]。钙是控制突触质变、分化和兴奋性毒性过程的最重要的胞内信使之一。钙通过天冬氨酸受体(-methyl--aspartate,NMDARs)进入树突状棘是突触传递的长时程增强和长期抑制所必需的[48]。其中钙调磷酸酶是突触囊泡循环的重要调节因子,是控制神经传递的关键过程[49]。PPP3CA编码Ca2+/CaM依赖的蛋白磷酸酶,介导转录因子和离子通道的活性,参与调节T细胞的活化。在本研究中,柴胡能作用于PPP3CA靶点,在“成分-靶标”的关联(图7)中,柴胡高极性部位主要成分脂肪酸类,包括棕榈酸、硬脂酸、油酸等成分,通过调节钙依赖性钙调磷酸酶,来改善突触囊泡循环最终达到抗惊厥的活性。
同时,本研究发现其他和癫痫发作密切相关的通路。帕金森病(Parkinson’s disease,PD)是一种好发于中老年人的神经系统疾病,是继阿尔茨海默病后第2常见的神经退行性疾病,其发病机制涉及线粒体功能障碍、氧化应激、神经炎症等多方面[50]。亨廷顿病(Huntington’s disease)是一种常染色体显性遗传的神经系统变性疾病,主要临床特点为慢性进行性舞蹈样不自主运动、精神障碍及痴呆,其发病机制与神经元线粒体和新陈代谢的异常导致的能量代谢水平下调、轴突传输改变和突触失衡密切相关[51]。帕金森病和亨廷顿病同时与能量代谢异常表现出很高的相关性,而柴胡高极性部位治疗癫痫的靶点也主要集中在能量代谢,这可能是通路富集在帕金森病、亨廷顿病的主要原因。但是对于柴胡是否能通过调节能量代谢来治疗帕金森病与亨廷顿病需要进一步的实验证明。此外,富集通路还包括卵母细胞减数分裂与内分泌系统,应激是癫痫患者癫痫发作的主要诱因,激素水平与癫痫发作密切相关。PTGS2为前列腺素内切酶又称环氧合酶,是前列腺素生物合成中的关键酶;雄激素受体基因(androgen receptor,AR)能调控雄激素应答基因的转录;PGR基因编码类固醇受体超家族的一个成员,编码蛋白介导孕酮的生理效应。柴胡的作用靶点包括PTGS2、AR和PGR,表明柴胡可能通过调节激素水平,维持内环境稳态起到治疗癫痫的作用。
本研究从动物水平筛选出了柴胡抗惊厥活性部位,确定柴胡高极性部位具有显著抗惊厥活性,并借助化学成分分析与中药整合药理学平台结合对药效物质基础和分子机制进行了预测,发现柴胡高极性部位主要通过调节能量代谢通路来抑制癫痫的发生,并通过改善ATP水平起到抗癫痫的作用。为进一步研究提供了方向性指导,其关键有效成分、靶点和通路仍有待进一步研究和验证。
利益冲突 所有作者均声明不存在利益冲突
[1] Collaborative E, Abou-Khalil B, Alldredge B,. The epilepsy phenome/genome project [J]., 2013, 10(4): 568-586.
[2] 邱文娟, 胡小伟, 张正春. 癫痫发病机制及治疗的研究进展 [J]. 中华临床医师杂志: 电子版, 2014, 8(10): 1920-1924.
[3] Kwan P, Brodie M J. Early identification of refractory epilepsy [J]., 2000, 342(5): 314-319.
[4] 黄运生, 陈宝田. 癫痫从肝论治: 柴胡疏肝汤治疗癫痫108例疗效分析 [J]. 实用中医内科杂志, 2005, 19(1): 4-5.
[5] 唐晓军, 徐楠. 柴胡加龙骨牡蛎汤治疗脑卒中后迟发性癫痫的临床观察 [J]. 光明中医, 2009, 24(11): 2139-2140.
[6] 周加信. 柴胡桂枝汤加味治疗小儿癫痫23例 [J]. 中医药信息, 1998, 15(3): 2139.
[7] 周加信, 景红. 小柴胡汤合温胆汤加味治疗小儿癫痫36例 [J]. 齐齐哈尔医学院学报, 2015, 36(3): 385.
[8] 龚素珍, 廖卫平, 郑德枢. 柴胡抗惊厥作用的实验研究 [J]. 广州医学院学报, 1997, 25(1): 24-26.
[9] 刘燕, 廖卫平, 葛发欢. 柴胡有效成分的萃取与抗惊厥作用实验研究 [J]. 中医药学报, 2001, 29(3): 47-49.
[10] 刘燕, 廖卫平, 郭姣, 等. 柴胡三种萃取物的抗惊厥作用研究比较 [J]. 中医药学报, 2002, 30(6): 21-22.
[11] 黄庆晖, 廖卫平, 葛发欢. 超临界CO2萃取物柴胡挥发油的抗惊厥作用 [J]. 中药材, 2002, 25(8): 576-577.
[12] 谢炜. 柴胡皂甙抗实验性癫痫的药效学及其作用机制研究 [D]. 广州: 南方医科大学, 2006.
[13] 余苏云, 陆茵. 中药起效作用机制探讨 [J]. 中国药理学与毒理学杂志, 2018, 32(5): 347-354.
[14] 许海玉, 刘振明, 付岩, 等. 中药整合药理学计算平台的开发与应用 [J]. 中国中药杂志, 2017, 42(18): 3633-3638.
[15] 方欢乐, 别蓓蓓, 穆颖, 等. 基于整合药理学的柴胡-黄芩药对改善COVID-19临床症状的作用机制研究 [J]. 海南医学院学报, 2020, 26(12): 895-900.
[16] 王玉, 杨雪, 靳晓杰, 等. 基于中医药整合药理学平台、GEO数据库芯片及分子对接探讨大黄抗肝癌的作用机制 [J]. 中草药, 2020, 51(20): 5207-5219.
[17] 于华芸, 吴智春, 韩晓春, 等. 基于中药整合药理学计算平台的当归贝母苦参丸治疗前列腺疾病分子机制研究 [J]. 中草药, 2018, 49(19): 4567-4574.
[18] 李晓宇, 徐男, 黄娜娜, 等. 整合药理学方法的心可舒片干预动脉粥样硬化作用网络机制探讨 [J]. 中草药, 2018, 49(15): 3463-3470.
[19] 刘中杰, 李凤仙, 张庆国, 等. 癫痫患者维库溴铵ED95的测定 [J]. 临床麻醉学杂志, 2011, 27(4): 358-359.
[20] 王本国, 廖卫平, 罗爱华, 等. 匹罗卡品癫痫模型及戊四唑点燃模型的行为学、组织学对比研究 [J]. 临床和实验医学杂志, 2006, 5(3): 197-199.
[21] 朱萱萱, 戴兵, 殷坤, 等. 定痫丸对戊四唑点燃癫痫大鼠脑内神经递质含量及海马c-fos表达的影响 [J]. 中华中医药学刊, 2011, 29(3): 468-470.
[22] 谢炜, 郑跃辉, 陈伟军, 等. 柴胡-白芍不同比例配伍应用的抗惊厥作用 [J]. 中国实验方剂学杂志, 2013, 19(18): 184-188.
[23] Racine R J. Modification of seizure activity by electrical stimulation. II. Motor seizure [J]., 1975, 32(3): 269.
[24] 苏娜. 糖类HPLC-MS分析方法及其质谱裂解规律的研究 [D]. 长沙: 湖南师范大学, 2010.
[25] 孙健, 张立富, 范斌, 等. 柴胡皂苷类化学成分的LC-MS分析 [J]. 中国药物警戒, 2012, 9(12): 725-727.
[26] 贺晶, 高晓霞, 田俊生, 等. UPLC-MS 分析柴胡、白芍水煎液的化学成分及其对逍遥散的贡献 [J]. 山西医科大学学报, 2018, 36(4): 49-56.
[27] 刘晓帆, 娄子洋, 朱臻宇, 等. 采用HPLC-TOF/MS对中药复方小柴胡汤中化学成分的快速分析鉴别 [J]. 第二军医大学学报, 2009, 30(8): 941-946.
[28] Shimizu K, Amagaya S, Ogihara Y. New derivatives of saikosaponins [J]., 1985, 33(8): 3349-3355.
[29] Gupta A, Singh R, Purwar C,. Two pentacyclic triterpenes from the stem of[J]., 2003, 42(8): 2030-2033.
[30] 魏晓萌. 锥叶柴胡化学成分及质量控制方法研究 [D]. 北京: 北京中医药大学, 2018.
[31] 刘燕, 吴惠勤, 葛发欢. 柴胡三种萃取物抗惊厥作用有效成分探讨 [J]. 中药材, 2002, 25(9): 635-637.
[32] 孙晓卉, 张量. 柴胡药理作用的研究进展 [J]. 中国医药导报, 2017, 14(10): 52-55.
[33] 梁梅丽. 基于LC-MS代谢组学技术的柴胡石油醚部位抗抑郁的量-效/毒关系研究 [D]. 太原: 山西大学, 2018.
[34] Gao X X, Liang M L, Fang Y,. Deciphering the differential effective and toxic responses offollowing the induction of chronic unpredictable mild stress and in healthy rats based on serum metabolic profiles [J]., 2017, 8: 995.
[35] Liu J L, Fang Y, Yang L,. A qualitative, and quantitative determination and pharmacokinetic study of four polyacetylenes fromby UPLC-PDA-MS [J]., 2015, 111: 257-265.
[36] 谢云, 唐月月, 魏晶晶, 等. 地西泮对焦虑、抑郁小鼠体重、痛阈和自主活动的影响 [J]. 中国药理学通报, 2010, 26(11): 1529-1530.
[37] 文静, 徐小林, 戴体俊. 多次注射地西泮对小鼠体重、自主活动及学习记忆能力的影响 [J]. 徐州医学院学报, 2008, 28(1): 13-14.
[38] Finsterer J. Treatment of central nervous system manifestations in mitochondrial disorders [J]., 2011, 18(1): 28-38.
[39] Bindu P S, Sonam K, Govindaraj P,. Outcome of epilepsy in patients with mitochondrial disorders: Phenotype genotype and magnetic resonance imaging correlations [J]., 2018, 164: 182-189.
[40] Wolf N I, Bast T, Surtees R. Epilepsy in inborn errors of metabolism [J]., 2005, 7(2): 67-81.
[41] Feldberg W, Sherwood S L. Effects of calcium and potassium injected into the cerebral ventricles of the cat [J]., 1957, 139(3): 408-416.
[42] Bøttger P, Doğanlı C, Lykke-Hartmann K. Migraine- and dystonia-related disease-mutations of Na+/K+-ATPases: Relevance of behavioral studies in mice to disease symptoms and neurological manifestations in humans [J]., 2012, 36(2): 855-871.
[43] Benarroch E E. Glutamate transporters: Diversity, function, and involvement in neurologic disease [J]., 2010, 74(3): 259-264.
[44] Yu Y H, Xie W, Bao Y,. Saikosaponin a mediates the anticonvulsant properties in the HNC models of AE and SE by inhibiting NMDA receptor current and persistent sodium current [J]., 2012, 7(11): e50694.
[45] Myers C T, Stong N, Mountier E I,. De novo mutations in PPP3CA cause severe neurodevelopmental disease with seizures [J]., 2017, 101(4): 516-524.
[46] Mizuguchi T, Nakashima M, Kato M,. Loss-of-function and gain-of-function mutations in PPP3CA cause two distinct disorders [J]., 2018, 27(8): 1421-1433.
[47] Qian Y Y, Wu B B, Lu Y L,. Early-onset infant epileptic encephalopathy associated with a de novogene mutation [J]., 2018, 4(6): a002949.
[48] Grewer C, Rauen T. Electrogenic glutamate transporters in the CNS: Molecular mechanism, pre-steady-state kinetics, and their impact on synaptic signaling [J]., 2005, 203(1): 1-20.
[49] Sibarov D A, Antonov S M. Calcium-dependent desensitization of NMDA receptors [J]., 2018, 83(10): 1173-1183.
[50] 游静, 顾乔乔, 余子云, 等. 帕金森病发病机制的研究进展 [J]. 赣南医学院学报, 2019, 39(7): 733-737.
[51] 沈原, 赵永波. 亨廷顿病发病机制的研究进展 [J]. 国际神经病学神经外科学杂志, 2010, 37(1): 70-72.
Antiepileptic effect and mechanism of different parts ofby integrative pharmacology
WANG Peng, GAO Xiao-xia, GAO Yao, XU Wen-qian, FENG Yan, LI Zhen-yu, QIN Xue-mei
Modern Research Center of Traditional Chinese Medicine, Shanxi University, Taiyuan 030006, China
To investigate the major active components and potential molecular mechanism ofin treatment of epilepsy.The activity-tracking method was used to obtain the anticonvulsant active parts ofby investigating the effects of three different polar sites on pentylenetetrazol (PTZ) kindled seizures in the rat. And the LC-MS technology was used to fully characterize the chemical components of the anticonvulsant active parts of. The protein targets related with epilepsy were collected by integrated pharmacology method and the interaction network of potential targets ofand epilepsy disease targets was constructed to illustrate the molecular mechanism.By screening for model dosage, 55.18 mg/kg PTZ was selected to establish the model. The time of clonic latency and tonic latency significantly was prolonged and number of convulsions significantly reduced in rats after high-polar fraction of(20 g/kg) treatment. A total of 32 chemical components was identified with the positive and negative ion mode, primarily including saikosaponins, fatty acids, sugars and coumarins, etc. A total of 22 key targets were screened. The main targets of disease and drug were ATP5A1, ATP5B, ATP1A1, ATP5C1, PPP3CA, PTGS2, AR, etc, which mainly related to Parkinson’s disease, energy metabolism, Huntington’s disease, oocyte meiosis, neurodegenerative diseases and other pathways. Furthermore, the keystone node in energy metabolism was validated by determining ATP content of hippocampus and liver, and the result showed that the decrease of ATP content in hippocampus and liver induced by epilepsy was significantly reversed by the high-polar fraction of.The high-polar fraction ofhas anticonvulsant activity, it inhibited the occurrence and development of seizures mainly by regulating energy metabolism. And saikosaponins and flavonoids mainly regulated energy metabolism by improving ATP content, which may be the main mechanism for the treatment of epilepsy with.
; pentylenetetraol; epilepsy; integrative pharmacology; energy metabolism
R285
A
0253 - 2670(2021)07 - 2024 - 15
10.7501/j.issn.0253-2670.2021.07.020
2020-09-11
国家自然科学基金资助项目(81473415);国家重点研发计划课题项目(2019YFC1710800);山西省应用基础研究项目杰出青年基金资助项目(201701D211009);国家国际科技合作专项(2017ZX09301-047);山西省重点研发计划(社会发展方面)项目(201803D31019);地产中药功效物质研究与利用山西省重点实验室(201605D111004)
王 鹏(1994—),男,湖北天门人,博士研究生,研究方向为中药药动学研究。Tel: 18406592715 E-mall: wp18406592715@outlook.com
高晓霞,女,教授,博士生导师,主要从事中药药动学研究。Tel: (0351)7019297 E-mail: gaoxiaoxia@sxu.edu.cn
秦雪梅,女,教授,博士生导师,主要从事中药质控、评价与代谢组学研究。Tel: (0351)7011202 E-mail: qinxm@sxu.edu.cn
[责任编辑 潘明佳]

