基于网络药理学探讨清肝化瘀颗粒治疗肝癌的作用机制
曹 建,朱晓燃,杨振寰,索菲娅,姚树坤, , 3*
基于网络药理学探讨清肝化瘀颗粒治疗肝癌的作用机制
曹 建1,朱晓燃2,杨振寰2,索菲娅2,姚树坤1, 2, 3*
1. 北京航空航天大学生物与医学工程学院,北京 100191 2. 北京中医药大学,北京 100029 3. 中日友好医院 消化内科,北京 100029
探讨清肝化瘀颗粒治疗肝癌的有效成分、作用靶点及可能作用机制。通过中药与疾病数据库,运用网络药理学工具筛选清肝化瘀颗粒治疗肝癌的主要有效成分与作用靶点,分析作用靶点的分子机制,构建“中药-成分-靶点-疾病”关系网络。采用体内外实验验证清肝化瘀颗粒核心有效成分苦参碱对肝癌细胞学行为的作用,并检测苦参碱对核心靶点及主要信号通路的调节作用。共筛选出清肝化瘀颗粒治疗肝癌的潜在作用靶点86个,富集分析结果显示作用靶点共涉及生物过程20种,细胞组成15种,分子功能20种,以及信号通路20条。利用构建的“中药-成分-靶点-疾病”网络发现清肝化瘀颗粒主要通过槲皮素、木犀草素及苦参碱对肿瘤蛋白p53(tumor protein p53,TP53)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)及G1/S期特异细胞周期蛋白D1(G1/S-specific cyclin D1,CCND1)等核心靶点参与细胞凋亡及细胞自噬等与肝癌有关的肿瘤生物学行为发挥治疗肝癌的作用。体外实验发现,清肝化瘀颗粒有效成分苦参碱以剂量相关的方式抑制肝癌细胞的增殖,促进肝癌细胞凋亡,并能调节肝癌细胞氧化应激胁迫标志物,同时可对TP53、VEGFA及CCND1等核心靶点的表达量进行调节。肝癌荷瘤裸鼠实验发现苦参碱对人肝癌细胞HepG2荷瘤裸鼠具有抑瘤作用,并诱导肝癌细胞凋亡,同时能调节线粒体自噬及线粒体分裂2种线粒体稳态调节过程相关蛋白的表达量。清肝化瘀颗粒治疗肝癌的主要机制包括以槲皮素、木犀草素及苦参碱为代表的多成分,以TP53、VEGFA及CCND1为代表的多靶点,以细胞凋亡、线粒体稳态及氧化应激为代表的多通路调节的系统性、协同性作用。
网络药理学;清肝化瘀颗粒;肝癌;苦参碱;分子机制;槲皮素;木犀草素
肝癌目前已经成为世界范围内第6大常见癌症,其致死率位居全球第4[1]。我国是肝癌大国,在全球肝癌的发病中,肝癌的发病率为46.6%,病死率为47.1%[2]。在我国肝癌的年龄标准化的5年生存率仅为12.1%[3],因此,我国的肝癌防治工作在全球肝癌的防治工作中占据举足轻重的位置。肝癌起病隐匿,致死率高,大多数患者在发现时已进展至中晚期,其发病率与死亡率之比接近1,在全世界范围内造成了广泛的医疗负担与社会负担[4]。外科手术切除目前仍是肝癌患者的最佳治疗手段,但是这种治疗手段对肝癌患者所处的分期与肝脏功能要求较高,且受到远期疗效与复发风险的局限[5]。因此,继续探索与研发有效的肝癌治疗策略很有必要。
随着我国中医药学的发展,传统中医药参与到癌症临床治疗的各个阶段[6],发挥着减轻治疗手段的毒副反应、提高癌症治疗效果、延长癌症患者生存期、提高癌症患者治疗后生存质量等重要作用[7-8]。清肝化瘀颗粒是本课题组将多年肝癌临证经验总结的经验方,由黄芩、苦参、白术、莪术、白花蛇舌草、半枝莲、三棱及甘草8味中药组成[9],临床实践显示出较好的肝癌治疗效果[10],前期的临床前研究也揭示了其在抑制肝癌细胞增殖中可能的细胞学与分子生物学机制[11-12]。清肝化瘀颗粒组方有效成分众多,作用靶点与靶信号通路相互作用机制复杂,其在抑制肝癌中的具体分子机制尚待阐明。本研究利用网络药理学工具预测了清肝化瘀颗粒治疗肝癌的潜在有效成分、作用靶点及信号通路,并通过体内外实验进一步验证了清肝化瘀颗粒主要有效成分苦参碱的作用及其对核心靶点的调节作用,旨在揭示清肝化瘀颗粒在肝癌中发挥治疗效果的可能有效成分及其分子机制,为其进一步的临床前研究及临床应用提供依据。
1 材料与方法
1.1 清肝化瘀颗粒治疗肝癌靶点的收集与筛选
利用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php,version2.3)[13]进行数据挖掘,收集清肝化瘀颗粒组方8味中药的有效成分与作用靶点。通过对既往中药活性成分的药物代谢动力学研究结果分析[14],本研究将人体口服生物利用度(oral bioavailability,OB)≥30%,药物相似性(drug-likeness,DL)≥0.18,肠上皮Caco-2细胞渗透性>0 nm/s,半衰期(half-time,HL)≥4 h,氢键供体数目(Hdon)<5个及氢键受体数目(Hacc)<10个设置为有效成分的筛选参数。
同时利用肝癌数据库OncoDB.HCC(http:// oncodb.hcc.ibms.sinica.edu.tw/index.htm)[15]及Liverome(http:// liverome.kobic.re.kr/index.php)[16]中的肝癌基因组数据对肝癌相关靶点进行搜集与筛选。基于实验设计,本研究纳入OncoDB.HCC数据库中的所有靶点及Liverome数据库中差异表达谱证据≥5条的靶点作为肝癌疾病靶点。
将以上两者预测的靶点结果取交集,进一步确认清肝化瘀颗粒治疗肝癌的作用靶点。基于此作用靶点集合,运用STRING(https://string-db.org/,version 11.0)及Cytoscape(version 3.7.2)软件进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建,利用MCODE插件构建PPI网络中的分子相互作用模块,根据实验设计,筛选条件设置为度值临界值(degree cutoff)=2,K核(K-core)=2。同时利用CytoHubba插件对PPI网络中核心靶点进行研究,根据实验设计,本研究选择最大团中心性(maximal clique centrality,MCC)算法获取核心靶点信息并按照重要度大小对其进行排序。
将筛选得到的作用靶点导入Metascape数据库,设定参数为最小重叠度(min overlap)=3,P临界值(P cutoff)=0.01,最小富集度(min enrichment)=1.5,对作用靶点进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)及基因本体(gene ontology,GO)富集分析,并使用R语言(version 3.0.6)中的ggplot2(version 3.3.0)程序包对富集分析的结果进行可视化,利用KEGG数据库对靶向信号通路示意图进行绘制。
1.2 中药-成分-靶点-疾病网络构建与分析
将所获得的清肝化瘀颗粒组方中药的有效成分及所获取的作用靶点与信号通路分别导入Cytoscape软件,构建网络图并利用网络分析(network analyzer)功能对网络图的特征进行分析,并获取主要有效成分及核心靶点信息。
1.3 分子生物学实验验证
1.3.1 材料 HepG2细胞系购自中国科学院典型培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心;分析纯级苦参碱(货号M5319)购自Sigma-Aldrich公司。
1.3.2 细胞模型构建与细胞培养 将HepG2细胞以含10%胎牛血清(购自GIBCO,货号10270-106)的RPMI 1640培养基(购自GIBCO,货号11875093)置于37 ℃、5% CO2细胞培养箱中进行常规传代培养。
1.3.3 CCK-8细胞活力检测 使用Cell Counting Kit-8(购自Dojindo,日本,CK04)进行CCK-8细胞活力检测。收集对数生长期细胞,按3×103个/孔的密度接种于96孔细胞培养板,待细胞贴壁后使用等量的不同浓度的苦参碱(1、5、10 nmol/L)给药并继续培养12 h,同时设置等量的不含苦参碱培养基处理的细胞作为对照组。每组设置3个重复孔。中止培养后,每个培养孔加入CCK-8溶液10 μL,避免引入气泡,同时设置不加细胞,仅添加不同浓度药物及CCK-8溶液的培养孔作为空白组。在培养箱中孵育4 h,将培养板置于酶标仪上,于450 nm处测定各孔的吸光度(),并按照下述公式计算细胞的生存率。同时确定苦参碱对HepG2细胞的最小抑制浓度。
细胞生存率=(苦参碱-空白)/(对照-空白)
1.3.4 细胞凋亡检测 使用Annexin V,FITC Apoptosis Detection Kit(购自Donjindo,日本,AD10)进行细胞凋亡检测。肝癌细胞的收集与接种按照“1.3.3”项下方法进行,实验分为4组,分别为对照组(等量的不含苦参碱的培养基处理)、苦参碱组(给药浓度采用“1.3.3”项下确定的苦参碱对HepG2细胞的最小抑制浓度)、苦参碱联合细胞凋亡抑制剂z-VAD-FMK组(z-VAD-FMK浓度为10 μmol/L,苦参碱给药浓度与苦参碱组相同)、z-VAD-FMK组(仅添加10 μmol/L z-VAD-FMK)。收集细胞后加入10倍体积的Annexin V结合溶液,重悬细胞使细胞终浓度为1×106个/mL。吸取100 μL细胞悬液加入到新的流式管中,加入5 μL Annexin,FITC聚合物,随后加入5 μL PI溶液。室温条件下,避光,孵育15 min,在流式管中加入10倍体积的Annexin V结合溶液,在流式细胞仪中上机检测。
1.3.5 细胞氧化应激标志物检测 使用总谷胱甘肽(glutathione,GSH)检测试剂盒(购自碧云天生物技术有限公司,批号S0052)及总超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒(购自碧云天生物技术有限公司,批号S0101)进行细胞氧化应激标志物检测。肝癌细胞的收集与接种按照“1.3.3”项下方法进行,苦参碱组给药浓度为1、5 nmol/L,同时设置等量的不含苦参碱的培养基处理的HepG2细胞作为对照组。收集细胞后按照试剂盒说明书进行细胞裂解、检测体系构建及后续反应,最后分别在酶标仪412 nm及450 nm处记录并计算GSH及SOD的活性变化程度。
1.3.6 ELISA法检测血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)含量 使用VEGFA定量检测试剂盒(购自R&D SYSTEMS,SVE00)进行VEGFA检测。肝癌细胞的收集、接种及给药按照“1.3.5”项下方法进行。收集细胞后按照试剂盒说明书进行细胞裂解、检测体系构建及后续反应,中止反应后将反应体系置于酶标仪450 nm处测定并计算VEGFA的含量。
1.3.7 Western blotting检测相关蛋白水平 肝癌细胞的收集、接种及给药按照“1.3.3”项下方法进行。各组细胞提取总蛋白后,利用二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(购自Solarbio,PC0020)对其浓度进行测定。使用浓度为10%的SDS-PAGE蛋白电泳后将目的条带转移至醋酸纤维膜上。使用一抗在4 ℃下孵育过夜后,用TBST缓冲液清洗3次,与二抗室温下孵育1 h。使用化学发光法对凝胶图像进行显影及定影,并进行扫描存档。本研究中使用的第一抗体信息:抗肿瘤蛋白p53(tumor protein p53,TP53)抗体(Abcam,ab26),抗G1/S期特异细胞周期蛋白D1(G1/S-specific cyclin D1,CCND1)抗体(Abcam,ab16663);内参蛋白第一抗体信息:抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(CST,5174);第二抗体信息:羊抗鼠-辣根过氧化物酶(Horseradish Peroxidase,HRP)(CST,7076),羊抗兔-HRP(CST,7074)。
1.4 肝癌细胞移植瘤动物模型实验验证
1.4.1 肝癌细胞移植瘤动物模型的建立、分组与给药 雄性SPF级BALB/C裸鼠,6周龄,实验开始时体质量(17.6±2.3)g,购自北京华阜康生物科技股份有限公司,动物生产许可证号:SCXK(京)2019-0008。所有裸鼠分笼饲养于中日友好医院临床研究所SPF级动物实验平台,采用12 h光/暗周期,自由摄食饮水,实验开始前适应性饲养1周,取材前12 h禁食。肝癌细胞移植瘤动物模型的建立与分组参考朱丹丹等[17]的方法,随机分为对照组和苦参碱给药组,每组各5只。收集对数生长期的HepG2人肝癌细胞,调整浓度至5×107个/mL,使用一次性注射器将细胞sc至裸鼠右侧腋窝,0.1 mL/只,连续10 d,瘤块长至约5 mm×5 mm×5 mm认为造模成功。对照组ip生理盐水1 mL,1次/d,参考朱丹丹等[17]前期的研究结果,苦参碱给药组用药剂量为50 mg/kg,ip 1.0 mg/mL苦参碱溶液1 mL,1次/d。连续给药28 d。
1.4.2 移植瘤瘤体HE染色病理检查 将裸鼠瘤块剥离后置于标记编号的包埋盒中,利用乙醇逐级脱水,二甲苯透明,并于58~60 ℃的石蜡中浸蜡,包埋,4 ℃过夜后置于切片机上,厚度调整为4 μm,连续切片,60 ℃烤片后脱蜡,使用苏木素及0.5%伊红染液染色,利用中性树胶封片后置于显微镜下采集图像。
1.4.3 移植瘤瘤体TUNEL染色法检测细胞凋亡 石蜡切片脱蜡后利用PBS溶液漂洗3次,并将切片置于煮沸的抗原修复液中修复抗原10 min,冷却至室温后加入100 μL蛋白酶K,湿盒中透明20 min,PBS漂洗后于3% H2O2溶液中孵育封闭10 min,加入100 μL阳性片孵育液,37 ℃湿盒孵育30 min,滴加50 μL标记反应液,37 ℃湿盒孵育90 min,加入PI染液50 μL,室温反应5 min,60 ℃烘箱中干燥后,使用含DAPI的抗荧光猝灭封片剂封片,置于显微镜下采集图像。
1.4.4 免疫组化及Western blotting法检测苦参碱对肝癌荷瘤裸鼠瘤体线粒体稳态相关分子的表达水平 石蜡切片脱蜡后利用PBS溶液漂洗3次,并将切片置于煮沸的抗原修复液中修复抗原10 min,使用免疫组化笔圈定待测组织区域,区域内加100 μL的3%H2O2,孵育10 min,加入100 μL封闭液,室温条件下于湿盒中孵育1 h,加入一抗后,4 ℃湿盒中孵育过夜,PBS冲洗后加入二抗,室温条件下湿盒中孵育1 h,以1∶100的体积比加入适量HRP标记的链霉亲和素,室温湿盒中孵育30 min,加入100 μL新鲜配制的DAB显色液,室温孵育7 min,加入苏木素染色液染色7 min,随后放入自来水10 min进行返蓝,置于60 ℃烘箱中干燥后封片并置于显微镜下拍照。Western blotting实验方法采用“1.3.7”项下方法。第一抗体信息:抗MST1抗体(Genetex,GTX109294),抗Parkin抗体(Bioworld,BS91016),抗哺乳动物不育系20样激酶1(mammalian sterile 20-like kinase 1,MST1)抗体(Genetex,GTX109294),抗磷酸化的c-Jun氨基末端激酶(p-c-Jun-terminal kinase,p-JNK)抗体(CST,4668T),抗PTEN诱导的激酶1(PTEN-induced kinase 1,PINK1)抗体(Bioworld,BS91075),抗Parkin抗体(Bioworld,BS91016);第二抗体信息:羊抗兔IgG(H+L)HRP(Bioworld,BS13278),羊抗兔-HRP(CST,7074)。
1.5 数据处理
2 结果
2.1 清肝化瘀颗粒治疗肝癌靶点获取及“中药-成分-靶点-疾病”网络构建
本研究经数据挖掘得到清肝化瘀颗粒有效成分161种,其中重复成分17种,包含于2味中药的重复成分12种,包含于3味中药的重复成分2种,包含于4味中药的重复成分3种。同时获得上述有效成分对应的靶点276个。利用肝癌数据库Liverome及OncoDB.HCC数据库共收集得到994个肝癌疾病靶点。将获得的清肝化瘀颗粒有效成分作用靶点及肝癌疾病靶点相互映射,得到86个交集靶点,即为清肝化瘀颗粒治疗肝癌潜在作用靶点。将共有靶点所对应的中药、有效成分与对应的疾病信息导入Cytoscape软件构建“中药-成分-靶点-疾病”网络图(图1)。
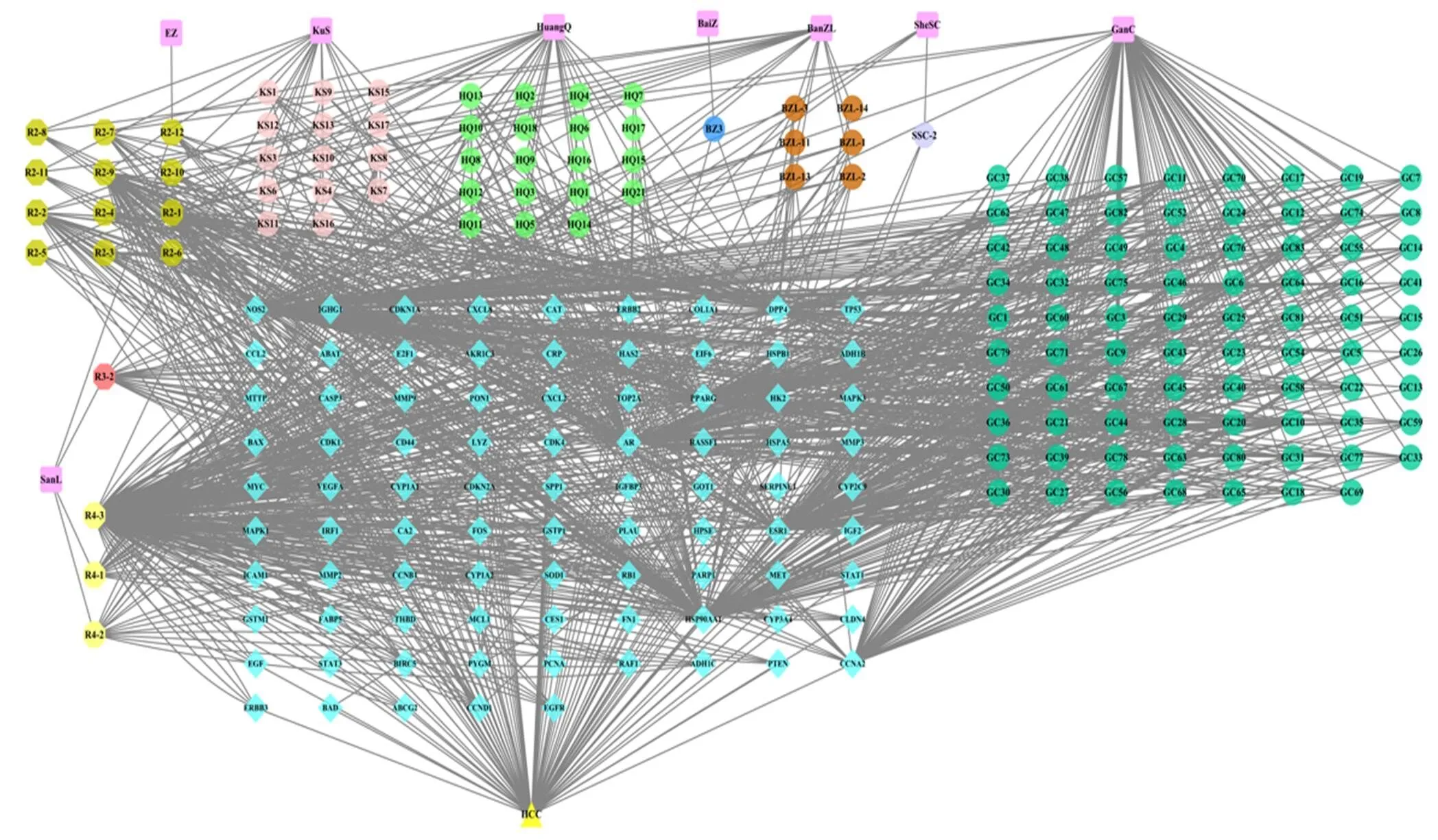
KuS-苦参 BanZL-半枝莲 HuangQ-黄芩 BaiZ-白术 SheSC-白花蛇舌草 GanC-甘草 SanL-三棱 Ezh-莪术 HCC-肝癌
“中药-成分-靶点-疾病”网络包括中药节点8个(图中以正方形显示),组方中药有效成分节点136个(图中以圆形显示),靶点节点86个(图中以菱形显示),疾病节点1个(图中以三角形显示),以及1299种“中药-成分-靶点-疾病”对应关系(图中以黑色直线显示)。在中药水平,对应有效成分数目由多到少的中药分别为甘草(83种有效成分)、黄芩(28种有效成分)、苦参(20种有效成分)、半枝莲(18种有效成分)、白花蛇舌草及三棱(各4种有效成分)、白术及莪术(各1种有效成分)。在化合物水平,按对应治疗肝癌的靶点数目由多到少的化合物有槲皮素(对应59个靶点),木犀草素(对应24个靶点)及苦参碱(对应16个靶点)等。在靶点蛋白层面,连接化合物数目较高的靶点有9×104热休克蛋白αA1(HSP90AA1,对应有效成分105种)、TP53(对应有效成分93种)及VEGFA(连接化合物数目60种)等,86个靶点节点中,有46个节点与2个及2个以上的化合物相连接,占全部靶点的53.5%。清肝化瘀颗粒组方中药治疗肝癌作用靶点蛋白数目如下:苦参治疗肝癌靶点数目为70个(占苦参预测靶点总数的34.8%,下同),黄芩31个(25.2%),白术2个(10.5%),莪术4个(18.2%),半枝莲72个(32.3%),白花蛇舌草62个(33.9%),三棱15个(18.8%),甘草75个(32.8%)。该网络中,每味中药对应平均靶点数目为10.75,每种中药成分对应的平均靶点数量0.63,每个靶点平均对应成分1.58个。
2.2 清肝化瘀颗粒治疗肝癌核心靶点的筛选与分析
利用STRING数据库及MCODE和cytoHubba插件对清肝化瘀颗粒治疗肝癌作用靶点PPI网络中的核心靶点进行筛选。如图2所示,在PPI网络中,评分较高的核心靶点有TP53、CCND1、VEGFA、原癌基因蛋白c-myc(proto-oncogene protein c-myc,MYC)及信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)等,以上作用靶点均为PPI网络中度值较高且受到多味中药及有效成分调节的靶点蛋白。
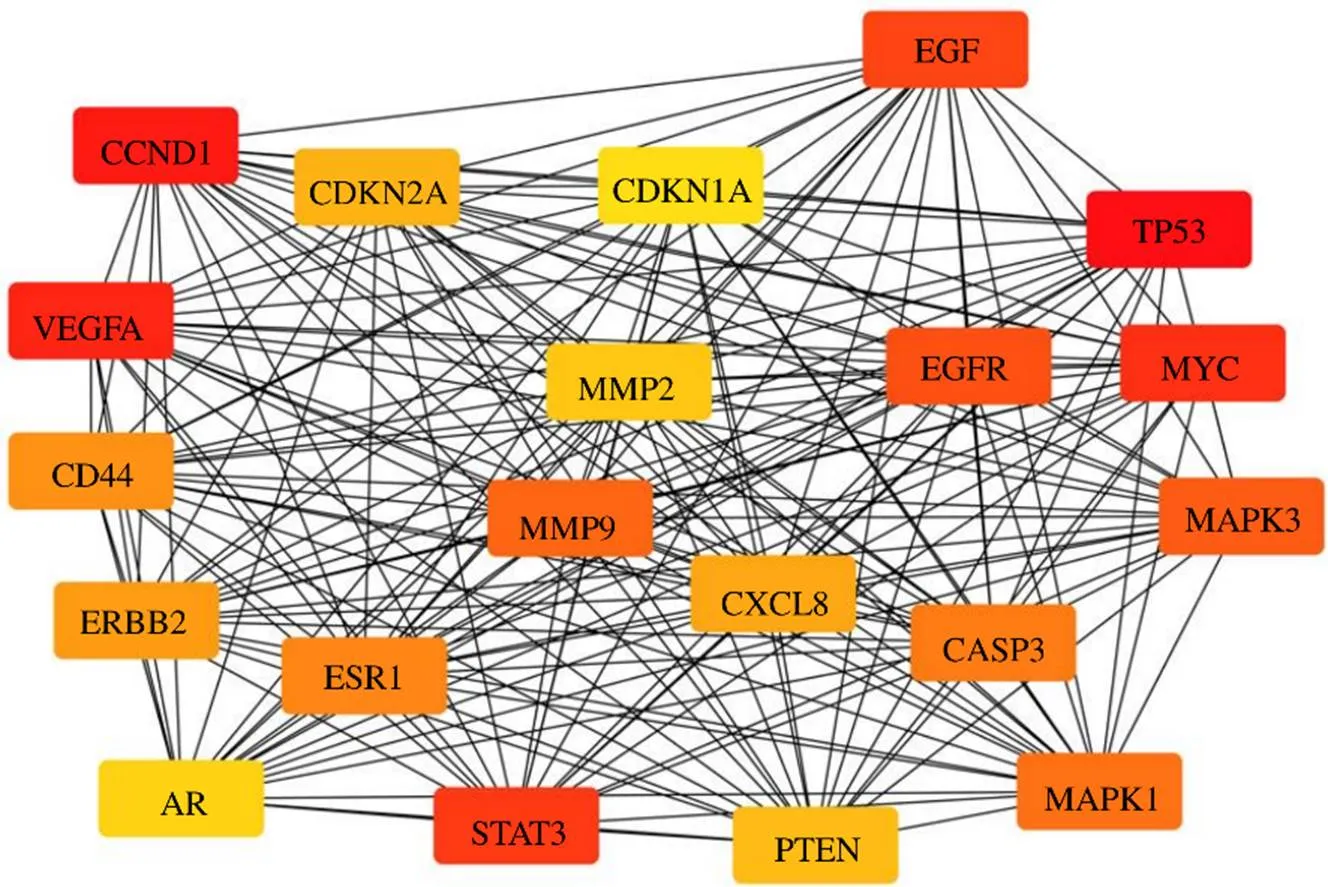
图2 清肝化瘀颗粒治疗肝癌的核心靶点网络
2.3 清肝化瘀颗粒治疗肝癌作用靶点的生物学过程分析
利用在线生物信息学数据库Metascape对得到的清肝化瘀颗粒治疗肝癌作用靶点基因进行GO功能注释分析。如图3所示,GO生物学途径分析得到20个条目,分别为细胞因子介导的信号通路(29个靶点参与)、氧含量响应途径(23个靶点参与)及细胞凋亡信号通路(20个靶点参与)等。GO细胞组分分析共得到15个条目,分别为细胞周期蛋白依赖性蛋白激酶全酶复合物(8个靶点参与)、内质网腔(7个靶点参与)及线粒体膜(10个靶点参与)等。GO分子功能分析共得到20个条目,分别为激酶结合功能(21个靶点参与)、激酶调节活性(12个靶点参与)及泛素样蛋白连接酶结合功能(9个靶点参与)等。KEGG代谢信号通路富集分析得到20个条目,分别为癌症相关通路(34个靶点参与)、含铂类药物耐药性相关通路(13个靶点参与)及P53信号通路(12个靶点参与)等。
根据本课题的研究内容,选取了肿瘤相关通路(pathways in cancer,hsa05200)、肝癌相关信号通路(hepatocellular carcinoma,hsa05225)、细胞凋亡信号通路(apoptosis,hsa04210)、动物细胞自噬信号通路(autophagy-animal,hsa04140)及动物细胞线粒体自噬信号通路(mitophagy-animal,hsa04137)5条信号通路,利用KEGG考察了清肝化瘀颗粒治疗肝癌靶点参与以上信号通路的调节机制。结果表明清肝化瘀颗粒治疗肝癌靶点可以通过调节多条信号通路诱导肿瘤细胞发生细胞凋亡,并对肝癌细胞过度增殖、血管新生、基因组不稳定、细胞分化阻遏及去分化状态维持等细胞学行为进行抑制。同时对肝细胞从氧化应激胁迫、慢性炎症、肝纤维化、肝硬化、肝癌癌前病变、早期肝癌、中期肝癌及转移型肝癌各个阶段的细胞学行为进行调节。此外,清肝化瘀颗粒治疗肝癌靶点可以对肝癌细胞的自噬,特别是线粒体自噬进行有效调节。
2.4 苦参碱对肝癌HepG2细胞生存率的影响
为了验证网络药理学实验筛选的治疗肝癌主要有效成分的可靠性,首先查阅了本课题前期初步构建的清肝化瘀颗粒指纹图谱[9],并在指纹图谱中验证了槲皮素、木犀草素及苦参碱的存在。以上结果初步验证了网络药理学实验筛选的清肝化瘀颗粒治疗肝癌的主要有效成分的预测结果。
苦参作为君药在清肝化瘀颗粒组方中扮演着清热燥湿、泻火解毒的重要药理学作用,在网络药理学研究中发现苦参为清肝化瘀颗粒组方8味中药中对应有效成分数目及靶点数目最多的君药,而苦参碱则是对应靶点数目较多的有效成分之一,且在清肝化瘀颗粒组方中为苦参中独有有效成分。既往研究也表明苦参及苦参碱在肝癌的治疗中发挥重要的药理学作用[18]。因此,推测苦参及苦参碱在清肝化瘀颗粒抗肝癌的作用机制中发挥重要作用,为了验证网络药理学实验预测的清肝化瘀颗粒治疗肝癌的主要有效成分及分子机制的可靠性,本实验选取苦参碱作为主要有效成分代表进行了细胞模型实验验证。使用不同浓度的苦参碱处理HepG2细胞12 h后采用CCK-8实验考察细胞的生存率。结果表明,5、10 nmol/L苦参碱处理后,HepG2细胞的生存率分别为对照组的81.2%、62.4%,提示与对照组相比,苦参碱可以显著降低HepG2细胞的生存率,且存在剂量相关性。实验结果同时表明1 nmol/L苦参碱对于HepG2细胞无细胞毒性,生存率为对照组的98.3%,与对照组相比无显著差异。苦参碱对HepG2细胞的最小抑制浓度为5 nmol/L。因此,选择5 nmol/L剂量的苦参碱作为肝癌细胞模型后续实验处理浓度。
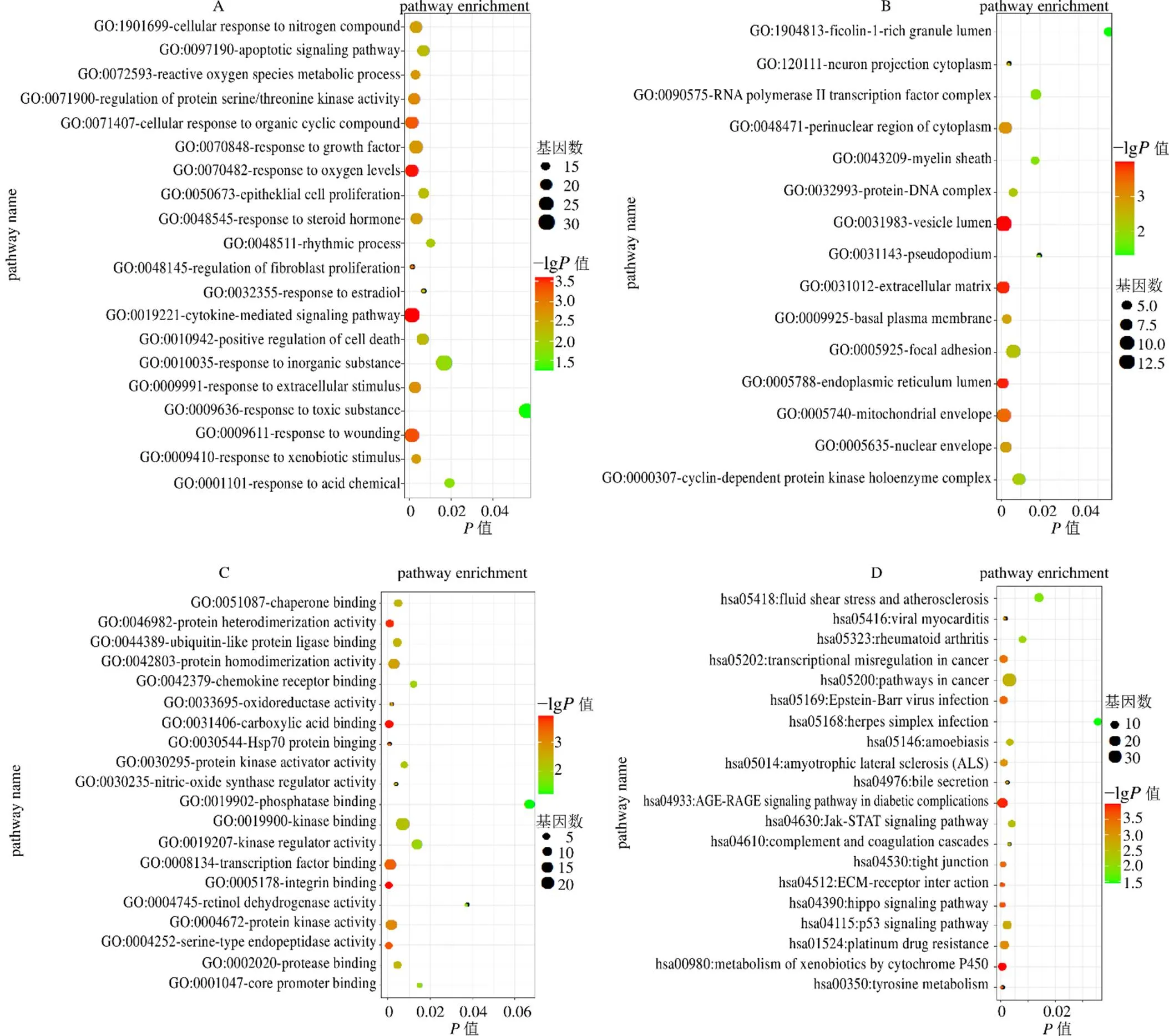
图3 清肝化瘀颗粒治疗肝癌作用靶点的GO-生物学过程分析(A)、GO-细胞组分分析(B)、GO-分子功能分析(C) 和KEGG富集分析(D)
2.5 苦参碱对肝癌HepG2细胞凋亡的影响
采用Annexin V-FITC/PI双染法检测苦参碱处理肝癌HepG2细胞后细胞凋亡的变化情况。结果如图4所示,对照组HepG2细胞中细胞凋亡率为4.9%(图4-A),5 nmol/L苦参碱处理HepG2细胞后细胞凋亡率与对照组相比显著提高,达到20.2%(图4-C),而细胞凋亡抑制剂z-VAD-FMK处理可以显著抑制苦参碱诱导的HepG2细胞凋亡,凋亡率下调至6.2%(图4-D)。以上结果表明,苦参碱可以在肝癌HepG2细胞中诱导线粒体依赖的内源性细胞凋亡。
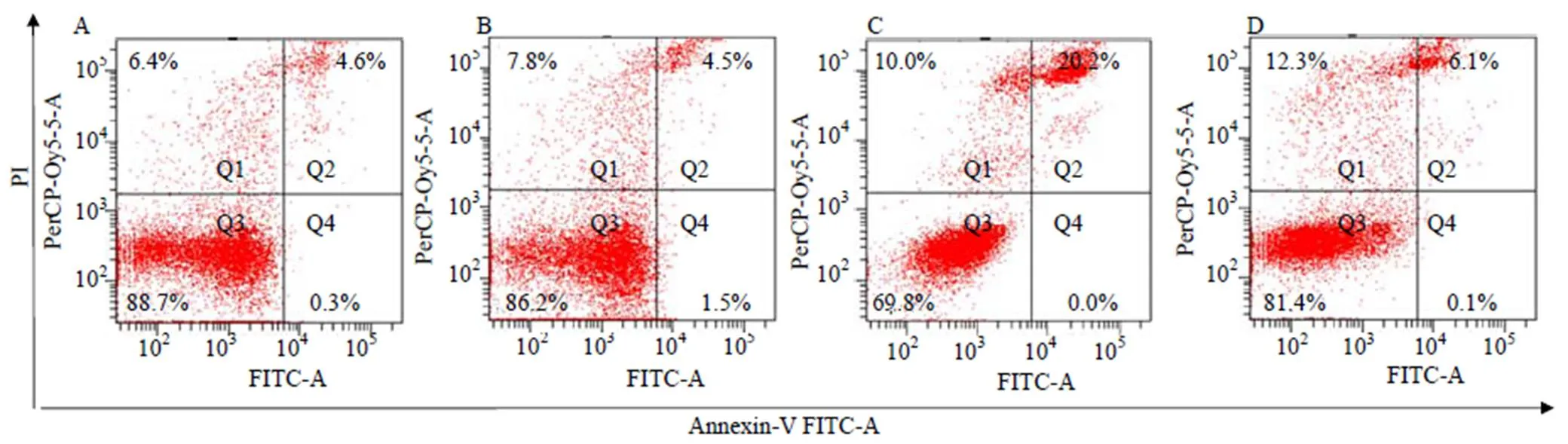
A-对照组 B-z-VAD-FMK组 C-苦参碱组 D-苦参碱联合z-VAD-FMK组
2.6 苦参碱对肝癌HepG2细胞氧化应激标志物的影响
使用苦参碱作用于肝癌HepG2细胞12 h后,利用试剂盒检测细胞体内的氧化应激标志物的变化。结果发现浓度为5 nmol/L的苦参碱处理后,细胞内氧化应激标志物GSH的浓度下调至23.9 nmol/mg(以蛋白量计,下同),而对照组中GSH的浓度为51.5 nmol/mg,提示苦参碱可以显著下调肝癌HepG2细胞中GSH浓度。此外,5 nmol/L苦参碱处理后,另一种氧化应激标志物SOD的浓度下调至4.10 U/mg,而对照组SOD的浓度则为8.62 U/mg,提示苦参碱可以显著下调肝癌HepG2细胞中SOD的水平。而浓度为1 nmol/L苦参碱处理的肝癌细胞中,氧化应激标志物无显著变化(GSH浓度为49.4 nmol/mg,SOD浓度为8.40 U/mg)。这一部分的实验结果说明苦参碱处理后,肝癌细胞模型中出现氧化应激胁迫,而苦参碱诱导的线粒体依赖性细胞凋亡可能与氧化应激胁迫环境的出现有关。
2.7 苦参碱对肝癌HepG2细胞中VEGFA含量的影响
利用ELISA法检测苦参碱处理肝癌HepG2细胞12 h后,其中VEGFA的含量变化。结果表明,与对照组相比,5 nmol/L苦参碱处理后,肝癌细胞HepG2中的VEGFA水平显著下调,下调倍数为2.4倍,而浓度为1 nmol/L苦参碱在肝癌细胞中对VEGFA水平无影响。
2.8 苦参碱对肝癌HepG2细胞中TP53及CCND1表达量的影响
利用Western blotting法检测苦参碱处理12 h肝癌HepG2细胞中TP53及CCND1的表达量变化。结果如图5所示,与对照组相比,HepG2细胞在5、10 nmol/L苦参碱处理后TP53蛋白的表达量显著提高(<0.05),上调倍数分别为3.4倍与3.1倍;CCND1蛋白的表达量则显著下调(<0.01),下调幅度分别为83.9%、83.8%。而浓度为1 nmol/L苦参碱对肝癌HepG2细胞中2种蛋白的表达量无影响。
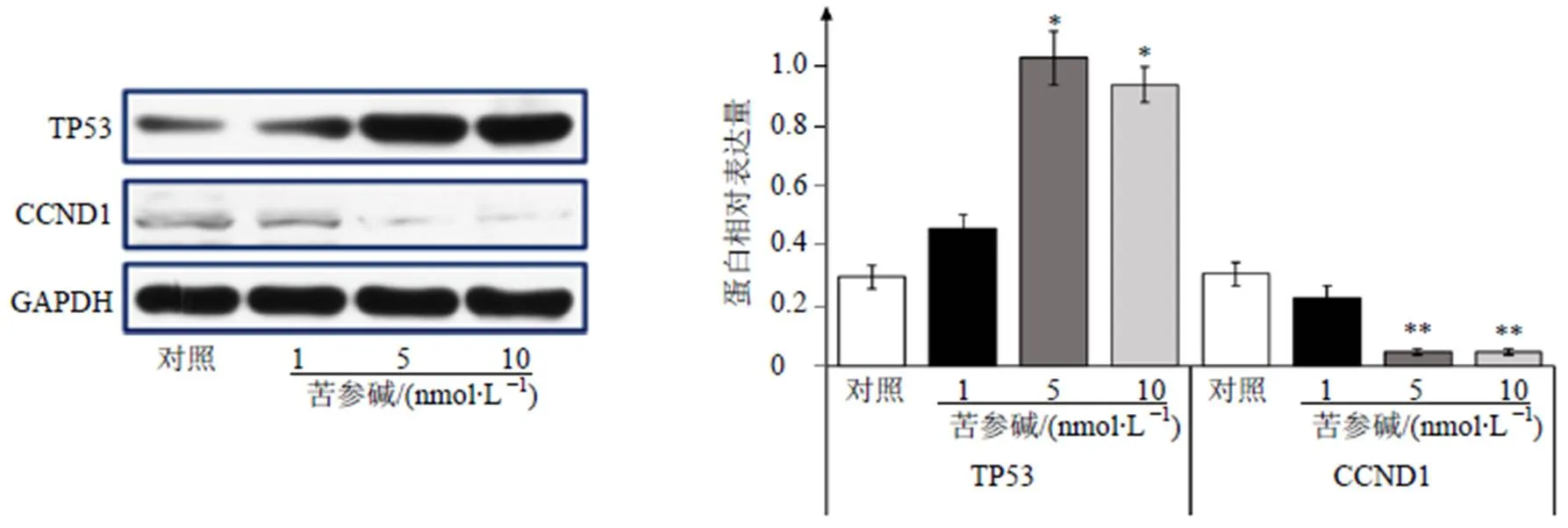
与对照组比较:*P<0.05 **P<0.01
2.9 苦参碱对肝癌荷瘤裸鼠瘤体积的影响
为了验证细胞实验检测的苦参碱对肝癌细胞生物学行为的作用,本实验探究了苦参碱对肝癌荷瘤裸鼠模型的治疗作用。研究发现,给药前对照组[(129.47±8.67)mm3]与苦参碱组[(129.73±7.51)mm3]中裸鼠瘤体积无统计学差异。给药后,与对照组[(2 163.58±400.40)mm3]相比,苦参碱组[(1 286.45±210.10)mm3)]裸鼠瘤体积显著减小(<0.05),抑瘤率为40.5%(图6-A)。此外,由肿瘤瘤体生长曲线(图6-B)可见,从14 d起,苦参碱延缓了裸鼠瘤体的生长速度。
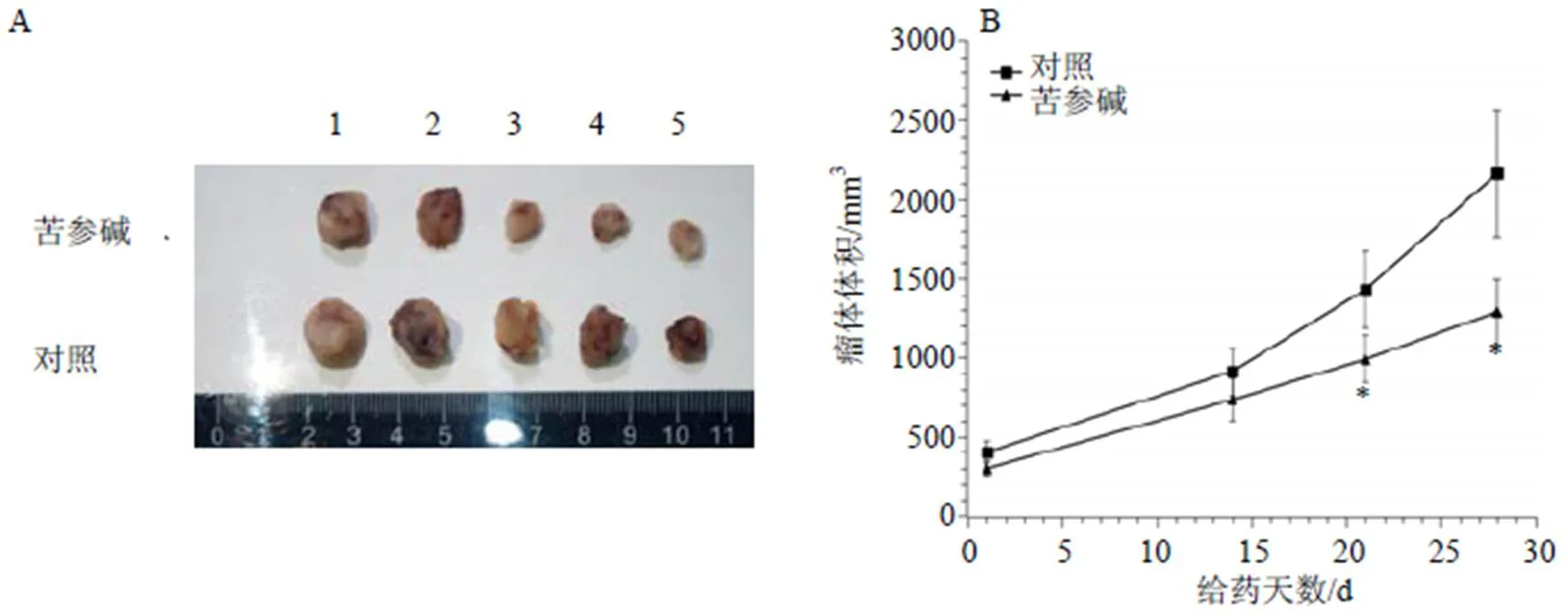
1~5-每组中肝癌荷瘤裸鼠编号 与对照组比较:*P<0.05
2.10 苦参碱对肝癌荷瘤裸鼠瘤体病理组织学影响
为了进一步验证苦参碱对肝癌荷瘤裸鼠模型的治疗作用,对肝癌荷瘤裸鼠瘤体进行了病理组织学观察。对照组瘤体可见完整的白色包膜,瘤体存在较多的出血及坏死组织;苦参碱组瘤体体积显著小于对照组,出血组织及坏死组织少于对照组。镜下可见对照组肝癌组织一系列病理变化,如肝细胞索紊乱,细胞形态异常,细胞核体积变大,细胞质内容物增多,深核染色以及炎症细胞浸润等。与对照组相比,苦参碱组上述病理改变显著减轻(图7)。
2.11 苦参碱对肝癌荷瘤裸鼠瘤体细胞凋亡的影响
为了进一步验证苦参碱对肝癌细胞凋亡行为的调控,利用TUNEL染色法对苦参碱处理后肝癌荷瘤裸鼠瘤体内肝癌细胞的凋亡水平进行了检测。如图8所示,与对照组相比,苦参碱处理后肝癌荷瘤裸鼠瘤体内发生凋亡的细胞数明显增多。
2.12 苦参碱对肝癌荷瘤裸鼠瘤体线粒体稳态相关分子的调节作用
以线粒体自噬及线粒体分裂为代表的线粒体稳态调节机制与在肿瘤细胞中被广泛抑制的线粒体介导的内源性细胞凋亡存在相互调节作用。在体外实验中发现苦参碱可以在HepG2细胞中通过抑制PINK1/Parkin通路相关的线粒体自噬及激活MST1/JNK通路相关的线粒体分裂诱导细胞凋亡的发生,抑制肝癌细胞增殖[19-20]。网络药理学研究结果也表明清肝化瘀颗粒及其有效成分可能通过调节肝癌细胞凋亡与细胞自噬,并通过调节线粒体细胞学行为发挥抑制肝癌的作用,因此本实验通过免疫组化及Western blotting验证了苦参碱给药后肝癌荷瘤裸鼠瘤体线粒体稳态相关分子的表达水平变化。如图9所示,免疫组化染色显示对照组瘤体MST1阳性细胞率为(27.90±5.51)%,苦参碱组瘤体MST1阳性细胞率为(45.92±8.62)%,与对照组相比显著提高(<0.01);此外,对照组瘤体Parkin阳性细胞率为(41.50±3.80)%,苦参碱组瘤体Parkin阳性细胞率为(33.69±2.98)%,与对照组相比显著降低(<0.05)。Western blotting结果验证了免疫组化的结果,如图10所示,苦参碱给药后线粒体分裂相关蛋白MST1及p-JNK表达量较对照组显著提高(<0.01),MST1、p-JNK上调倍数分别为2.1倍和5.2倍;而线粒体自噬相关蛋白PINK1及Parkin在苦参碱给药后表达水平较对照组显著下调,PINK1下调62.9%(<0.01),Parkin下调40.2%(<0.05)。以上结果提示苦参碱可以在肝癌动物模型中对线粒体稳态进行调节。
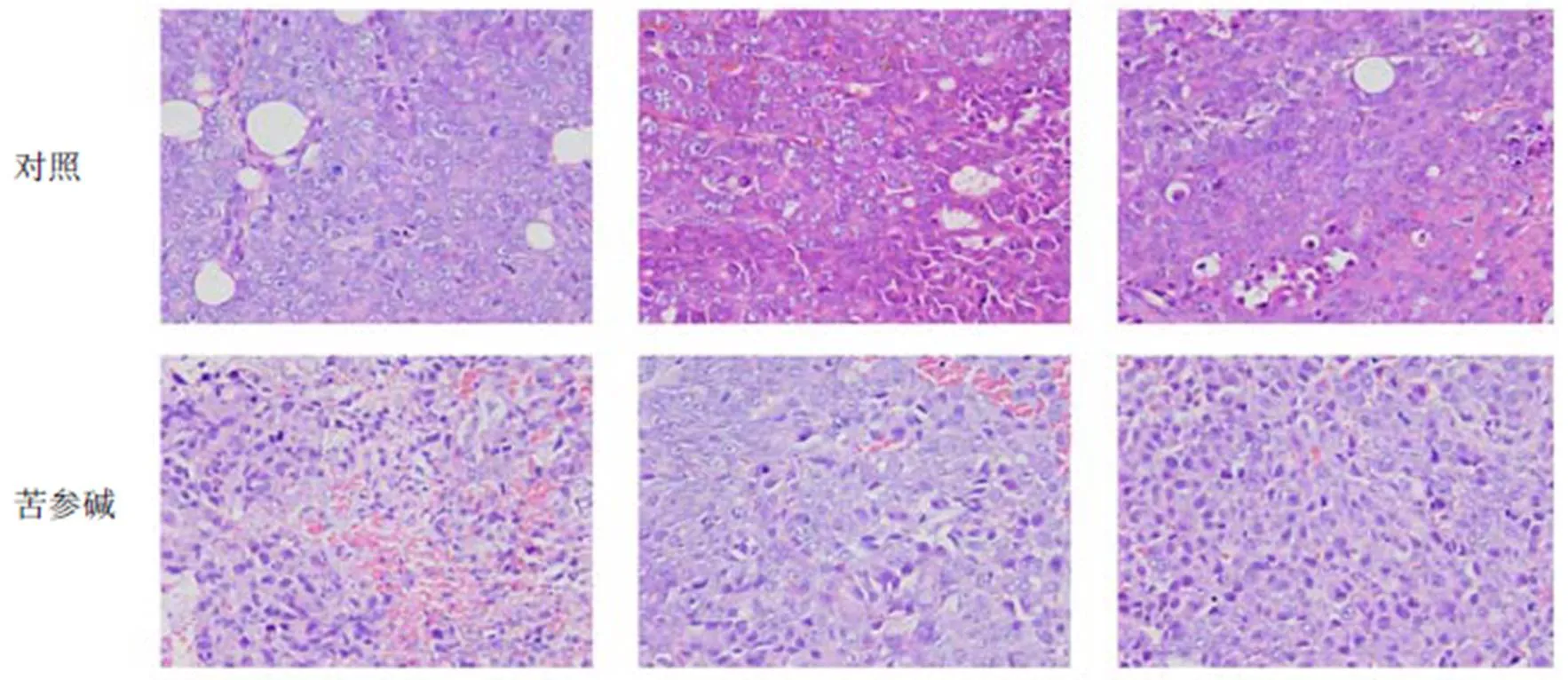
图7 裸鼠瘤体病理切片(HE染色,×400)
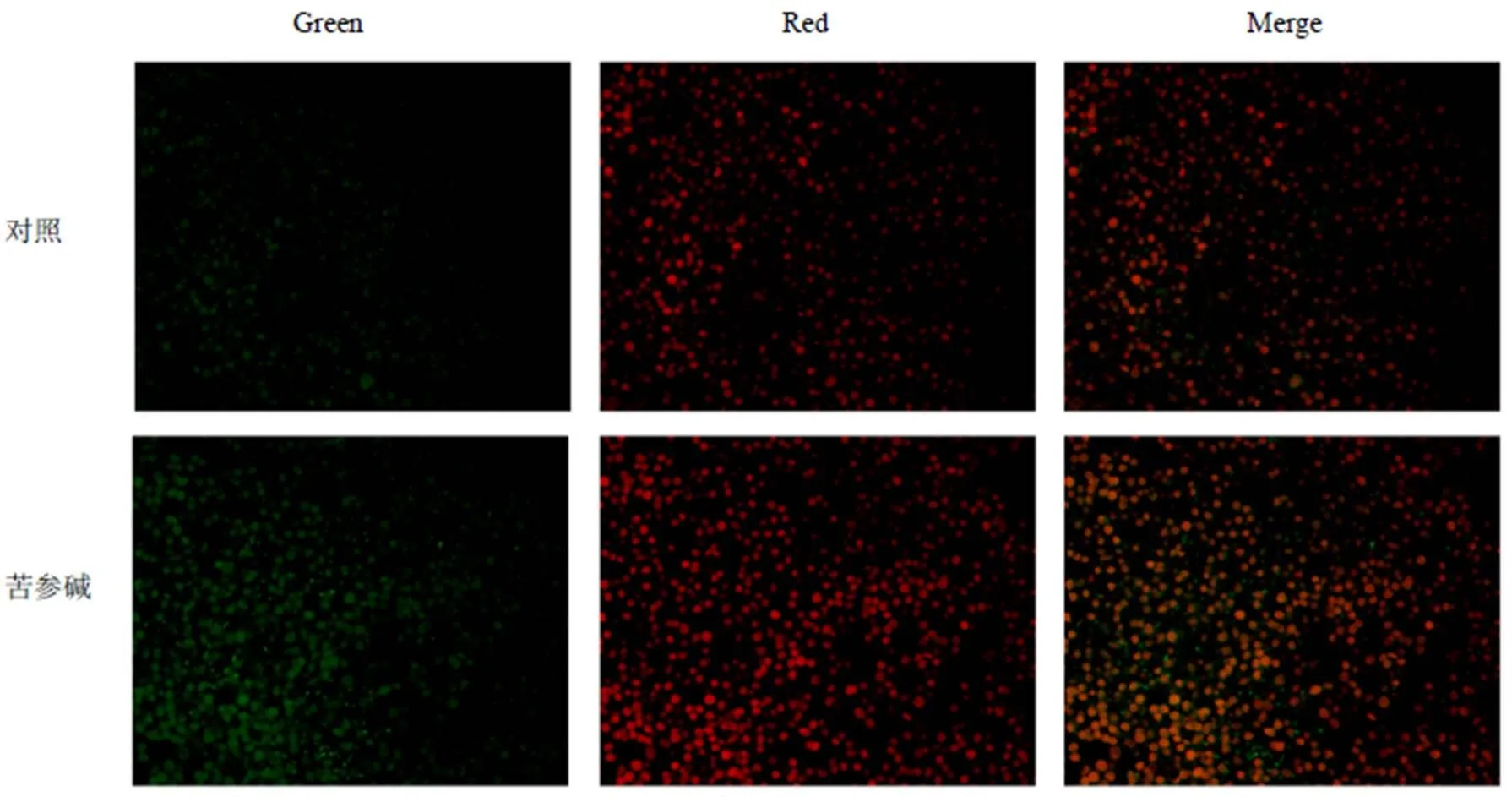
图8 TUNEL法检测肝癌荷瘤裸鼠瘤体细胞凋亡情况(×400)
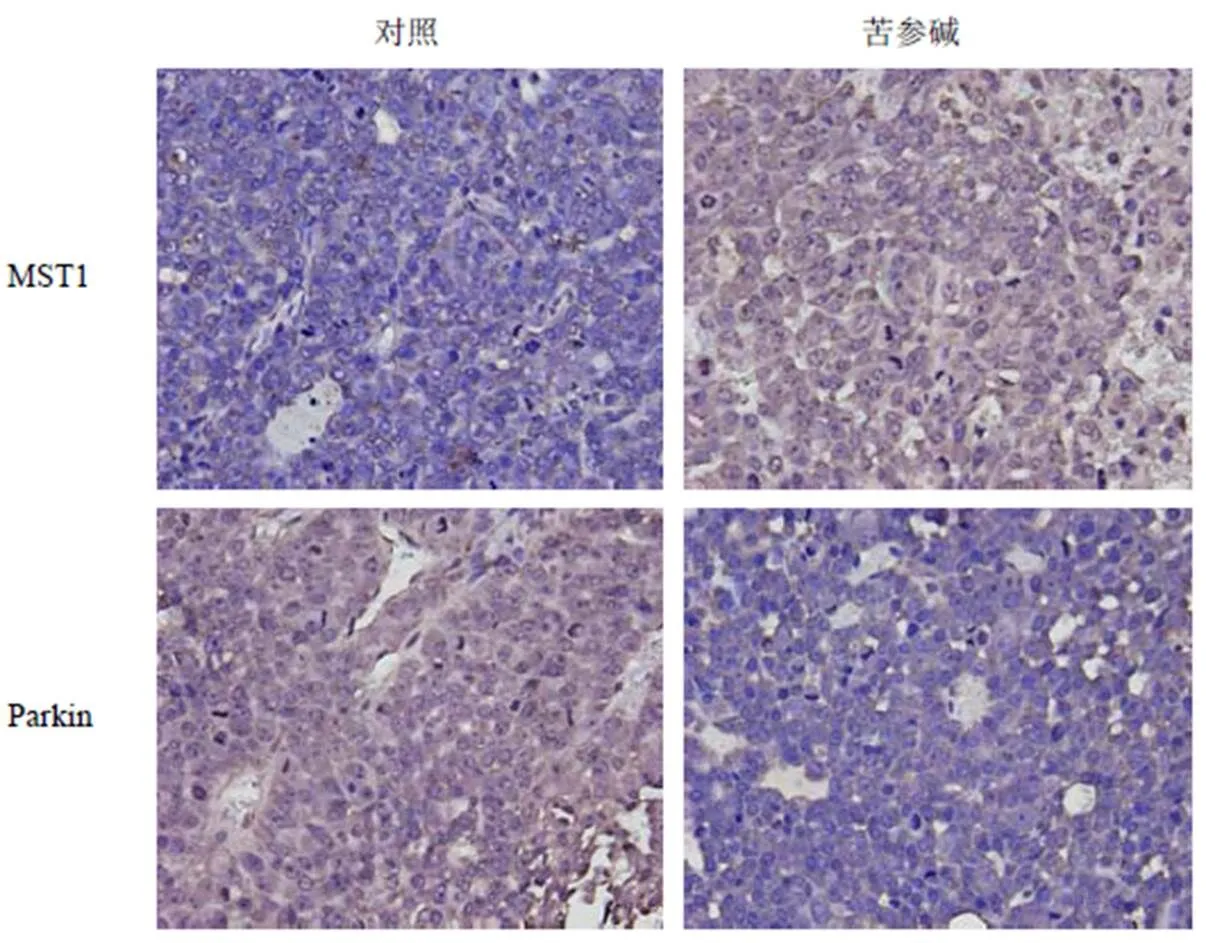
图9 免疫组化法检测肝癌荷瘤裸鼠瘤体线粒体稳态相关分子表达情况(×400)
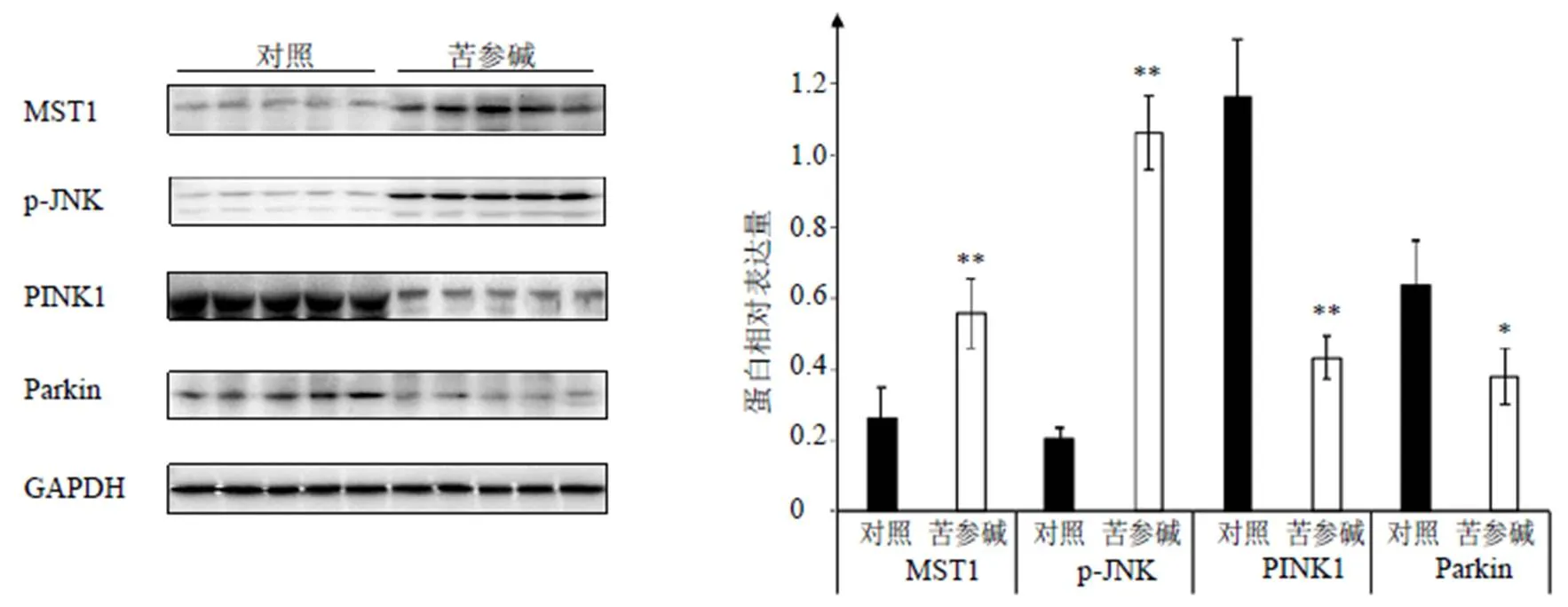
与对照组比较:*P<0.05 **P<0.01
3 讨论
本研究从清肝化瘀方8味中药中发现了可以作用于肝癌治疗靶点蛋白的136种有效成分,其中槲皮素、木犀草素、苦参碱为对应靶点与信号通路数量较多的有效成分,同时这几种有效成分也为清肝化瘀颗粒组方中君药和臣药的主要药效成分,且具有较好的口服利用度与成药性,这一结果从主要成分的层次说明了清肝化瘀颗粒配伍严谨,君臣佐使搭配精妙,处方遣方用药合理科学。既往研究发现这3种化合物具有较好的抗肿瘤活性。Salama等[21]发现槲皮素可以通过调节酪蛋白激酶2α(Casein kinase 2α,CK2α)/cyclin D1的表达量阻遏肝癌细胞的细胞周期进程,同时通过调节p53/Caspase-3信号通路解除肝癌细胞凋亡的抑制进而下调肝癌细胞的增殖水平。研究人员发现,木犀草素可以诱导肝癌Hep3B细胞发生内质网应激参与的细胞凋亡,同时抑制其细胞增殖水平[22]。本课题组前期研究也发现苦参碱可以通过诱导肝癌细胞凋亡与自噬的相互调节对肝癌细胞的恶性增殖进行抑制[23]。
本研究也利用体内外实验同时验证了苦参碱对于肝癌细胞增殖的抑制作用。本研究同时发现,清肝化瘀颗粒治疗肝癌靶点蛋白PPI网络中评分较高的靶点蛋白也是槲皮素、木犀草素及苦参碱的靶点蛋白,并可以富集到多条与肿瘤发生发展相关的信号途径中。因此,推测以槲皮素、木犀草素、苦参碱为代表的3种主要成分在清肝化瘀颗粒治疗肝癌中发挥主导作用。这为从有效单体成分水平研究清肝化瘀颗粒治疗肝癌的作用提供了依据。
本研究利用网络药理学工具发现TP53、CCND1及VEGFA为清肝化瘀颗粒治疗肝癌靶点蛋白PPI网络中的枢纽蛋白。TP53是人体中最重要的抑癌蛋白,其可在多种恶性肿瘤中起到抑制肿瘤发生发展的作用。P53信号通路的活性抑制可以在肝癌细胞中维持恶性增殖、凋亡抑制及侵袭转移等多种肿瘤细胞学行为的激活,进而对肝癌的发生发展提供机会[24]。CCND1是一种细胞周期调节蛋白,可以对细胞周期蛋白依赖性激酶进行调节并参与G1期向S期的细胞周期转化。CCND1参与了多种肿瘤的发生发展。已有研究表明CCND1可以通过调节肝癌细胞的细胞周期进程对肝癌细胞的侵袭转移、肝癌干细胞干性维持及化疗药物耐药性形成等肿瘤细胞学行为发挥促进作用[25]。VEGFA为生长因子家族的成员,其在许多肿瘤组织中表达量上调并与肿瘤分期及进展相关,既往研究表明,其在肝癌中可以在氧化应激胁迫下诱导促癌炎症微环境形成,促进肝癌细胞的血管新生、侵袭转移与免疫逃逸,同时抑制肝癌细胞凋亡进而引起肝癌细胞恶性增殖[26]。本研究利用基因功能富集分析结果显示,TP53、CCND1及VEGFA可以参与细胞凋亡通路、氧化应激胁迫相关信号通路、细胞增殖相关信号通路及细胞周期相关信号通路多条与肿瘤发生发展相关的信号通路。本研究利用网络药理学工具同时发现,来自清肝化瘀颗粒组方中药的多种有效成分可与这3种靶点发生相互作用,进一步的体外实验也证实苦参碱对这3种靶点蛋白的调节作用。以上结果说明TP53、CCND1及VEGFA可以作为核心靶点在清肝化瘀颗粒对肝癌的治疗中发挥着重要作用,为从靶点水平上阐释清肝化瘀颗粒治疗肝癌的分子学机制提供了依据。
肿瘤的发生发展是多种蛋白分子、多条信号通路对多种细胞生物学行为进行调节的结果。而中医药对疾病多靶点、多信号通路,整体性的治疗方式在肿瘤的治疗中具有极大优势。本研究对获得的清肝化瘀颗粒治疗肝癌的靶点基因进行富集分析发现其治疗肝癌的靶点蛋白可以富集到包括磷脂酰肌醇3激酶-蛋白激酶B(phosphatidylinositol 3 kinase-Akt,PI3K-Akt)信号通路,P53信号通路及JAK激酶-信号传导及转录激活蛋白(Janus kinase-signal transducer and activator of transcription,JAK-STAT)信号通路等与肝癌发生发展密切相关的信号通路,基因富集分析结果发现这些靶点基因可以定位于肝癌细胞的各个组分,并在肝癌发生发展过程中对促炎微环境形成、氧化应激胁迫、代谢重编程、细胞周期调节、细胞凋亡进程以及侵袭转移等肝癌细胞生物学调节功能中发挥重要作用。线粒体作为整合细胞能量代谢、物质代谢和生命信号转导的细胞器,在细胞的环境适应与存活作用中不可或缺[27]。因此,线粒体的功能与自稳态调节对于肿瘤的发生发展及药物治疗肿瘤的效果至关重要,线粒体的生物发生、裂变与融合、新陈代谢与氧化应激调节,线粒体自噬及线粒体参与的细胞凋亡等生物学事件都在肿瘤细胞的存活与死亡中扮演重要角色,其在肿瘤靶向治疗中也发挥着重要作用[28]。本研究利用苦参碱治疗HepG2肝癌荷瘤裸鼠后发现,苦参碱可以在肝癌细胞中通过PINK1/Parkin信号通路与MST1-JNK信号途径对线粒体自稳态进行调节,并重新激活被抑制的细胞凋亡进程,进而抑制肝癌的发生发展。同时在体外实验中也发现,苦参碱可以诱导肝癌细胞发生氧化应激胁迫及细胞凋亡进程。本课题组前期研究也发现清肝化瘀方含药血清对肝癌细胞的抑制与线粒体参与的代谢重编程、细胞凋亡及细胞增殖等肝癌细胞生物学行为的调节密切相关[29]。以上研究结果进一步说明清肝化瘀颗粒组方可以通过多成分、多靶点、多信号通路对肝癌的多种生物学行为进行抑制,苦参碱在其中可以作为主要有效成分发挥作用,此外作为细胞生命活动,新陈代谢途径及信号通路的交汇中心,线粒体在清肝化瘀颗粒抑制肝癌的作用中发挥着重要作用。
肝癌在中医属“肝积”“癥积”“鼓胀”“胁痛”等范畴,中医学认为,由于机体正气虚弱,外感邪毒;或情志抑郁,气滞血瘀;或脾失健运,湿浊内生,终致湿浊瘀毒结于脏腑所致。根据我国卫生健康委员会发布的《原发性肝癌诊疗规范》及国家中医药管理局发布的《肝癌中医诊疗方案》,肝癌从发病到进展等各个时期的临床表现可辨证分型为“肝胆湿热证”及“肝热血瘀证”等5种[6]。针对肝癌的这些辨证分型也符合现代人因过度进食高蛋白、高脂肪的饮食,进而影响脾胃运化,积聚而生湿浊的肝癌病因[7];也符合恶性肿瘤患者气血不足甚至气血衰败,癥积日久进而瘀阻血脉造成的气血运行不畅等临床表现[8]。研究表明,湿热证可通过调节炎症、免疫反应,影响代谢及肠道微环境诱导肿瘤的发生发展,清热燥湿类中药可发挥抗炎、抗氧化、调节免疫、调节肠道菌群、调节血糖血脂等作用。清肝化瘀颗粒是由苦参、黄芩等8味中药组成,具有清热解毒、化瘀散结、健脾益气之功。其中苦参、黄芩作为君药,可清热燥湿、泻火解毒;白术、莪术作为臣药,可健脾和胃、活血化瘀;臣药之中另外2味为半枝莲及白花蛇舌草,有加强清热解毒及抗癌作用,辅以消肿散结的功效;三棱为佐药,可以增强活血化瘀、软坚消癥的药效;使药为甘草,有解毒扶正、益气且调和诸药的作用。本研究利用网络药理学发现清肝化瘀颗粒组方中药可对细胞凋亡、代谢重编程、促癌炎症微环境、血管新生与侵袭转移等多种肝癌细胞学行为发挥作用。而改善炎症微环境、降低氧化应激胁迫、调节细胞凋亡及阻止血管新生可能是清肝化瘀颗粒发挥清热解毒、破瘀散结功效的主要分子机制。既往研究也发现,清肝化瘀方可以通过改变VEGFA信号通路,抑制肝癌模型大鼠的血管新生和侵袭转移,同时通过促进肝癌细胞凋亡发挥肝癌抑制作用[30],基于清肝化瘀方联合肝动脉化疗栓塞的肝癌临床研究也得到了类似的结论[31]。基于以上传统医学和现代医学2个角度的研究结果,推测清肝化瘀颗粒可以通过组方中药中的多种有效成分,对多靶点、多通路、多生物学行为进行调节,同时对现代人群中湿热型肝癌发挥治疗作用,而改善炎症微环境、降低氧化应激胁迫、调节细胞凋亡及阻止血管新生可能是清肝化瘀颗粒发挥清热解毒、破瘀散结功效的主要分子机制。
本研究为中西医结合治疗肝癌的作用机制研究提供了理论依据及新思路,也为传统中医药理论的现代化奠定了基础。为进一步验证本研究所得出的结果,利用分子细胞生物学及动物实验研究,对本研究预测的有效成分、靶点蛋白、信号通路及细胞生物学行为开展深入研究,以期为祖国医学在肝癌治疗中的应用提供更多的依据。
利益冲突 所有作者均声明不存在利益冲突
[1] GBD Mortality and Causes of Death Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: A systematic analysis for the Global Burden of Disease Study 2015 [J]., 2016, 388(10053): 1459-1544.
[2] Bray F, Ferlay J, Soerjomataram I,. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]., 2018, 68(6): 394-424.
[3] Zeng H M, Chen W Q, Zheng R S,. Changing cancer survival in China during 2003-15: A pooled analysis of 17 population-based cancer registries [J]., 2018, 6(5): e555-e567.
[4] Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: A systematic analysis for the Global Burden of Disease Study 2013 [J]., 2015, 385(9963): 117-171.
[5] Omata M, Cheng A L, Kokudo N,. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: A 2017 update [J]., 2017, 11(4): 317-370.
[6] 林丽珠, 肖志伟, 黄学武, 等. 原发性肝癌中西医结合诊疗实践回眸 [J]. 中医肿瘤学杂志, 2020, 2(1): 5-9.
[7] 袁菊花, 郑丽平, 吴煜. 从“痰”之致病学说探讨原发性肝癌的发病机制 [J]. 天津中医药, 2017, 34(5): 323-326.
[8] 李莹. 140例乙肝相关性原发性肝癌中医证候及心理健康调查研究 [D]. 北京: 北京中医药大学, 2016.
[9] 吴桐. 清肝化瘀颗粒制剂工艺、指纹图谱及药代动力学研究 [D]. 北京: 北京中医药大学, 2015.
[10] 姚树坤, 殷飞, 王娜. 清肝化瘀方药对原发性肝癌患者的疗效及对细胞免疫功能的影响 [J]. 临床荟萃, 2006, 21(18): 1300-1302.
[11] 王娜, 殷飞, 姚树坤. 清肝化瘀方含药血清对肝癌细胞的影响 [J]. 河北医科大学学报, 2011, 32(5): 501-504.
[12] 李蕊, 柳芳, 宋威江, 等. 清肝化瘀颗粒对H22荷瘤小鼠的抗肿瘤作用研究 [J]. 时珍国医国药, 2016, 27(9): 2130-2134.
[13] Ru J L, Li P, Wang J N,. TCMSP: A database of systems pharmacology for drug discovery from herbal medicines [J]., 2014, 6: 13.
[14] Wang Y H, Zheng C L, Huang C,. Systems pharmacology dissecting holistic medicine for treatment of complex diseases: An example using cardiocerebrovascular diseases treated by TCM [J]., 2015, 2015: 980190.
[15] Su W H, Chao C C, Yeh S H,. OncoDB.HCC: An integrated oncogenomic database of hepatocellular carcinoma revealed aberrant cancer target genes and loci [J]., 2007, 35: D727-D731.
[16] Lee L, Wang K, Li G,. Liverome: A curated database of liver cancer-related gene signatures with self-contained context information [J]., 2011, 12(Suppl 3): S3.
[17] 朱丹丹, 姚树坤. 苦参碱对人肝癌细胞HepG2荷瘤裸鼠的抑瘤作用研究 [J]. 现代药物与临床, 2016, 31(6): 736-741.
[18] 曹建, 魏润杰, 邓茹芸, 等. 苦参碱及氧化苦参碱抑制肿瘤作用机制研究进展及展望 [J]. 中草药, 2019, 50(3): 753-760.
[19] Wei R, Cao J, Yao S. Matrine promotes liver cancer cell apoptosis by inhibiting mitophagy and PINK1/Parkin pathways [J]., 2018, 23(6): 1295-1309.
[20] Cao J, Wei R J, Yao S K. Matrine has pro-apoptotic effects on liver cancer by triggering mitochondrial fission and activating Mst1-JNK signalling pathways [J]., 2019, 69(2): 185-198.
[21] Salama Y A, El-Karef A, El Gayyar A M,. Beyond its antioxidant properties: Quercetin targets multiple signalling pathways in hepatocellular carcinoma in rats [J]., 2019, 236: 116933.
[22] Lee Y, Kwon Y H. Regulation of apoptosis and autophagy by luteolin in human hepatocellular cancer Hep3B cells [J]., 2019, 517(4): 617-622.
[23] Yang J, Yao S K. JNK-bcl-2/bcl-xL-bax/bak pathway mediates the crosstalk between matrine-induced autophagy and apoptosis via interplay with beclin 1 [J]., 2015, 16(10): 25744-25758.
[24] Krstic J, Galhuber M, Schulz T J,. p53 as a dichotomous regulator of liver disease: The dose makes the medicine [J]., 2018, 19(3): E921.
[25] Gennaro V J, Stanek T J, Peck A R,. Control of CCND1 ubiquitylation by the catalyticsubunit USP22 is essential for cell cycle progression through G1 in cancer cells [J]., 2018, 115(40): E9298-E9307.
[26] Liu C, Xu D, Xue B,. Upregulation of RUNX1 suppresses proliferation and migration through repressing VEGFA expression in hepatocellular carcinoma [J]., 2020; 26(2): 1301-1311.
[27] Zong W X, Rabinowitz J D, White E. Mitochondria and cancer [J]., 2016, 61(5): 667-676.
[28] Vyas S, Zaganjor E, Haigis M C. Mitochondria and cancer [J]., 2016, 166(3): 555-566.
[29] 贺云妹, 殷飞, 姚树坤. 清肝化瘀方药含药血清对肝癌SMMC-7721细胞基因组学影响 [J]. 北京中医药大学学报, 2011, 34(12): 843-846.
[30] 殷飞, 姚树坤, 吴新满, 等. 清肝化瘀方对大鼠肝癌血管形成的影响 [J]. 中药药理与临床, 2005, 21(1): 29-32.
[31] 王永中, 姚树坤, 李智岗, 等. 清肝化瘀口服液对肝细胞癌介入治疗后血管内皮生长因子及环氧合酶2表达的影响 [J]. 临床荟萃, 2010, 25(22): 1951-1954.
An exploration on mechanisms of Qinggan Huayu Granule in treating liver cancer based on network pharmacology
CAO Jian1, ZHU Xiao-ran2, YANG Zhen-huan2, SUO Fei-ya2, YAO Shu-kun1, 2, 3
1. School of Biological Science and Medical Engineering, Beihang University, Beijing 100191, China 2. Beijing University of Chinese Medicine, Beijing 100029, China 3. Department of Gastroenterology, China-Japan Friendship Hospital, Beijing 100029, China
To investigate the main active compounds, molecular target genes, and target signal pathways of Qinggan Huayu Granule (清肝化瘀颗粒) treating liver cancer.Based on multiple traditional Chinese medicine and disease databases, the network pharmacology tool was used to screen the main active compounds and action targets of Qinggan Huayu Granule treating liver cancer, analyze the biological functions of potential targets, and construct a network of “herb-ingredient-target-disease”. Theandexperiment was used to verify the effect of matrine, the core component of Qinggan Huayu Granule, on cytological behaviors of liver cancer cells. The regulation of matrine on the candidate target protein was also detected.A total of 86 potential targets for the treatment of liver cancer were screened by traditional Chinese medicine and disease databases. Through enrichment analysis of potential targets, there were 20 biological processes, 15 cellular components, 20 molecular functions, and 20 signaling pathways were yielded. Using “herb-ingredient-target-disease” network, it was found that Qinggan Huayu Granule regulated the biological behaviors of tumors related to liver cancer, such as apoptosis and autophagy, by mainly targets tumor protein p53 (TP53), vascular endothelial growth factor A (VEGFA), G1/S-specific cyclin-D1(CCND1), and other hub genes through quercetin, luteolin, matrine and other active ingredients.experiments revealed that matrine could inhibit cell proliferation, promote apoptosis, and modulate the levels of molecular markers of oxidative stress in a dose-dependent manner in liver cancer cell model. At the same time, matrine can regulate expression of TP53, VEGFA, and CCND1 in protein level.experiments showed that matrine had a tumor suppression effect on HepG2 xenograft tumors in nude mice, and induced apoptosis of liver cancer cells. Meanwhile, matrine regulated the expression in protein levels of mitophagy and mitochondrial fission related molecules.The main mechanism of Qinggan Huayu Granule in treating liver cancer was related to systematic synergy effect of multiple compounds as represented by quercetin, luteolin and matrine, multiple targets as represented by TP53, VEGFA and CCND1, multiple signal pathways as presented by the regulation effects of apoptosis, mitochondrial homeostasis and oxidative stress.
network pharmacology; Qinggan Huayu Granule; liver cancer; matrine; molecular mechanism; quercetin; luteolin
R285
A
0253 - 2670(2021)07 - 2039 - 14
10.7501/j.issn.0253-2670.2021.07.021
2020-08-13
北京市科委G20工程创新研究十病十药研发项目(Z171100001717008)
曹 建(1990—),男,博士研究生,主要研究方向为中药单体抗肿瘤机制。Tel: (010)84206160 E-mail: caojian120@163.com
姚树坤,博士生导师,主任医师,主要从事中西医结合抗肝癌的基础与临床。E-mail: shukun_yao@163.com
[责任编辑 潘明佳]

