人参糖蛋白对阿霉素所致心肌毒性的保护作用及其机制研究
王 蕾,董金香,罗浩明,邱智东,刘 达
• 药理与临床 •
人参糖蛋白对阿霉素所致心肌毒性的保护作用及其机制研究
王 蕾,董金香,罗浩明,邱智东,刘 达*
长春中医药大学药学院,吉林 长春 130117
通过体内外实验,探讨人参糖蛋白对阿霉素心脏毒性的保护作用及机制。建立SD大鼠心肌损伤模型,给予人参糖蛋白进行干预后,检测血清中乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酸激酶同工酶MB(creatine kinase isoenzymes-MB,CK-MB)、超氧化物歧化酶(superoxide dismutase,SOD)活性及谷胱甘肽(glutathione,GSH)水平;采用苏木素-伊红(HE)染色法观察大鼠心肌组织病理变化。建立心肌细胞H9c2损伤模型,采用CCK-8法检测H9c2细胞活力;通过流式细胞术检测H9c2细胞周期、细胞凋亡、活性氧(reactive oxygen species,ROS)水平和线粒体膜电位变化;采用Western blotting法检测H9c2细胞凋亡相关蛋白、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路相关蛋白、沉默信息调节因子2相关酶类3(silent mating type information regulation 2 homolog 3,Sirt3)的表达情况。心肌损伤大鼠模型中,模型组大鼠心肌纤维排列紊乱,肌纤维严重变性,LDH和CK-MB活性显著升高(<0.01),SOD活性和GSH水平显著降低(<0.05、0.01);与模型组比较,人参糖蛋白高剂量组心肌肌束排列较为整齐,LDH和CK-MB活性显著下降(<0.05),GSH水平显著升高(<0.05),人参糖蛋白对阿霉素所致的心肌组织病理学损伤有明显修复作用。细胞损伤模型中,模型组细胞存活率显著下降(<0.001),细胞周期阻滞于G1期(<0.01),细胞凋亡显著升高(<0.01),ROS水平显著升高(<0.01),线粒体膜电位显著下降(<0.01),Sirt3、Caspase-3、B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)蛋白表达水平显著降低(<0.01),Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、细胞色素C(cytochrome C,Cyt C)、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)、p38、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)蛋白表达水平显著升高(<0.05、0.01);与模型组比较,人参糖蛋白组细胞存活率显著升高(<0.05、0.01),细胞增殖周期恢复,细胞凋亡率显著降低(<0.05),ROS水平显著降低(<0.05),线粒体膜电位显著升高(<0.05),Sirt3、Caspase-3、Bcl-2蛋白表达水平显著升高(<0.05),Bax、Cyt C、JNK、p38、ERK1/2蛋白表达水平显著降低(<0.05)。人参糖蛋白能够通过抗氧化应激、降低线粒体膜电位、提高H9c2细胞内ROS水平并调控MAPK信号通路抑制细胞凋亡,从而保护阿霉素诱导的心肌损伤。
人参糖蛋白;心脏毒性;阿霉素;氧化应激;线粒体
阿霉素为高效广谱的抗生素,广泛用于治疗多种癌症[1-4]。与肾脏、肝脏和大脑相比,阿霉素对心肌的亲和力更高;阿霉素会引起心肌收缩功能障碍和心力衰竭,产生自由基损伤心脏,极大限制了其临床的应用[5-6]。阿霉素诱导心脏的损伤与临床心肌疾病的病理表现相似[7]。人参具有抗损伤、抗衰老、抗氧化、增强免疫力等药理作用[8-11]。人参中含有皂苷、多糖等活性成分,课题组前期从人参中提取了具有生物活性的人参糖蛋白[12-13]。人参糖蛋白具有改善记忆功能、治疗老年痴呆、镇静、催眠等作用[14-17],由于糖蛋白具备糖类和蛋白质的双重特性,其生物活性较好。以人参为代表的中药由于其安全性和多靶点的优势,在保护心肌损伤方面有着重要的作用,目前人参糖蛋白对阿霉素所致的心脏毒性作用研究尚无报道。本研究探究人参糖蛋白对阿霉素所致心脏毒性的保护作用及机制,为其抑制阿霉素诱导的癌症患者心脏毒性提供依据。
1 材料
1.1 动物
SPF级雄性SD大鼠50只,体质量(220±10)g,8周龄,购自吉林省实验动物质量检测中心,动物许可证号SCXK(吉)-2018-0007。动物于温度(20±5)℃、湿度(45±10)%条件下饲养。动物实验经长春中医药大学伦理委员会批准(批准号2020208)。
1.2 细胞
大鼠心肌细胞H9c2购自广州赛库生物技术有限公司。
1.3 药物
人参糖蛋白由长春中医药大学中药药剂实验室自制,中性碳水化合物质量分数为11%、酸性碳水化合物质量分数为4%、蛋白质质量分数为82%;相对分子质量为8000~44 000,平均相对分子质量为19 994,具体结构及质谱图参见文献报道[10-15]。
盐酸阿霉素(质量分数≥99%,批号D8740)购自北京索莱宝科技有限公司;氯化钠注射液(批号1812380721)购自辰欣药业股份有限公司;卡托普利片(25 mg/片,批号63181201)购自上海信谊天平药业有限公司。
1.4 试剂
DMEM高糖培养基(批号81220286)、胎牛血清(批号42G2095K)购自美国Gibco公司;磷酸缓冲盐(phosphate buffer saline,PBS)溶液(批号AF29485475)、胰酶(批号J200014)、青霉素链酶素双抗(批号J190005)购自美国Hyclone公司;CCK8试剂盒(批号AR1199)购自博士德生物工程有限公司;台盼兰(批号20190520)、线粒体膜电位检测试剂盒(批号M8650)、Hoschst 33342染色液(批号C0031)购自北京索莱宝科技有限公司;碘化丙啶(批号B07T00102)购自北京鼎国昌盛生物技术有限公司;FITC Annexin V Apoptosis Detection Kit(批号9312842)购自BD PharmingenTM;β-actin抗体(批号10011066)、Caspase-3抗体、B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)抗体(批号00080083)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体(批号00080266)、细胞色素C(cytochrome C,Cyt C)抗体(批号00047881)、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)抗体(批号10010983)、p38抗体(批号00076414)、细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)抗体(批号10009232)、沉默信息调节因子2相关酶类3(silent mating type information regulation 2 homolog 3,Sirt3)抗体(批号00048945)、辣根过氧化物酶标记的山羊抗小鼠抗体(批号20000242)、辣根过氧化物酶标记的山羊抗兔抗体(批号20000217)购自美国Proteintech公司;谷胱甘肽(glutathione,GSH)测定测试盒(批号20200616)、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(批号20200617)、乳酸脱氢酶(lactate dehydrogenase,LDH)测定试剂盒(批号20200619)购自南京建成生物有限公司;肌酸激酶同工酶MB(creatine kinase isoenzymes-MB,CK-MB)酶免试剂盒(批号202006)购自江苏酶免实业有限公司;BCA蛋白测定试剂盒(批号080719191113)、极超敏ECL化学发光试剂盒(批号123119200922)、苏木素-伊红(HE)染色试剂盒(批号C0105S)购自上海碧云天有限公司。
1.5 仪器
SpectraMax Paradigm酶标仪(美谷分子仪器有限公司);1645050蛋白质电泳仪(美国BIO-RAD公司);Forma™ 3 CO2恒温培养箱、1300 series A2生物安全柜、Heraeus™ Megafuge™ 8离心机、iBright FL1000多功能凝胶成像系统、Countess™ II FL全自动细胞成像系统(美国Thermo Fisher Scientific公司);Cytoflex FCM流式细胞仪(美国Beckman公司);MK200-2干湿恒温器(长春绿谷生物科技有限公司);BX63荧光显微镜(日本Olympus公司)。
2 方法
2.1 动物分组、造模与给药
按照文献方法[13],将大鼠随机分为对照组、模型组及人参糖蛋白低、高剂量(255、510 mg/kg)组和卡托普利(10 mg/kg)组,每组10只。采用ip阿霉素法建立大鼠心肌损伤模型[18],对照组ip氯化钠注射液(1 mL/kg),其余各组ip等体积阿霉素(2.5 mg/kg,阿霉素溶于生理盐水配制成质量浓度为2.5 mg/mL的溶液),3次/周,连续2周。人参糖蛋白、卡托普利分别溶于生理盐水配制成质量浓度为150、10 mg/mL的溶液。造模同时,对照组和模型组尾iv氯化钠注射液(2.5 mL/kg),各给药组尾iv相应药物,1次/d,连续21 d。
2.2 人参糖蛋白对心肌损伤大鼠血清生化指标及氧化应激指标的影响
大鼠ip水合氯醛麻醉,腹主动脉取血,常温静置30~60 min,4 ℃、5000 r/min离心5 min,按照试剂盒说明书检测血清中生化指标(LDH、CK-MB)和氧化应激指标(GSH、SOD)。
2.3 人参糖蛋白对心肌损伤大鼠心肌组织病理变化的影响
大鼠iv巴比妥(150 mg/kg)安乐死,取心肌组织,用4%多聚甲醛固定,石蜡包埋后切片(厚5 μm),脱蜡后置苏木素染液中染色3 min,1%盐酸乙醇分化2 s,自来水中返蓝15 min;再将切片放入伊红染液中继续染色1 min,用自来水冲洗残留的染液。将切片进行脱水和透明处理,中性树胶封片,于显微镜下观察。
2.4 细胞培养与分组
H9c2细胞用含10%胎牛血清的DMEM培养基,于37 ℃、5% CO2、饱和湿度的培养箱中培养。设置对照组、模型组和不同质量浓度(50、100、200 μg/mL)人参糖蛋白给药组[12]。模型组和各给药组加入0.58 μg/mL阿霉素[19],各给药组另加入相应药物,对照组加入不含药物的培养基,培养24 h。
2.5 人参糖蛋白对细胞活力的影响
取对数生长期的H9c2细胞,以1×104/孔接种于96孔板中,培养24 h,按“2.4”项下方法处理。每孔中加入10 μL CCK-8溶液,孵育1~4 h,于450 nm处测定吸光度()值,计算细胞存活率。
2.6 人参糖蛋白对细胞周期和细胞凋亡的影响
取对数生长期的H9c2细胞,以2×105/孔接种于6孔板,培养24 h后,按“2.4”项下方法处理。
收集细胞悬液,加入70%乙醇4 ℃固定过夜,用PBS洗涤3次,加入1 mL碘化丙啶(PI)染料,混匀后避光孵育30 min,流式细胞仪进样检测,用ModFit软件对细胞周期进行分析。
收集细胞悬液,加入200 μL结合缓冲液、5 μL膜联蛋白V和5 μL PI,室温避光孵育15 min,流式细胞仪进样检测细胞凋亡情况。
2.7 人参糖蛋白对细胞内ROS水平的影响
取对数生长期的H9c2细胞,以2×105/孔接种于6孔板中,培养24 h,按“2.4”项下方法处理。收集细胞悬液,加入100 μL DCFH-DA探针(10 μmol/L),孵育20 min,用无血清的DMED培养基清洗3次,流式细胞仪进样检测。
2.8 人参糖蛋白对细胞线粒体膜电位的影响
取对数生长期的H9c2细胞,以2×105/孔接种于6孔板中,培养24 h,按“2.4”项下方法处理。收集细胞悬液,加入0.5 mL JC-1染色工作液,孵育20 min,4 ℃、1400 r/min离心3 min,弃上清,用JC-1染色缓冲液洗涤2次,用JC-1染色缓冲液重悬细胞,流式细胞仪进样检测。
2.9 人参糖蛋白对细胞凋亡相关蛋白表达的影响
取对数生长期的H9c2细胞,以2×105/孔接种于6孔板中,培养24 h,按“2.4”项下方法处理。3000 r/min离心5 min,弃上清,加入RAPI裂解液,裂解4 h;12 000 r/min离心30 min,吸取上清液,采用BCA蛋白定量试剂盒测定蛋白质量浓度,加入上样缓冲液,95 ℃金属浴10 min。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶封闭1.5 h,分别加入β-actin(1∶5000)、Bax(1∶2000)、Bcl-2(1∶1000)、Caspase-3(1∶1000)、Cyt C(1∶1000)、JNK(1∶3000)、p38(1∶500)、ERK1/2(1∶2000)、Sirt3(1∶1000)抗体,4 ℃孵育过夜,加入辣根过氧化物酶标记的山羊抗兔/鼠抗体,孵育1.5 h,滴加ECL化学发光液,采用多功能凝胶成像仪显影。
2.10 统计学分析
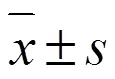
3 结果
3.1 人参糖蛋白对心肌损伤大鼠血清生化指标的影响
如图1所示,与对照组比较,模型组大鼠血清中CK-MB和LDH活性均显著升高(<0.01),表明造模成功;与模型组比较,人参糖蛋白高剂量组和卡托普利组CK-MB和LDH活性均显著下降(<0.05、0.01),表明人参糖蛋白可以减轻阿霉素诱导的大鼠心脏毒性。
3.2 人参糖蛋白对心肌损伤大鼠氧化应激指标的影响
如图2所示,与对照组比较,模型组大鼠血清中SOD活性和GSH水平均显著降低(<0.05、0.01);与模型组比较,人参糖蛋白高剂量组GSH水平显著升高(<0.05),SOD活性呈升高趋势。
与对照组比较:#P<0.05 ##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01,下图同

图2 人参糖蛋白对心肌损伤大鼠氧化应激指标的影响()
3.3 人参糖蛋白对大鼠心肌组织病理学的影响
如图3所示,对照组心肌细胞结构完整,心肌肌束排列整齐,无明显组织病理学损伤;模型组心肌细胞严重损伤,心肌肌束排列明显紊乱,产生炎性细胞浸润和核溶解;与模型组比较,人参糖蛋白低剂量组没有明显变化,人参糖蛋白高剂量组和卡托普利组对阿霉素所致的心肌组织病理学损伤有明显改善作用。
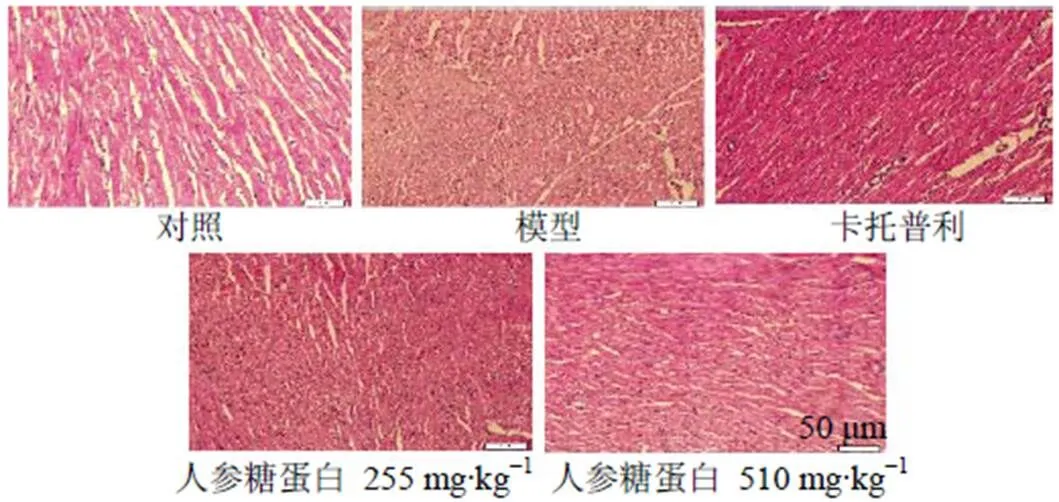
图3 人参糖蛋白对心肌损伤大鼠心肌组织病理变化的影响(HE, ×200)
3.4 人参糖蛋白对阿霉素诱导的H9c2细胞活性的影响
如图4所示,与对照组比较,模型组细胞存活率明显降低(<0.001),提示造模成功。与模型组比较,人参糖蛋白组细胞存活率显著升高(<0.05、0.01),呈剂量相关性。
3.5 人参糖蛋白对阿霉素诱导的H9c2细胞周期的影响
如图5所示,与对照组比较,模型组G0/G1期细胞数显著升高(<0.01),S期、G2/M期细胞数明显减少(<0.01),表明阿霉素使细胞阻滞在G0/G1期,抑制H9c2细胞进入DNA合成期,影响DNA正常复制,从而抑制H9c2细胞增殖。与模型组比较,人参糖蛋白中、高剂量组G0/G1期细胞数显著降低(<0.01),S期、G2/M期细胞数显著升高(<0.05),呈剂量相关性。
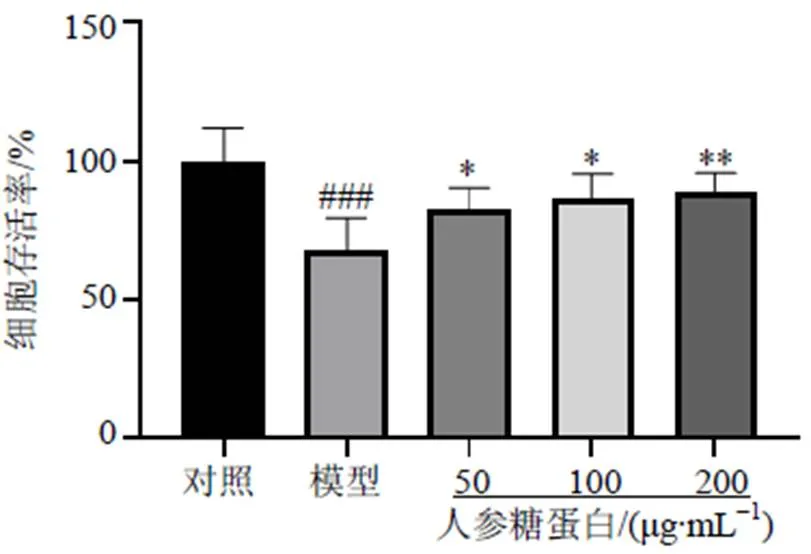
图4 人参糖蛋白对阿霉素损伤的H9c2细胞活性的影响()
3.6 人参糖蛋白对阿霉素诱导的H9c2细胞凋亡的影响
如图6所示,与对照组比较,模型组细胞凋亡率(早期凋亡与中晚期凋亡之和)明显升高(<0.01);与模型组比较,人参糖蛋白组细胞凋亡率显著降低(<0.05),呈剂量相关性。
3.7 人参糖蛋白对阿霉素诱导的H9c2细胞内ROS的影响
如图7所示,与对照组比较,模型组ROS荧光强度显著增强(<0.01);与模型组比较,人参糖蛋白高剂量组ROS荧光强度显著降低(<0.05),呈剂量相关性。
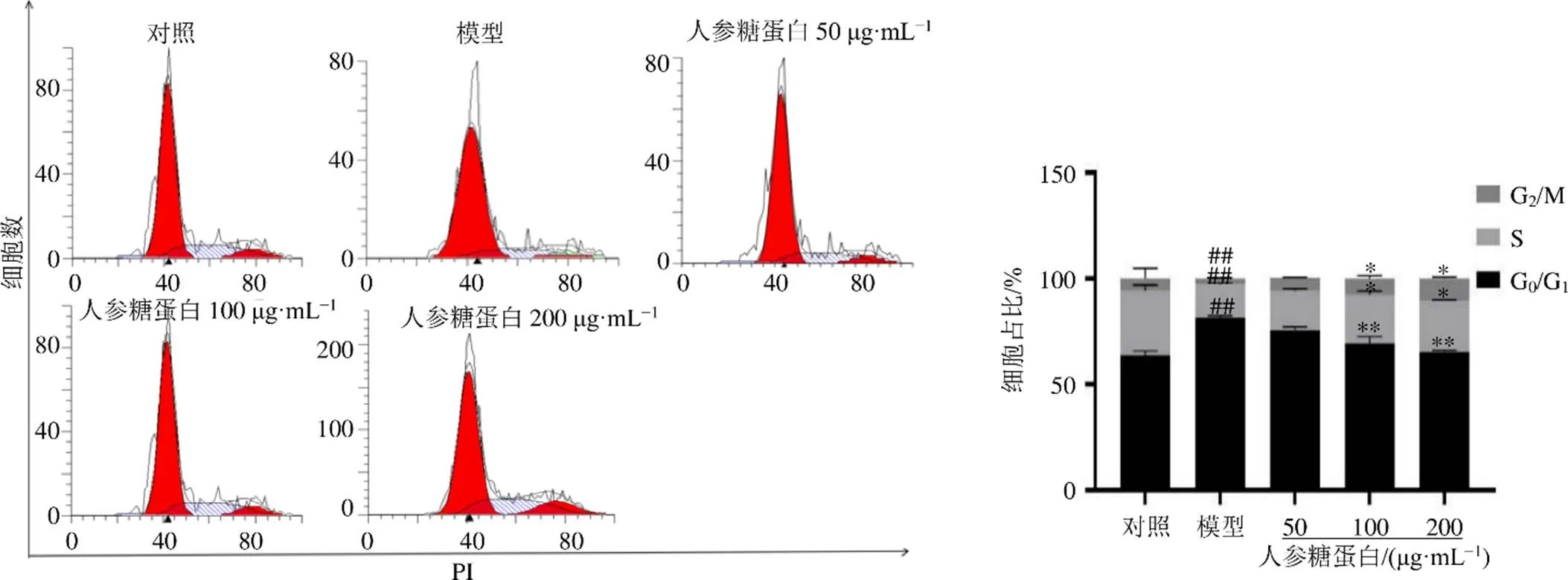
图5 人参糖蛋白对阿霉素损伤的H9c2细胞周期的影响
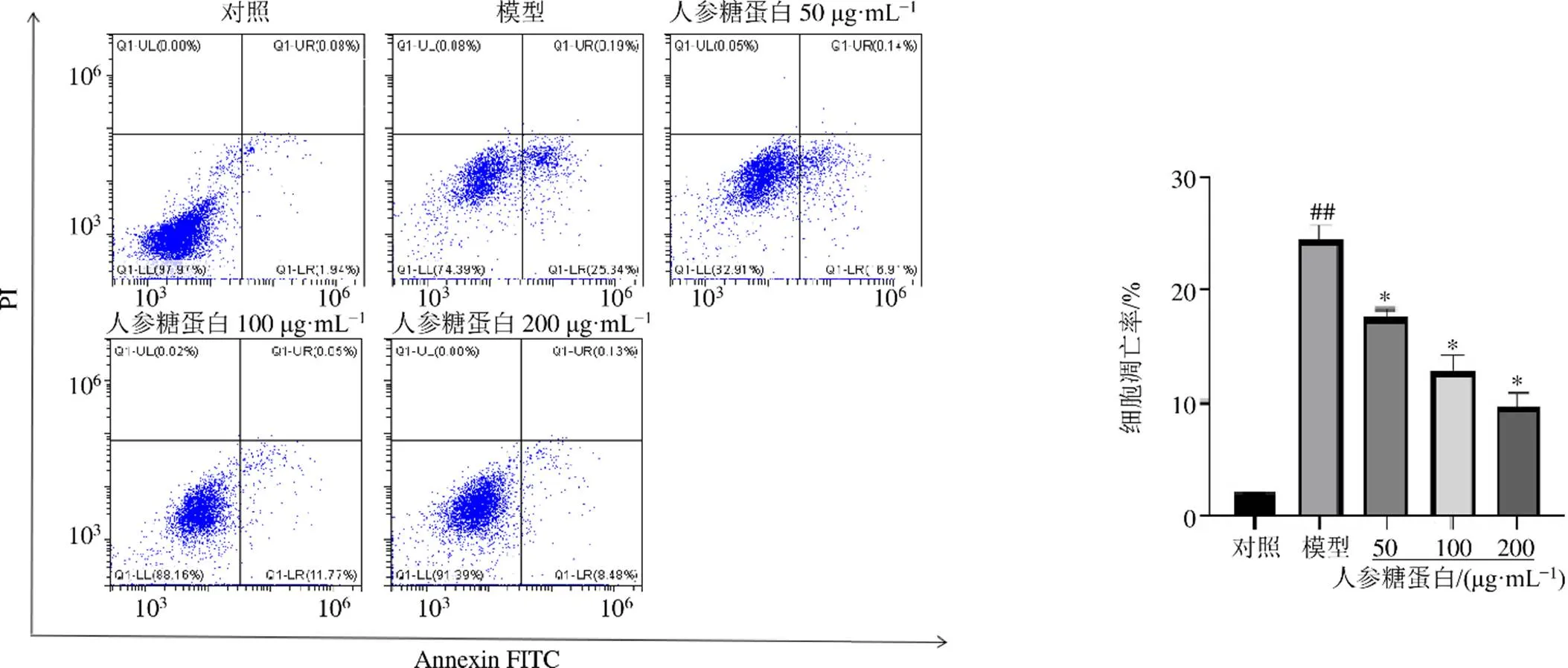
图6 人参糖蛋白对阿霉素诱导的H9c2细胞凋亡的影响()
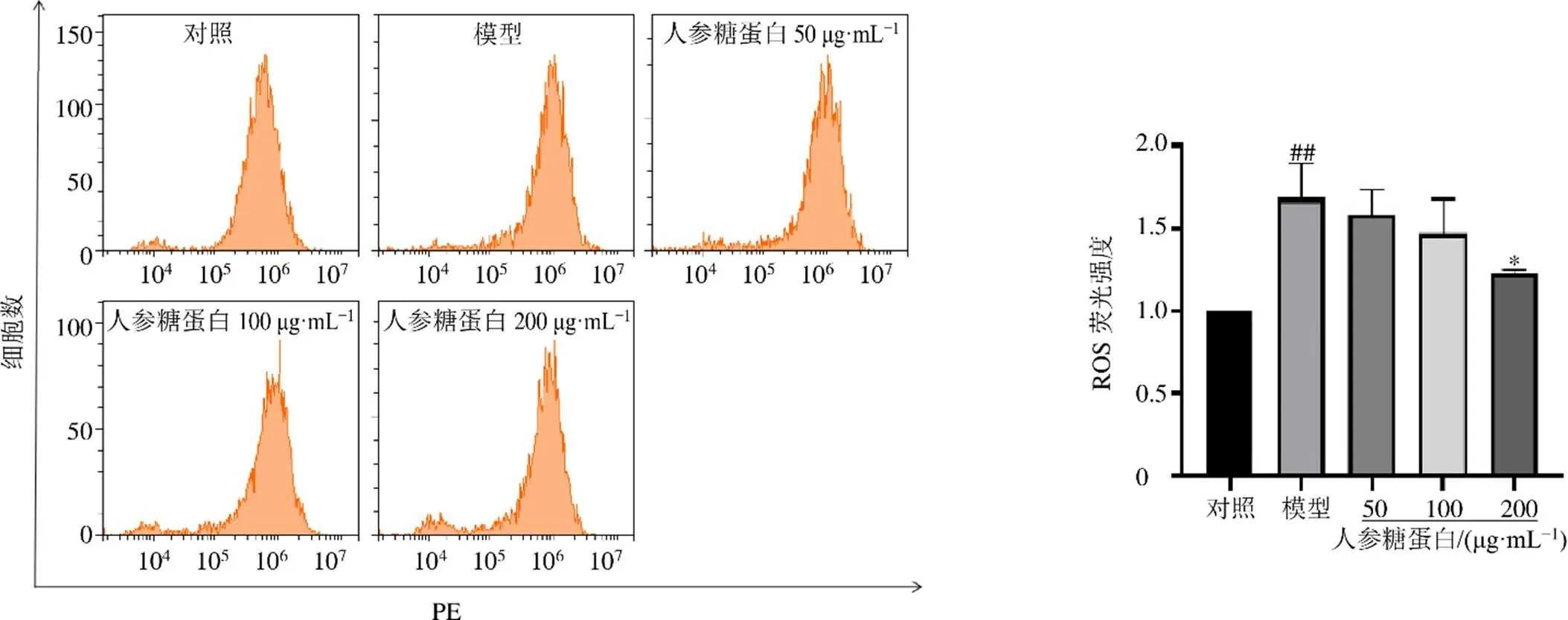
图7 人参糖蛋白对阿霉素诱导的H9c2细胞内ROS水平的影响()
3.8 人参糖蛋白对阿霉素诱导的H9c2细胞线粒体功能的影响
线粒体膜电位是衡量线粒体功能的主要指标,正常细胞的膜电位正常时,JC-1通过线粒体膜极性进入线粒体内,并因浓度升高而形成发射红色荧光的多聚体;凋亡细胞的线粒体跨膜电位去极化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式。如图8所示,与对照组比较,模型组线粒体膜去极化的细胞比例增多,线粒体膜电位显著降低(<0.01);与模型组比较,人参糖蛋白高剂量组线粒体膜完整细胞比例增多,红/绿荧光相对强度逐渐升高,线粒体膜电位显著升高(<0.05),呈剂量相关性。
3.9 人参糖蛋白对阿霉素诱导的H9c2细胞凋亡相关蛋白、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路相关蛋白和Sirt3蛋白表达的影响
如图9所示,与对照组比较,模型组Caspase-3、Bcl-2、Sirt3蛋白表达水平显著降低(<0.01),Bax、Cyt C、JNK、p38、ERK1/2蛋白表达水平显著升高(<0.05、0.01)。与模型组比较,人参糖蛋白高剂量组Caspase-3、Bcl-2、Sirt3蛋白表达水平显著升高(<0.05),Bax、Cyt C、JNK、p38、ERK1/2蛋白表达水平显著降低(<0.05),呈剂量相关性。
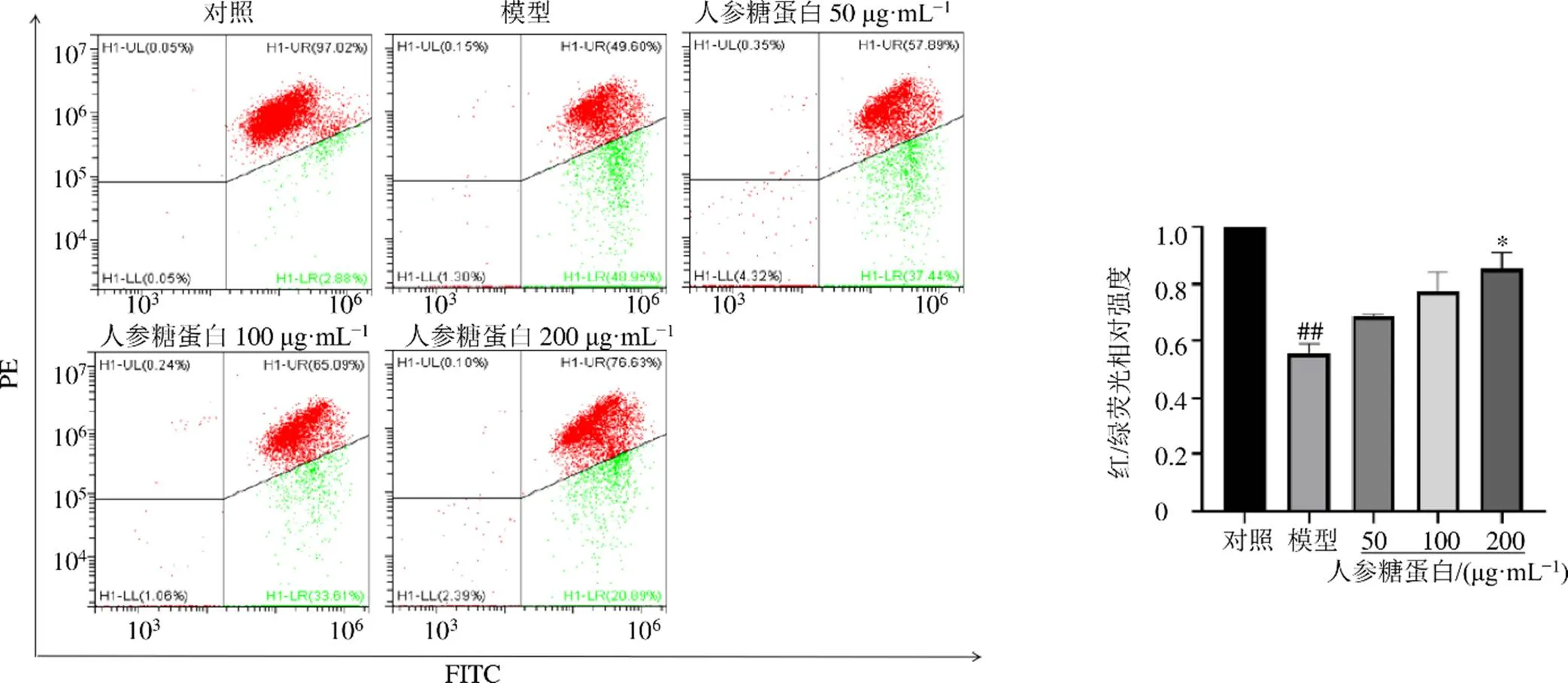
图8 人参糖蛋白对阿霉素损伤的H9c2细胞线粒体膜电位的影响()
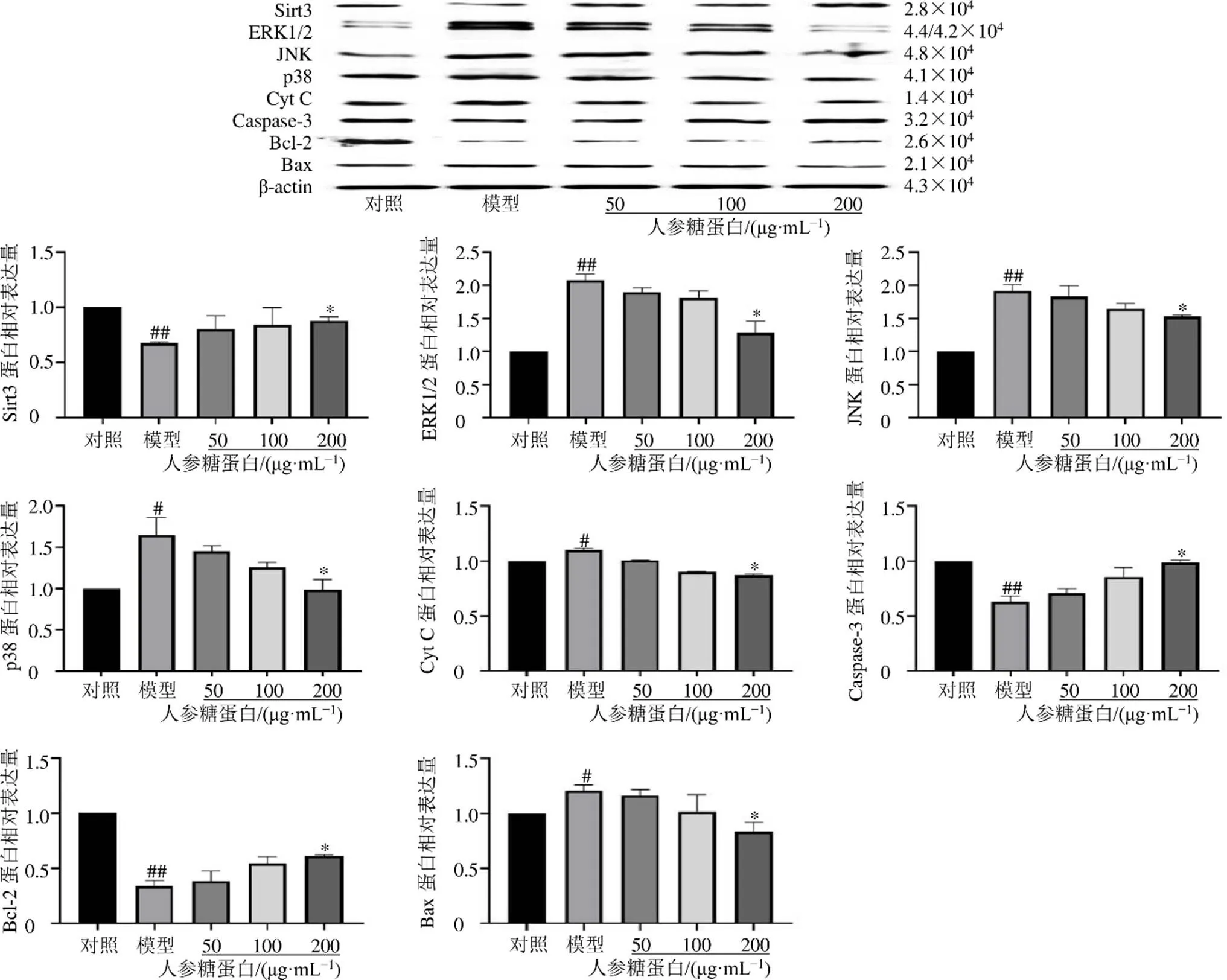
图9 人参糖蛋白对阿霉素诱导的H9c2细胞中凋亡相关蛋白、MAPK通路相关蛋白和Sirt3蛋白表达的影响()
4 讨论
人参具有降低心肌梗死面积、调节血液循环、调血脂等多种药理作用,广泛应用于心血管疾病的预防。阿霉素可诱导H9c2细胞凋亡和自噬,人参皂苷Rb1可能通过抑制阿霉素诱导的自噬,从而保护阿霉素诱导的心脏毒性;从人参中提取到具有保护心脏作用的酸性多糖组分,其心脏保护作用与激活受体介导的再灌注损伤挽救激酶(reperfusion injury salvage kinase,RISK)/内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)/一氧化氮(nitric oxide,NO)通路、调节线粒体功能和代谢有关[20-21]。因此,本研究探究了人参糖蛋白对阿霉素诱导的心肌损伤的作用及机制。
阿霉素是治疗肿瘤的常用药物[22],其对心脏的毒性限制了临床应用[23]。研究发现,阿霉素造成的心肌损伤与氧化应激[24]、线粒体功能障碍[25]、细胞凋亡[26]、Ca2+-三磷酸腺苷(adenosine triphosphate,ATP)酶活性降低、DNA损伤[27]等相关。氧化应激损伤在阿霉素诱导的心脏毒性中发挥着重要作用,细胞产生内在抗氧化系统以降低ROS水平,提高细胞存活率,GSH可催化过氧化氢等过氧化物还原,SOD可催化O2−还原为过氧化氢。本研究发现,阿霉素诱导的心肌损伤大鼠血清中CK-MB与LDH活性升高,引起心肌损伤,这可能是由于阿霉素引起心肌细胞膜脂质过氧化,导致CK-MB从心肌细胞质渗漏到血液中;人参糖蛋白对阿霉素诱导的氧化应激和细胞损伤具有明显的保护作用,可显著降低LDH和CK-MB活性,显著增加GSH水平。
线粒体是阿霉素诱导心肌细胞的主要靶标,阿霉素进入细胞后在线粒体中积累并破坏线粒体电子链,ROS生成增加,线粒体通透性转换孔开放,促进凋亡蛋白Cyt C表达,激活Caspase-3,抑制抗凋亡蛋白Bcl-2表达,促进促凋亡蛋白Bax表达,从而促进细胞凋亡。本研究发现,人参糖蛋白可恢复阿霉素诱导的H9c2细胞线粒体膜电位,降低ROS水平,提高细胞存活率,抑制H9c2细胞的凋亡途径,从而有效缓解阿霉素诱导的心脏毒性。
激活Sirtuins可保护心脏免受阿霉素诱导的细胞毒性的影响[28]。Sirt3是Sirtuin家族在线粒体中的主要脱乙酰基酶,具有清除ROS和提高抗氧化酶活性的能力,可通过乙酰化和激活电子传递链负向调控ROS的产生,Sirt3可通过激活多种防御机制抑制心肌细胞凋亡[29]。本研究结果显示,阿霉素诱导的H9c2细胞Sirt3蛋白表达水平降低,ROS水平升高;人参糖蛋白可上调Sirt3蛋白表达水平,降低ROS水平。MAPKs在细胞增殖、分化和凋亡中起重要作用,ERK1/2、JNK和p38参与阿霉素诱导的氧化应激的响应[30]。本研究结果显示,人参糖蛋白可能通过下调ERK1/2、JNK和p38来缓解阿霉素诱导的心脏毒性,保护心肌细胞损伤。
综上所述,人参糖蛋白能上调Sirt3蛋白表达水平、减少ROS产生、恢复线粒体膜电位、上调Bcl-2蛋白表达水平、下调Bax蛋白表达水平、减少Cyt C释放以及Caspase-3裂解、抑制氧化应激损伤、调节MAPK信号通路,从而有效改善阿霉素所致的心脏毒性。本研究为减少阿霉素诱导的H9c2细胞凋亡、提高心脏功能和改善心血管病的药物开发提供依据。
利益冲突 所有作者均声明不存在利益冲突
[1] Pilco-Ferreto N, Calaf G M. Influence of doxorubicin on apoptosis and oxidative stress in breast cancer cell lines [J]., 2016, 49(2): 753-762.
[2] Wang A M, Wang W N, Chen Y Q,. Deguelin induces PUMA-mediated apoptosis and promotes sensitivity of lung cancer cells (LCCs) to doxorubicin (Dox) [J]., 2018, 442(1/2): 177-186.
[3] Vong L B, Nagasaki Y. Combination treatment of murine colon cancer with doxorubicin and redox nanoparticles [J]., 2016, 13(2): 449-455.
[4] Pugazhendhi A, Edison T N J I, Velmurugan B K,. Toxicity of doxorubicin (Dox) to different experimental organ systems [J]., 2018, 200: 26-30.
[5] Renu K, V G A, P B T P,. Molecular mechanism of doxorubicin-induced cardiomyopathy-an update [J]., 2018, 818: 241-253.
[6] Li D L, Hill J A. Cardiomyocyte autophagy and cancer chemotherapy [J]., 2014, 71: 54-61.
[7] Bartlett J J, Trivedi P C, Pulinilkunnil T. Autophagic dysregulation in doxorubicin cardiomyopathy [J]., 2017, 104: 1-8.
[8] 中国药典 [S]. 一部. 2015: 8.
[9] 刘琳, 张凯, 何勐, 等. 人参皂苷Rg1对阿尔茨海默病转基因小鼠的神经保护作用 [J]. 中草药, 2020, 51(5): 1264-1272.
[10] 于雪妮, 冯小刚, 张建民, 等. 人参化学成分与药理作用研究新进展 [J]. 人参研究, 2019, 31(1): 47-51.
[11] 孟雪, 邱智东, 王蕾, 等. 人参皂苷CK抑制人结肠癌SW480细胞增殖的机制研究 [J]. 中草药, 2020, 51(6): 1567-1574.
[12] 罗浩铭, 王颖, 陈英红, 等. 人参糖蛋白对Aβ25~35诱导SH-SY5Y细胞凋亡的影响 [J]. 中国老年学杂志, 2016, 36(24): 6077-6080.
[13] Fang X, Zhu D, Chen Y,. LC-MS/MS analysis of partial structure ofprotein and its distribution[J]., 2020, 150: 695-704.
[14] Luo H, Hu J, Wang Y,.andneuroprotective effects ofglycoproteins [J]., 2018, 113: 607-615.
[15] Luo H M, Zhu D F, Wang Y,. Study on the structure of ginseng glycopeptides with anti-inflammatory and analgesic activity [J]., 2018, 23(6): 1325.
[16] 罗浩铭, 陈英红, 周婷婷, 等. 人参糖蛋白对小鼠学习和记忆能力的影响 [J]. 吉林大学学报: 医学版, 2016, 42(3): 439-445.
[17] 王颖, 陈英红, 徐宏, 等. 人参糖蛋白的结构及其镇静安眠作用研究 [J]. 特产研究, 2017, 39(2): 1-4.
[18] Lin H, Zhang J, Ni T J,. Yellow wine polyphenol compounds attenuate doxorubicin-induced cardiotoxicity [J]., 2019, 23(9): 6034-6047.
[19] 刘欢, 雷欢, 梁瑞华, 等. 柚皮素对阿霉素致心肌细胞损伤的保护作用及机制研究 [J]. 中药新药与临床药理, 2020, 31(7): 788-793.
[20] Yang E J, Kim S I, Ku H Y,. Syringin from stem bark ofprotects Abeta(25-35)-induced toxicity in neuronal cells [J]., 2010, 33(4): 531-538.
[21] 李龙飞, 马增春, 王宇光, 等. 人参皂苷Rb1减轻阿霉素诱导心肌细胞自噬的保护作用 [J]. 中国中药杂志, 2017, 42(7): 1365-1369.
[22] Fraczkowska K, Bacia M, Przybyło M,. Alterations of biomechanics in cancer and normal cells induced by doxorubicin [J]., 2018, 97: 1195-1203.
[23] Li D L, Hill J A. Cardiomyocyte autophagy and cancer chemotherapy [J]., 2014, 71: 54-61.
[24] Mei S B, Hong L, Cai X Y,. Oxidative stress injury in doxorubicin-induced cardiotoxicity [J]., 2019, 307: 41-48.
[25] Kavazis A N, Morton A B, Hall S E,. Effects of doxorubicin on cardiac muscle subsarcolemmal and intermyofibrillar mitochondria [J]., 2017, 34: 9-19.
[26] Fang J T, Tang Y D, Cheng X W,. Exenatide alleviates adriamycin-induced heart dysfunction in mice: Modulation of oxidative stress, apoptosis and inflammation [J]., 2019, 304: 186-193.
[27] Vichi P, Robison S, Tritton T R. Temperature dependence of adriamycin-induced DNA damage in L1210 cells [J]., 1989, 49(20): 5575-5580.
[28] Ruan Y, Dong C L, Patel J,. SIRT1 suppresses doxorubicin-induced cardiotoxicity by regulating the oxidative stress and p38MAPK pathways [J]., 2015, 35(3): 1116-1124.
[29] Pillai V B, Bindu S, Sharp W,. Sirt3 protects mitochondrial DNA damage and blocks the development of doxorubicin-induced cardiomyopathy in mice [J]., 2016, 310(8): 962-972.
[30] Zuo Y H, Han Q B, Dong G T,.polysaccharide protected H9c2 cardiomyocyte from hypoxia/reoxygenation injury through regulating mitochondrial metabolism and RISK pathway [J]., 2018, 9: 699.
Protective effect and mechanism of ginseng glycoproteins on cardiotoxicity caused by adriamycin
WANG Lei, DONG Jin-xiang, LUO Hao-ming, QIU Zhi-dong, LIU Da
School of Pharmacy, Changchun University of Chinese Medicine, Changchun 130117, China
andexperiments were conducted to investigate the protective effect and mechanism of ginseng glycoproteins on adriamycin-induced cardiotoxicity.SD rats myocardial injury model was established. After intervention with ginseng glycoprotein, activities of lactate dehydrogenase (LDH), creatine kinase isoenzymes-MB (CK-MB), and superoxide dismutase (SOD) and glutathione (GSH) levels in serum were detected; Hematoxylin-eosin (HE) staining was used to observe the pathological changes of rat myocardial tissue. H9c2 injury model of cardiomyocytes was established, and viability of H9c2 cells was detected by CCK-8 method; H9c2 cells cycle, apoptosis, reactive oxygen species (ROS) levels and mitochondrial membrane potential changes in mitochondrial membrane potential were detected by flow cytometry; Western blotting was used to detect expressions of apoptosis-related proteins, mitogen-activated protein kinase (MAPK) signaling pathway related proteins and silent information regulator 2 related enzymes 3 (Sirt3) in H9c2 cells.In myocardial injury rats model, the myocardial fiber arrangement of model group was disordered, the muscle fiber was severely degenerated, the activities of LDH and CK-MB were significantly increased (< 0.01), and the SOD activity and GSH level were significantly decreased (< 0.05, 0.01); Compared with model group, the myocardial muscle bundles in high-dose ginseng glycoprotein group were arranged more neatly, activities of LDH and CK-MB were significantly decreased (< 0.05), and level of GSH was significantly increased (< 0.05). The pathological damage of myocardial tissue caused by adriamycin had obvious repairing effect. In cell injury model, cell viability of model group was significantly decreased (< 0.001), cell cycle was arrested in G1phase (< 0.01), apoptosis was significantly increased (< 0.01), and level of ROS was significantly increased (< 0.01), mitochondrial membrane potential was significantly decreased (< 0.01), expressions of Sirt3, Caspase-3, B cell lymphoma-2 (Bcl-2) were significantly decreased (< 0.01), expressions of Bcl-2 associated X protein (Bax), cytochrome C (Cyt C), c-Jun-terminal kinase (JNK), p38, extracellular regulated protein kinases 1/2 (ERK1/2) were significantly increased (< 0.05, 0.01); Compared with model group, cell viability of ginseng glycoprotein group was significantly increased (< 0.05, 0.01), cell proliferation cycle was restored, and apoptosis rate was significantly reduced (< 0.05), ROS level was significantly reduced (< 0.05), and mitochondrial membrane potential was significantly increased (< 0.05), expressions of Sirt3, Caspase-3 and Bcl-2 in ginseng glycoprotein group were significantly increased (< 0.05), expressions of Bax, Cyt C, JNK, p38, ERK1/2 were significantly reduced (< 0.05).Ginseng glycoprotein can prevent oxidative stress, reduce mitochondrial membrane potential, increase ROS level in H9c2 cells, and regulate MAPK signaling pathway to inhibit cell apoptosis, thereby protecting adriamycin-induced myocardial injury.
ginseng glycoprotein; cardiotoxicity; adriamycin; oxidative stress; mitochondria
R285.5
A
0253 - 2670(2021)07 - 1965 - 09
10.7501/j.issn.0253-2670.2021.07.013
2020-12-10
国家自然科学基金资助项目(81803680);吉林省科技发展项目(20170309005YY);吉林省中医药科技项目(2020041)
王 蕾(1995—),女,硕士研究生,研究方向为中药药剂学。E-mail: 597790201@qq.com
刘 达,男,副教授,研究方向为分子生物学。Tel: 18743010987 E-mail: liuda_1986@163.com
[责任编辑 李亚楠]

