温郁金组织培养高效再生及毛状根诱导体系初探
徐正贤,江 洁,罗灶霞,李江山,周鑫媛,龙发宗,向太和
(杭州师范大学生命与环境科学学院,浙江 杭州 311121)
温郁金(CurcumawenyujinY.H. ChenetC. Ling)是姜科姜黄属植物,其块根加工成的药材“温郁金”为浙江省道地药材“浙八味”之一[1].根据药用部位与加工方法的不同,可分别加工成3种不同药材:块根煮熟晒干称“温郁金”,侧根茎纵切厚片晒干称“片姜黄”,主根茎煮熟晒干称“温莪术”.3种药材均为2010年版《中国药典》收载品种,具有极高的经济价值[2].迄今,已从温郁金中分离获得82种化学成分,包括单萜类、倍半萜类、二萜类、生物碱等[3-8].蓬莪术环二烯,作为温郁金根茎挥发油的主要成分之一,对肿瘤细胞具有抑制作用[9-10].特别是近年来发现,从温郁金中分离的β-榄香烯表现出高效低毒的抗肿瘤活性,具有增加诱导细胞凋亡的作用,对肺癌、肝癌、脑癌、食道癌、胃癌和骨转移癌等多种癌症安全有效[11-13].据此已研制出疗效好、副作用小的新型抗肿瘤药物,开发出具有我国自主知识产权的抗肿瘤植物药物[14].此外,温郁金在抗炎、镇痛方面具有显著疗效,还具有保肝、抗忧郁作用以及抗血栓和改善血液循环等功效[15-16].
温郁金主要以根茎繁殖,易感染病毒,且受到多种病虫害的危害.由于其长期的无性繁殖,导致种群退化、病毒化严重,严重影响产量和品质,难以得到安全、有效、稳定、可控的温郁金药材[17].为了提纯复壮温郁金资源,快速繁殖获得良种,通过植物组织培养技术建立温郁金快速高效的繁殖体系非常必要.目前虽然有个别报道利用组织培养获得了温郁金的再生植株,但由于直接以块根作为外植体,外植体严重带菌,导致外植体消毒不彻底、培养过程中污染严重、再生植株频率低等问题[18-20].另一方面,毛状根(hairy roots)是发根农杆菌所含Ri质粒的T-DNA片段在植物细胞基因组DNA中插入、整合并表达,诱导植物细胞形成的不定根.在应用上,毛状根具有天然植物根的结构、能够在不含有植物激素的培养基上快速生长,且遗传稳定性高并能合成和积累植物次生代谢物质.因此,毛状根可作为生物反应器生产植物的药用活性成分[21-22].根据文献报道,通过发根农杆菌的侵染,在一些药用植物中实现了毛状根的诱导,并从毛状根中分离获得多种药用活性成分,如:丹参[23]、人参[24]、绞股蓝[25]、红豆杉[26]、长春花[27]、金铁锁[28]、三叶青[29]和温山药[30]等.本研究在实现温郁金高效再生的基础上,利用发根农杆菌侵染外植体成功诱导获得毛状根.
1 材料与方法
1.1 实验材料
温郁金实生苗原种由浙江省温州市天禾生物科技有限公司惠赠,实生苗种植在杭州师范大学人工气候室.选取长势良好、无病虫害的温郁金叶、茎作为组培的外植体.同时,利用健壮的块根,埋入泥炭∶蛭石=4∶1(v/v)配比的培养土中,保持培养土湿润,20—25 ℃条件下生长30—40 d,待块根长出1—1.5 cm长的芽尖,从块根上端0.1—0.2 cm处剪取芽尖作为组培的外植体.诱导毛状根的外植体来源于无菌苗.
1.2 外植体消毒
外植体用含0.1%洗洁精的自来水浸泡清洗10 min,再用自来水漂洗3次,最后在消毒液中浸泡5-50 min.消毒后的外植体用无菌的双蒸馏水冲洗3次.实验使用的消毒液有0.1%升汞水溶液、3.0%双氧水和6.0%次氯酸钠水溶液(即稀释5倍的市售安替福民).
1.3 外植体培养
消毒后的外植体接种至诱导丛生芽的培养基,即含6-BA(6-苄基腺嘌呤)2 mg/L+IAA (吲哚乙酸)1 mg/L+ZT(玉米素)1 mg/L+Cef(头孢霉素)500 mg/L的MS培养基.在20—25 ℃、光照1 000—1 200 Lux条件下培养,获得丛生芽.获得的丛生芽切割为带顶芽的个体,接种至生根培养基,即含6-BA 0.5 mg/L+ 0.5 mg/L IAA的MS培养基.在20—25 ℃、光照1 000—1 200 Lux下培养15—20 d,形成带根的完整植株.
1.4 发根农杆菌K599侵染液制备
将-80℃保存的野生型发根农杆菌K599在LB + 50 mg/L Str(链霉素)固体培养基上划线、28℃暗培养2 d.取单菌落于LB + 50 mg/L Str液体培养基中过夜培养,28 ℃、200 r/min.当农杆菌菌液光密度OD值约为1.0时,取1 mL菌液于1.5 mL离心管中,离心、除上清;用MS液体培养基悬浮菌体,离心、除上清;再用MS液体培养基稀释至OD值约为0.1,用作侵染液.
1.5 温郁金毛状根的诱导和繁殖
在超净工作台上,剪取约长×宽约2×1 cm的叶片、长1—2 cm的茎、约1 cm3球形块根、同时带1—2 cm长茎和约1 cm3块根的根茎段作为农杆菌侵染的外植体.在每个叶片上剪出2—3个伤口,用无菌的解剖针在茎段和根上刺出5—10个伤口.带伤口的外植体,放入培养皿中,加入适量侵染菌液,覆盖外植体,置于摇床上、90 r/min侵染10 min后取出,用无菌蒸馏水清洗3次,再用无菌滤纸吸干外植体表面液体,置于MS+NAA 0.4 mg/L+As(乙酰丁香酮) 20 mg/L培养基中,20—25 ℃、遮光培养.2—3 d后,将外植体取出,转入MS+Cef 500 mg/L液体培养基中,100 r/min振荡除菌10 min,再用无菌滤纸将外植体表面液体吸干,转入MS+NAA 0.4 mg/L+Cef 500 mg/L培养基中,20—25 ℃、遮光培养,每周更换一次培养基.待诱导出的毛状根长至3 cm左右,剪下置于B5+KT 1 mg/L+IBA 1 mg/L培养基中培养繁殖.
1.6 毛状根的分子鉴定
利用生工公司植物基因组DNA提取试剂盒提取毛状根和组培苗根的基因组DNA.根据发根农杆菌K599 Ri质粒pRi2659 T-DNA上rolB序列(GenBank:EF433766)设计引物5’-GCCAGCATTTTTGGTGAACT-3’和5’-CTGGCCCATCGTTCTAAAAA-3’,利用PCR扩增仪对DNA进行扩增,PCR反应程序为:94 ℃预变性5 min,按94 ℃变性45 s、55 ℃退火45 s、72 ℃延伸90 s的程序进行30个循环,循环结束后在72 ℃下延伸10 min结束反应.扩增产物在1.2%的琼脂糖凝胶上电泳1 h (5 V/cm),溴化乙锭染色,凝胶成像系统观察和拍照记录.
2 结果与分析
2.1 不同消毒剂对温郁金外植体消毒的效果
不同消毒剂对温郁金叶、茎和根的消毒效果差异明显(表1).其中,0.1%升汞水溶液处理外植体20 min消毒效果最佳.
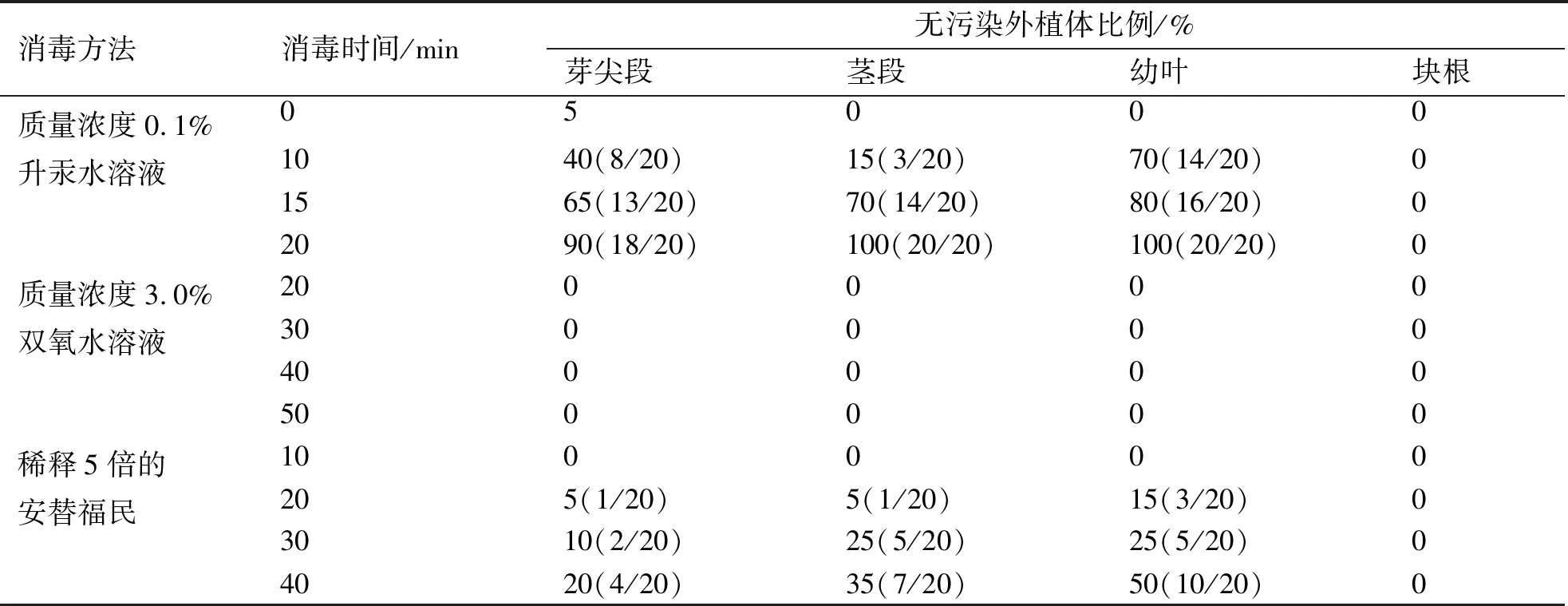
表1 不同方法对外植体消毒的效果Tab.1 Results of explant contamination by different disinfection methods
2.2 外植体的消毒方法对丛生芽的影响
0.1%升汞水溶液消毒20 min以及稀释5倍的安替福民消毒的外植体均出现黄化枯死;而0.1%升汞水溶液消毒10 min的茎尖端培养,能较好分化出芽丛(表2).为此,选择0.1%升汞10 min的灭菌方法,利用芽尖段作为外植体,做进一步优化实验.在接种的100个芽尖端外植体中,全部无污染.培养3—5 d,芽尖靠基部的区段可见有膨大萌动;15—20 d可见分化出小的芽丛.所有接种的茎尖端外植体均能全部再分化出芽丛,芽的再生率可达100%.培养25—30 d后,形成大量的芽丛.将再生的芽生丛切割后,转入MS+6-BA 0.5 mg/L+IAA 0.5 mg/L培养基中,再经过15—20 d,可获得含粗壮根系的完整植株.洗除植株根的基部培养基,移栽至培养土中,散射光下10 d后转入室外,在自然条件下生长能获得健壮的实生苗(图1).
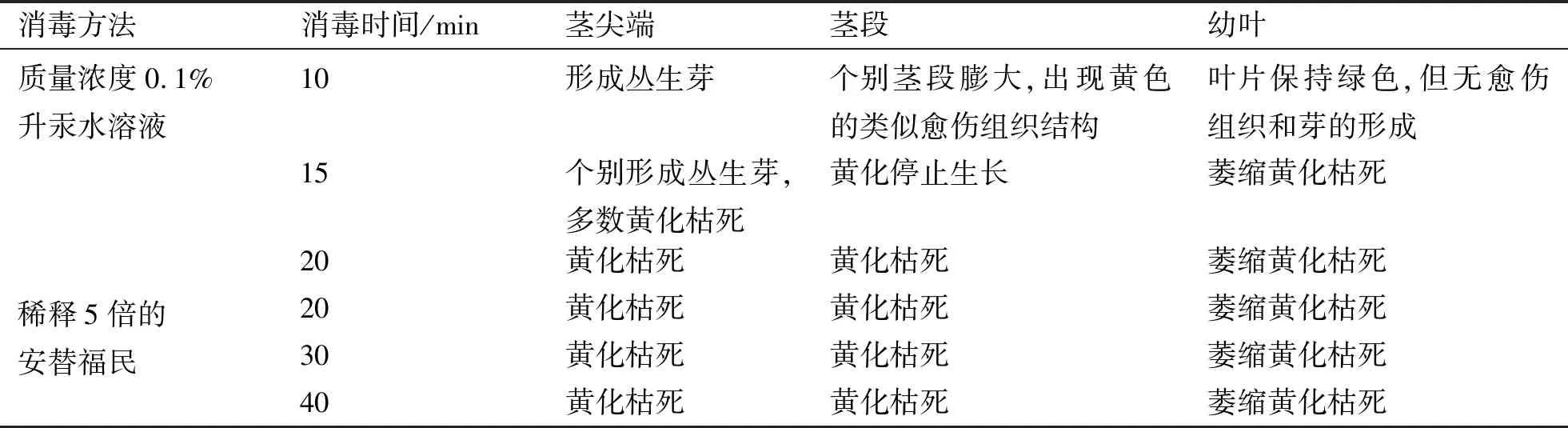
表2 不同消毒方法以及不同外植体再分化结果Tab.2 Results of redifferentiation of different explants with different disinfection methods




A:接种的芽尖段;B:芽尖诱导出的丛生芽;C:移栽到盆钵中组培苗;D:移栽成活的组培苗
2.3 毛状根的诱导和繁殖
发根农杆菌K599侵染叶片后,培养过程中叶片逐渐变黄,未能诱导出毛状根;侵染茎后20 d左右,在茎的下端会长出毛状的不定根,诱导率为35.6%(16/45);侵染块根后20 d左右,在根的伤口处长出绒状的不定根,诱导率为30%(6/20);侵染根茎段后20 d左右,在根和茎端均可诱导出不定根,诱导率可达75%(15/20)(图2).待毛状根长至3 cm左右,剪下置于繁殖培养基中能进一步生长发育.
2.4 毛状根的分子鉴定
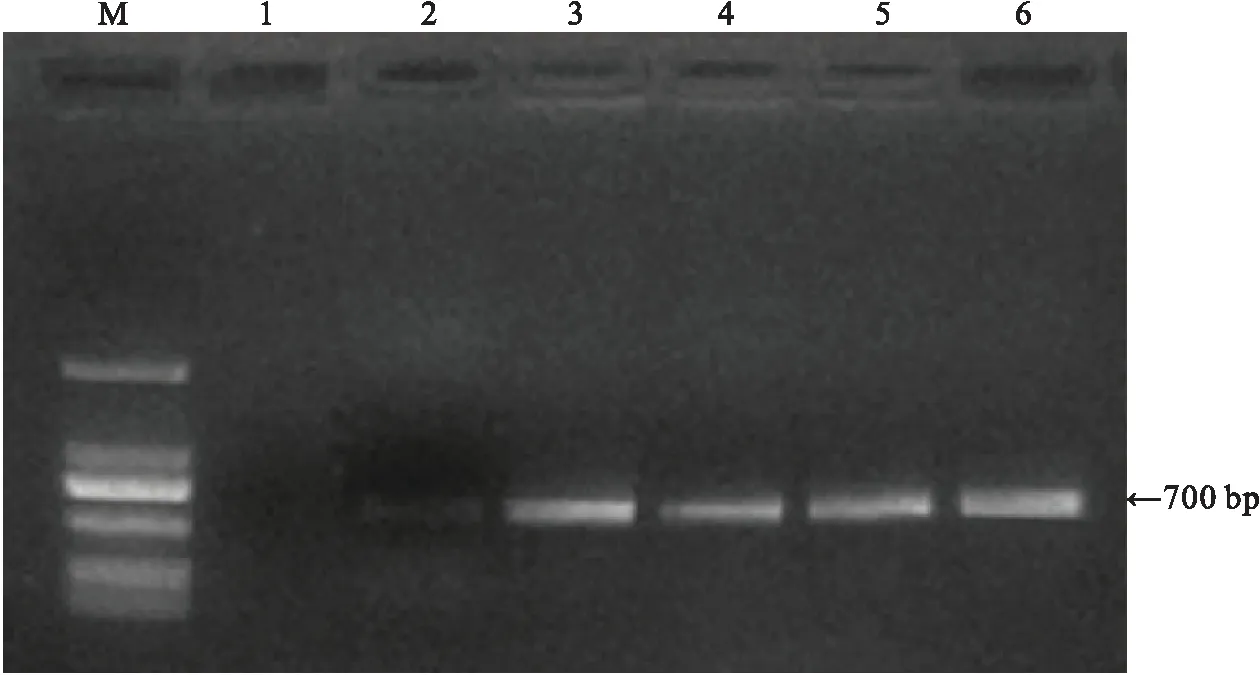
M:DS2000 DNA标准分子量;1:普通组培苗的根;2:发根农杆菌K599菌液;3—6:从根茎上诱导的毛状根
鉴于根茎段诱导毛状根的诱导率最高,选用rolB基因引物对根茎段诱导的毛状根进行PCR扩增,结果显示,能从诱导的毛状根中扩增出大小约700 bp的特征条带,而温郁金组培苗的根,则无条带(图3).进一步说明,诱导出的不定根为毛状根.
3 讨论
通过植物组织培养技术可为提纯复壮温郁金提供资源,实现快速繁殖获得良种.汪洪等和王晓慧等分别报道以温郁金的主根茎和根茎上大约0.5 cm的芽作为外植体,通过愈伤组织的诱导和再分化获得了再生植株[18-19].吕德任等利用剥离的温郁金茎尖生长点作为外植体,污染少;但采用其他的外植体,则污染率极高[20].本研究通过剪取块根上的芽尖端作为外植体,用0.1% HgCl2消毒外植体,外植体无污染情况出现;而且,外植体可以直接再生丛生芽,芽的再生率可达100%.本研究提供了一种无污染、高效的快速繁殖温郁金的方法,克服了目前温郁金组织培养污染严重、再生频率低等问题,在生产实践中有利于温郁金的品种改良.
另一方面,毛状根可以作为生物反应器生产药用成分,可实现在发酵罐中工厂化培养繁殖[21-22].本研究利用发根农杆菌K599侵染温郁金的茎、根以及根茎段,均成功诱导出了毛状根,其中,根茎段的诱导毛状根的频率较高,初步建立了毛状根诱导的技术体系.因此,利用温郁金的毛状根,可望实现工厂化生长并提取温郁金抗癌药用成分β-榄香烯等.由发根农杆菌诱导的毛状根中β-榄香烯含量如何?如何实现温郁金毛状根在发酵罐中的大量繁殖、以及如何从毛状根中高效提纯药用成分,尚待进一步分析和研究.

