靶向肿瘤血管生成的天然产物研究进展
张 冰,炎士珂,包春玲,刘 宁
1上海海洋大学 食品学院;2上海健康医学院附属第六人民医院东院 妇产科;3上海水产品加工及贮藏工程技术研究中心,上海 201306
传统的肿瘤治疗主要通过作用于肿瘤细胞生长的不同环节抑制或杀伤肿瘤细胞,虽取得显著成效,但易产生耐药性[1]及严重的不良反应。1971年,Folkman等[2]详细报道了血管生成(angiogenesis)在肿瘤生长和转移过程中的重要作用,并提出通过抑制血管新生控制肿瘤细胞生长的假说,这为肿瘤治疗提供了新的思路。血管生成是从已有的血管中生长或分裂新的血管的复杂过程,与许多病理过程有关[3],是实体肿瘤的十大特征之一[4],更是肺癌[5]、肝癌、肾癌[6]、直肠癌[7]和卵巢癌[8]等多种癌症的治疗靶点[9]。近年来的研究表明,肿瘤生长和转移依赖于新血管生成提供的氧气和营养物质[10]。若抑制肿瘤血管生成,肿瘤会进入“休眠状态”,肿瘤细胞的增殖率与死亡率会达到平衡[11]。因此,抑制血管生成可通过切断肿瘤细胞的营养来源和氧的输送来抑制肿瘤的生长和转移。
肿瘤血管生成过程受到多种血管生成促进因子和抑制因子的共同调节,一旦破坏二者的平衡就会激活“血管生成开关”,肿瘤开始生成新的血管[12]。其中血管内皮生长因子(vascular endothelial growth factors,VEGF)是目前发现的对血管形成最有效的特异性促进因子[13],可由肿瘤细胞、内皮细胞、间质细胞等多种细胞分泌。VEGF及血管内皮生长因子受体(vascular endothelial growth factors receptor,VEGFR)在肿瘤血管生成中发挥关键作用,VEGF与VEGFR结合后可以激活下游通路PI3K/Akt、PTEN/Akt、Akt/mTOR、NF-κB和MAPK/ERK等引起血管内皮细胞的增殖、分化、迁移从而促进肿瘤血管生成[14]。此外,还有许多其他促血管生成因子,如血小板衍生生长因子(platelet-derived growth factor,PDGF)[15]、成纤维细生长因子(fibroblast growth factor,FGF)[16]、缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)[17]、血管生成素(angiopoietins,ANG)、胰岛素样生长因子(insulin-like growth factor,IGF)、基质金属蛋白酶(matrix metalloproteinases,MMP)[18]和肿瘤坏死因子(tumor necrosis factor,TNF)等[19]。其中,PDGF家族配体与血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)结合后,通过激活下游Ras/MAPK、JAK/STAT、NF-κB信号通路,引发ERK1/2磷酸化,促进ANG、VEGF等血管生成因子分泌,刺激内皮细胞增殖,参与调节血管成熟和肿瘤细胞迁移。FGF和成纤维细胞生长因子受体( fibroblast growth factor receptor,FGFR)除了可以调节正常细胞的生长、分化外,还可以促进肿瘤血管密度和通透性,协同VEGF共同诱导血管生成[20]。已有研究报道表达FGF可以激活下游的Ras/MAPK、PI3K /Akt 和PKC等信号通路促进肿瘤细胞的增殖、分化和血管生成[21]。PDGF、FGF 和VEGF之间的协同被认为是血管生成和转移的重要过程。此外,在肿瘤细胞中,HIF-1的活性水平与其侵袭、转移、血管生成和治疗抵抗有密切关系。缺氧状态下,肿瘤细胞中PI3K/Akt和Ras/Raf/MAPK通路被激活后,诱导HIF-1α蛋白的合成,同时,HIF-1α与HIF-1β可以结合形成HIF-1异二聚体[10],与靶基因启动子/增强子区的HRE元件结合,从而参与VEGF等血管生成相关基因的转录,促进肿瘤血管生成。随着科学家们对肿瘤血管生成调节机制的深入研究,发现阻断促血管生成因子与其特异性受体结合,抑制其在内皮细胞中的信号通路激活,进而抑制内皮细胞的侵袭、迁移、降低血管通透性等生物学特性是抑制肿瘤血管生成的主要作用机制。因此,通过阻断肿瘤血管的生成,可以切断肿瘤细胞的营养供应,进而抑制肿瘤的发生发展。目前,靶向血管生成治疗已然成为肿瘤治疗的重要策略,具有广阔的临床应用前景。
近年来,随着化学合成药研发的成本提高、周期延长,成功率大幅下降。尤其是耐药问题的产生很大程度上限制了抗肿瘤药物在临床上的应用和疗效。天然产物(natural products,NPs)由于其结构新颖多样、毒副作用低、生物活性较强、作用机制独特、靶点广泛等优势已经成为新药研发的主要来源,得到了科学家的广泛关注。1804年Friedrich从罂粟中分离得到纯的吗啡[22],开创了NPs研究的先河。NPs是指来源于自然界由生物体产生的具有特殊生物学作用的低分子量有机化合物。NPs一直是药物开发中先导化合物[23]的源泉,尤其是抗癌和抗菌药物[24]。大部分获美国食品药品管理局(FDA)或欧洲医疗机构(EMA)批准的处方药物都是基于天然产物或其衍生物开发的[25],如抗癌天然产物紫杉醇(Taxol®,Paclitaxel),1992年12月获FDA批准上市用于卵巢癌的二线治疗[26]、其衍生物多西紫杉醇(Taxotere®,Docetaxel)也于1996年5月获得FDA批准上市,用于治疗乳腺癌、铂治疗失败后局部晚期或转移性非小细胞肺癌、转移性胃癌和头颈部鳞状细胞癌;1988年7月获得FDA上市批准的长春碱(Vincrex®)被用于治疗膀胱癌、及其他血液和实体癌症包括霍奇金淋巴等;喜树碱衍生物也相继被FDA批准上市,如拓扑替康(Topotecan®,Hycamtin®)于1996年被FDA批准2011年2月25日被FDA批准上市用于一线治疗小细胞肺癌(SCLC),伊立替康(Irinotecan,Camptosar®,Onivyde®)于1996年6月14日被FDA批准上市用于转移性结直肠癌的一线治疗;我国自主研发的抗肿瘤一类新药人参皂苷Rg3[27],在2000年获得了CFDA的新药证书。另外,DX-8951f、GG211、CKD-602、ST1481、BNP-1350、BN80915等喜树碱衍生物新药[28],都还在进一步研究和开发中,已有部分被批准进入临床试验。
本文将重点介绍具有抗肿瘤血管生成活性的天然产物的研究进展,并对其就靶向的血管生成因子进行归类(见表1)。希望能为发现和开发靶向血管生成的抗肿瘤药物以及联合靶向治疗的研究提供理论依据。
1 抑制肿瘤血管生成的靶向天然产物
1.1 靶向VEGF
VEGF是影响肿瘤血管生成的主要血管生成因子之一,它既能刺激新生毛细血管的生长,又能增加血管的通透性[29]。目前报道的靶向VEGF的抗肿瘤药物主要包括多酚类、黄酮类、生物碱类天然产物及其衍生物。其作用机制为通过Raf/MEK/ERK、PI3K/Akt或NF-κB信号途径抑制VEGF的激活或阻断VEGF与VEGFR结合,进而影响肿瘤血管生成。
1.1.1 多酚类
姜黄素(curcumin,1)是从姜黄的根茎中分离纯化的一种具有抗血管生成、抗炎和抗氧化等多种活性的多酚化合物(见图1)[30]。Binion等[31]的研究表明姜黄素可以阻断环氧合酶2(cyclooxygenase-2,COX-2)的表达,抑制PI3K/Akt信号通路下调VEGF的表达,从而抑制VEGF诱导的血管生成,进而抑制肝癌细胞的增殖[32]。羟基酪酸(hydroxytyrosol,HT,2)是一种从橄榄油中获得的酚类化合物,在Lamy等[33]研究中发现HT可以通过抑制酪氨酸残基(Tyr951、Tyr1059、Tyr1175、Tyr1214)的磷酸化及ERK1/2和SAPK/JNK的磷酸化进而达到抗肿瘤的作用,是橄榄油中抑制VEGF诱导的血管生成最有效的化合物。白藜芦醇(resveratrol,RST,3)是来源于葡萄、浆果、花生、桑椹的一种多酚化合物,被证实可以通过阻断Tyr磷酸化下调VEGF的表达及分泌进而抑制VEGF诱导的血管生成[34],具有抗氧化、抗炎和抗肿瘤等多种活性。

图1 姜黄素(1)、羟基酪醇(2)和白藜芦醇(3)的化学结构Fig.1 The chemical structures of curcumin(1),HT(2) and RST(3)
1.1.2 黄酮类
汉黄芩素(wogonin,4)是从黄芩中提取的天然黄酮类化合物(见图2),因其抗氧化、抗炎、抗肿瘤等作用而得到广泛应用。已有研究报道汉黄芩素通过抑制脂多糖(LPS)和PI3K/Akt/NF-κB信号通路诱导的VEGF表达而具有抗肿瘤血管生成活性[35],是潜在的肿瘤治疗药物。穗花杉双黄酮(amentoflavone,5)是一种生物类黄酮,广泛存在于银杏、贯叶连翘等植物中。Tarallo等[36]的研究表明,穗花杉双黄酮可以阻断VEGF与VEGFR-1/-2的相互作用,抑制内皮细胞迁移和毛细血管形成,并且下调白细胞介素家族(interleukin,IL)IL-1β、IL-6等多种内源性炎症因子的表达水平,进而抑制血管生成从而达到抗肿瘤的治疗效果。
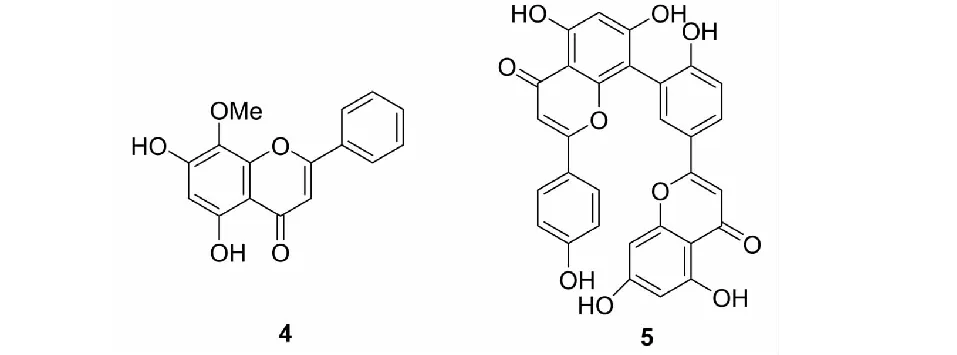
图2 汉黄岑素(4)和穗花杉双黄酮(5)的化学结构Fig.2 The chemical structures of wogonin(4) and amentoflavone(5)
1.1.3 生物碱类
紫杉醇(paclitaxel)是从短叶红豆杉中提取出的一种生物碱药物,具有诱导细胞凋亡、自噬和抗血管生成等多种药理特性。紫杉醇可以通过Raf/MEK/ERK和PI3K/Akt信号途径抑制VEGF的激活和表达,影响内皮细胞的黏附作用,进而发挥抗血管生成的作用。Taxol®作为全球第一个上市的紫杉醇制剂,于1992年12月获得FDA批准上市,用于卵巢癌二线治疗。紫杉醇目前已成为一线抗肿瘤药物,对治疗晚期癌症有显著疗效,且联合MEK抑制剂或PI3K抑制剂可以显著提高治愈率[9]。
1.1.4 其他
人参皂苷Rg3(ginsenoside Rg3)是从红参中提取出来的单体皂苷,有两种常见构型,即20(S)-人参皂苷Rg3(SPG-Rg3)和20(R)-人参皂苷Rg3(RPG-Rg3)。其中SPG-Rg3被证实可以通过下调VEGFR-2,抑制其介导的PI3K/Akt/mTOR信号通路中p-Akt和p-mTOR的表达,进而抑制血管生成。蟾蜍灵(bufalin,6)是蟾蜍毒中的主要生物活性成分[37](见图3),已被证明与抗血管生成抑制剂索拉非尼(sorafenib)联合治疗时,可以通过抑制PI3K/Akt、mTOR/VEGF信号通路下调VEGF的表达进而增强sorafenib的抗血管生成作用[38]。有研究表明,白花蛇虫草(HedyotisdiffusaWilld,HDW)的乙醇提取物可以通过抑制音猥因子(sonic hedgehog,SHH)信号通路关键靶基因VEGF的表达及与特异性受体VEGFR的结合[39],抑制肿瘤血管生成进而发挥抗肿瘤作用。辣椒中的主要活性成分辣椒素(capsaicin,7)具有抑制黑色素瘤侵袭的潜力,其作用机制是通过PI3K/Akt/Rac1信号通路抑制VEGF活性,影响了黑色素瘤的血管生成,从而抑制肿瘤侵袭。Sunilae等[40]研究表明荜茇(piper longum)的醇提取物可以通过抑制VEGF的表达水平调节内皮细胞的存活、分化和增殖,是一种潜在的抗血管生成药物,然而具体的有效活性成分和分子机制还有待于进一步研究。熊果酸(ursolic acid,8)又名乌索酸,是从多种药用植物中分离出来的一种五环三萜化合物[41]。Aryan等[42]的体内研究表明Ursolic Acid可显著降低血清VEGF水平抑制内皮细胞增殖、迁移和侵袭,具有抗血管生成活性,是潜在的癌症预防剂,然而具体的分子机制还有待进一步研究。此外,十字花科蔬菜中富含具有抗肿瘤活性的有效成分异硫氰酸烯丙酯(allyl isothiocyanate,AITC)。在腹水瘤细胞移植小鼠模型中,AITC可通过下调VEGF的表达显著抑制血管新生,是潜在的特异性靶向VEGF的肿瘤血管生成抑制剂[43],然而具体分子机制尚不明确。

图3 蟾蜍灵(6)、辣椒素(7)和熊果酸(8)的化学结构Fig.3 The chemical structures of bufalin(6),capsaicin(7) and ursolic acid(8)
1.2 靶向PDGF
PDGF及PDGFR的表达水平与肿瘤的发生发展、耐药性及不良的临床预后有关[44]。PDGF家族成员及其受体PDGFRs通过向肿瘤血管中招募内皮祖细胞而促进血管的成熟和新生血管的形成。目前开发靶向PDGF的抗肿瘤药物策略主要是通过破坏PDGF与PDGFR之间相互作用抑制肿瘤血管生成,如直接靶向PDGF、用小分子抑制剂阻断PDGFR的酪氨酸激酶活性等[45]。
鞣花酸(ellagic acid,EA)在地榆、石榴和五倍子等中药中含量丰富,是一种由两分子没食子酸聚合而成的小分子多酚化合物[46]。多项研究表明,EA可以通过抑制PDGFB与PDGFR结合阻断下游JAK/STAT途径的激活,进一步抑制STAT3蛋白的表达和磷酸化;同时,EA还可以抑制VEGFR磷酸化,进一步抑制下游Ras/MAPK信号通路中ERK/Akt/JNK的磷酸化[47],具有PDGF和VEGF双靶点抑制血管生成的作用,发挥抗肿瘤的效果。雷公藤甲素(triptolide)是从雷公藤中提取和纯化的一种二萜三环氧化合物。Triptolide可以通过抑制Akt/NF-κB/cyclinD1信号通路活性,下调PDGF基因的表达[48];此外,Zhu等[49]的研究发现Triptolide还可以通过下调ANG,降低VEGF介导信号下游ERK/Akt磷酸化,起到抗肿瘤血管生成的效果,是一种多靶点抗肿瘤治疗药物。飞燕草素(delphinidin,9)是一种膳食花青素,是浆果中含量较高的多酚类物质(见图4),已被报道可以抑制PDGF-BB诱导的ERK1/2磷酸化,以及PDGFR-b的酪氨酸磷酸化,从而抑制PDGF诱导的平滑肌细胞迁移、内皮细胞和平滑肌细胞向毛细血管样结构的形态分化,进而影响肿瘤新生血管稳定性[50],是一种潜在的癌症预防剂。齐墩果酸(oleanolic acid,OA,10)是一种五环三萜类天然产物,广泛分布于夏枯草、橄榄油、连翘、青叶、女贞等植物中,具有多种重要的药理活性。Meng等[51]已发现OA能够通过抑制PDGFR酪氨酸激酶活性和信号传导影响肿瘤血管生成,然而具体分子机制尚不明确。
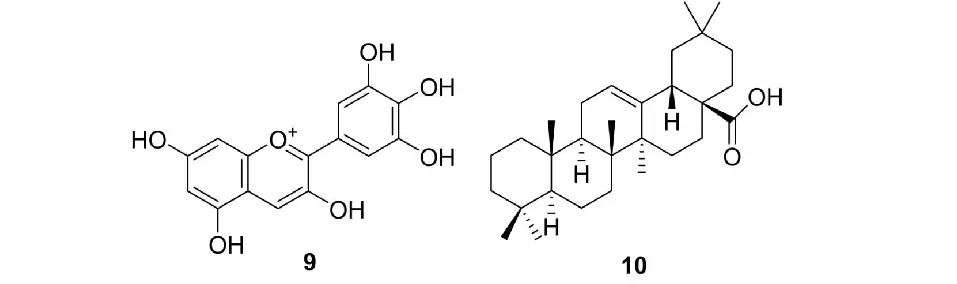
图4 飞燕草素(9)和齐墩果酸(10)的化学结构Fig.4 The chemical structures of triptolide(9) and OA(10)
1.3 靶向FGF
FGF家族由18个配体和4个受体组成,在肿瘤发生发展的多种重要过程中发挥重要作用,例如肿瘤细胞无限增殖[52]、肿瘤血管重塑[53]、血管生成、血管浸润、内皮细胞迁移和侵袭等。许多研究表明,FGF表达也与获得性抗血管生成药物的耐药性有关,抑制FGF的表达可以显著改善上皮间质转化(epithelial-mesenchymal transition,EMT)和耐药性的发生有助于肿瘤治疗的预后[54]。靶向FGF抗肿瘤药物的主要机制是通过阻断FGF与FGFR结合抑制其下游激酶蛋白(ERK1/2、PKC、RSK2)磷酸化,进而抑制肿瘤血管生成和转移。近年来,开发靶向FGF/FGFR的天然小分子抑制剂已然成为抗癌药物研究领域的热点。
二苯乙烯苷(stilbene glycosides)是从药用植物何首乌中分离出来的天然产物,通过抑制ERK1/2磷酸化、降低FGF-2的活性,从而抑制FGF-2与FGFR1/2的相互作用,抑制肿瘤血管生成[55],是一种天然的血管生成抑制剂。青藤碱(sinomenine)是从青藤中提取出的一种生物碱单体,被证明可以通过抑制NF-κB和MAPK信号通路下调FGF基因的表达水平,影响内皮细胞的迁移和侵袭,从而具有抗肿瘤血管生成的活性[56]。蒜氨酸(alliin)是一种来源于大蒜的化合物,可以有效抑制FGF-2和VEGF的释放,是肿瘤血管生成过程的有效抑制剂[57]。此外,Powell等[58]的早期研究表明,在鸡绒毛尿囊膜(CAM)模型中,Alliin可以抑制FGF-2诱导的血管生成,是一种潜在可开发的抗肿瘤天然药物,然而具体分子机制尚待研究。
1.4 靶向HIF-1
缺氧诱导因子HIF-1是一种转录因子,可以转录激活VEGF等多种靶基因,参与调节肿瘤血管生成,与肿瘤的发生、发展[59]相关。因此,HIF-1也被认为是抗癌药物的有效靶点[60]。目前报道的具有抗肿瘤活性的天然产物,大部分是通过调节靶向抑制肿瘤细胞中HIF-1活性及其下游激酶SAPK/JNK和ERK1/2的磷酸化,从而抑制VEGF等促血管生成因子的表达。
1.4.1 黄酮类
芹菜素(apigenin,11)是一种广泛分布于欧芹、洋葱、桔子、茶、洋甘菊、小麦芽等多种植物中的黄酮类化合物(见图5),因具有抑制肿瘤细胞增殖和血管生成的药理活性而被用作健康食品补充剂,对开发新型的肿瘤预防及治疗药物有特殊意义。Apigenin被证明可以通过PI3K/Akt/p70S6K1和HDM2/p53途径降解HIF-1α,干扰HIF-1α与Hsp90的结合,并且抑制缺氧诱导的HIF-1和VEGF的表达[61]进而抑制血管生成。因此,apigenin可以作为一种有效的抗肿瘤血管生成抑制剂。千层纸素(oroxylin A,12)是黄芩中具有主要生物活性的一类黄酮类化合物,是治疗和预防直肠癌的有效候选药物。千层纸素是一种潜在的HIF-1α抑制剂,可以通过抑制PI3K/Akt途径,诱导HIF-1α蛋白失活,还可以调节固醇调节元件结合蛋白(sterol regulatory element binding protein,SREBP)抑制血管生成、影响癌细胞脂肪酸代谢、糖酵解代谢[62]。萝卜硫素(sulforaphane)是一种存在于西蓝花、芽甘蓝和卷心菜等蔬菜中的异硫氰酸盐衍生物。Kim等[63]的研究表明,sulforaphane可在缺氧条件下,抑制结肠癌细胞(HCT116)中HIF-1α和VEGF的表达从而抑制结肠癌的血管生成和转移,被认为是通过抑制血管生成预防和治疗结肠癌的一种天然活性产物。

图5 芹菜素(11)和千层纸素(12)的化学结构Fig.5 The chemical structures of apigenin(11) and oroxylin A(12)
1.4.2 生物碱类
小檗碱(berberine,13)是从黄连中分离得到的生物碱之一(见图6)。Lin[64]等发现berberine以HIF-1为靶点通过破坏HIF-1的稳定性,抑制ERK和PI3K/Akt信号通路,阻断EGFR信号;还可以通过降解HIF-1α蛋白,抑制VEGF在胃癌细胞中的表达。Berberine对肿瘤血管生成的抑制作用涉及多个细胞因子和信号通路,具有多途径、多靶点的特点。在天然产物组合文库中筛选出的新型HIF-1小分子抑制剂103D5R,可以通过减少HIF-1的合成而快速下调HIF-1α的蛋白表达,同时通过抑制Akt、SAPK/JNK和ERK1/2的磷酸化阻止HIF-1下游靶基因VEGF和GLUT-1的转录[65],是潜在的靶向HIF-1的抗血管生成药物。

图6 小檗碱(13)的化学结构Fig.6 The chemical structure of berberine(13)
1.4.3 萜类
从日本落叶松根皮中分离得到的伪极酸B(pseudolaric acid B,PAB,14)是一种天然二萜类化合物(见图7),与肿瘤血管生成密切相关[66]。有研究表明PAB不仅可以直接抑制内皮细胞的增殖、迁移,具有抗血管生成活性,而且可以通过抑制HIF-1,进而下调VEGF的表达,达到抗肿瘤血管生成的效果。尾叶香茶菜丙素(kamebakaurin,15)是从尾叶香茶菜中分离出的一种二萜类化合物,对缺氧或CoCl2诱导的HIF-1激活具有较强的抑制作用[67]。Kamebakaurin能够抑制HIF-1α蛋白的合成和积累,下调HIF-1靶基因VEGF和促红细胞生成素(EPO)的表达。Kamebakaurin具有很强的抗肿瘤活性。

图7 伪极酸B(14)和尾叶香茶菜丙素(15)的化学结构Fig.7 The chemical structures of PAB(14) and kamebakaurin(15)
1.4.4 苯醌类
9-β-D-阿拉伯呋喃磺酰-2-氟腺嘌呤又名弗达拉滨(fludarabin)是一种核苷酸类似物,已被证明可以通过抑制Akt激活活化下调HIF-1的表达,从而抑制VEGF的转录激活[68]抑制血管生成,达到抗肿瘤的效果。1997年,Adkins等[69]的临床研究中表明Fludarabin是一种有效且普遍耐受的抗肿瘤药物。格尔德霉素(geldanamycin,GA)是一种天然的阿那霉素抗生素,具有抗血管生成的活性。GA可以显著下调HIF-1α的蛋白表达水平[70],同时阻断HIF-1转录激活VEGF、GLUT-1等靶基因,显著降低VEGF中mRNA积累,从而具有抗血管生成活性。此外,GA衍生物17-脱甲氧基-17-烯丙胺基格尔德霉素(17-allylamino-17-demethoxygeldanamycin,17-AAG),是具有抗热休克蛋白90(heat shock protein 90,Hsp90)增殖活性的的苯醌类安塞霉素化合物[71]。17-AAG作为Hsp90抑制剂可以通过抑制HIF-1的转录活性[72],同时下调Akt1、ERK、EGFR、HER-2、Raf-1、VEGF的表达,因此也具有抑制肿瘤血管生成的药效,是靶向肿瘤细胞中HIF-1的小分子抑制剂的理想候选药物[70]。
1.4.5 其他
番荔枝内酯(annonaceous acetogenins,16)是木瓜中的一种内酯类活性成分(见图8)[73],可以通过阻断缺氧微环境诱导的HIF-1蛋白活化,同时抑制HIF-1下游靶基因VEGF和GLUT-1的表达,进而抑制肿瘤血管生成[74]。癌症患者可以食用含有番荔枝内酯的膳食补充剂作为治疗替代药物。六氢大麻素类似物LYR-8(hexahydrocannabinol analog LYR-8)是大麻素的衍生物,被报道除了可以抑制肿瘤血管生成,还参与调节肿瘤细胞生长和凋亡等多种生物学特性。LYR-8可以抑制PI3K/Akt信号通路,同时阻断HIF-1α的转录激活,进而抑制VEGF、COX-2等促血管生成因子的表达,最终抑制肿瘤血管生成。综上,LYR-8是潜在的靶向HIF-1的抗肿瘤药物[75]。抗坏血酸呋喃酮(ascofuranone,17)是从真菌子囊菌中分离出来的一种天然化合物,具有显著的抗肿瘤活性,包括抑制肿瘤血管生成、阻断细胞周期、抑制细胞侵袭等。Jeong等[76]已报道Ascofuranone可以通过抑制Akt/mTOR/p70S6K途径抑制HIF-1因子表达,从而下调VEGF的表达,进而抑制肿瘤血管生成,是一种潜在的抗肿瘤药物。天然产物苦皮藤醇(piceatannol,PCT,18)是从大戟种子中分离出的一种羟基二苯乙烯,可以通过抑制HIF-1α蛋白的表达显著下调靶基因VEGF的表达[77],进而调节肿瘤血管生成,从而达到抗肿瘤的效果。2-甲氧基雌二醇(2-methoxyestradiol,2ME2)是雌二醇的天然代谢产物,一方面可以下调HIF-1α的表达,抑制HIF-1的转录活性发挥抗血管生成作用[78],另一方面通过产生活性氧(ROS)诱导肿瘤细胞凋亡[79],是一种有前景的癌症治疗药物。

图8 番荔枝内酯(16)、抗坏血酸呋喃酮(17)和苦皮藤醇(18)的化学结构Fig.8 The chemical structures of annonaceous acetogenins(16),ascofuranone(17) and PCT(18)
1.5 其他
1.5.1 血管生成素(ANG)
ANG家族包括4个配体(Ang-1/2/3/4)和两个相应的内皮细胞受体(Tie-1/2),其中,ANG1和ANG2在肿瘤血管生成中发挥着关键作用。ANG-1由周细胞产生,是血管成熟的关键因子,通过激活Tie-2介导内皮细胞的迁移、粘附和存活,增加血管稳定性。ANG-2可以拮抗ANG-1从而破坏血管稳定性,同时破坏内皮细胞和血管周围细胞之间的联系,促进细胞死亡,并且ANG-2可与VEGF协同诱导异常血管生成,阻断ANG-2表达可以有效抑制VEGF信号[80],达到抗肿瘤的效果。因此,有必要对靶向ANG的天然产物进行研究,以开发有疗效的抗肿瘤药物。目前已有报道发现三叶丹参的甲醇提取物(Salviatrilobaextract,STE)可以显著降低前列腺癌细胞中ANG、IL-6、EGF和VEGF等细胞因子的表达,抑制血管生成[81],从而达到抗肿瘤的效果。STE虽具有潜在的抗肿瘤活性成分,但需要进一步分离、鉴定提取物中具有此生物活性的天然产物成分,进一步研究其抗肿瘤血管生成的分子机制。
1.5.2 胰岛素样生长因子(IGF)
IGF-1/2是一个与胰岛素高度同源的蛋白质家族,在调节内皮祖细胞的增殖、迁移、新血管的形成等方面也起着重要作用,可以促进肿瘤血管生成。窃衣素(torilin)是1969年从小窃衣果实的甲醇提取物中分离出来的一种倍半萜化合物[82]。有研究表明,在缺氧条件下,Torilin可以显著下调缺氧诱导的IGF-2和VEGF表达,减少血管内皮细胞的形成、抑制血管生成,进而具有抗癌活性。因此,窃衣素可能是一种有潜力的血管生成抑制剂。
1.5.3 基质金属蛋白酶(MMPs)
MMPs 是一种锌离子依赖的蛋白内肽酶,在许多肿瘤细胞中过表达。MMPs可以调节肿瘤血管新生、介导肿瘤细胞对宿主细胞外基质(ECM)降解、细胞黏附因子的功能及调控肿瘤细胞的生长[83]。刺芒柄花素(formononetin)是从黄芪中分离出的一种异黄酮类成分,同时作为一种植物雌激素,具有抗肿瘤、降血脂、抗氧化、抗炎等多种药理作用[84]。Kathy等[85]报道Formononetin可以抑制MMP-2和MMP-9的蛋白表达,引起细胞外基质中的Ⅳ型胶原蛋白裂解,下调TNF-α和IL-6的分泌,进而抑制内皮细胞的迁移及肿瘤血管生成。
1.5.4 肿瘤坏死因子(TNF)
TNF是一种有激酶活性的同三聚体形式的跨膜糖蛋白,由内皮细胞、巨噬细胞、树突状细胞、淋巴细胞和MCs合成,由TNF转化酶从细胞表面释放,生理活性功能包括促进肿瘤血管生成、促进癌细胞存活、迁移和侵袭等。肿瘤细胞对TNF的反应是通过肿瘤坏死因子受体1/2(TNFR-1/2)介导的,TNFR-1可以激活MAPK和PI3K/Akt信号通路影响肿瘤的发生发展;TNFR-2可以通过内皮/上皮酪氨酸激酶(ETK)的磷酸化,激活PI3K/Akt途径调节细胞间的相互作用包括内皮细胞的迁移与增殖,促进血管生成反应。T复合环肽-1(tailless complex polypeptide 1,TCP-1)是一种生物体内普遍存在的环肽,已被发现作用于直肠癌中的血管生成系统[86]。高剂量的TCP-1与TNF-α联合作用显示出降低新生血管数量、诱导细胞凋亡、减少细胞增殖等抗肿瘤活性[87]。TCP-1还可以作为载体靶向呈递抗肿瘤化疗药物[88]。然而TCP-1作用于肿瘤血管生成的机制尚待进一步研究。

表1 抗血管生成天然产物

续表1(Continued Tab.1)
2 结论与展望
随着近年来对血管生成在肿瘤发生发展过程中所发挥的重要生理功能,以及对靶向促血管生成因子抑制肿瘤血管生成的分子机制的深入研究。已有报道发现,在使用靶向血管生成因子药物一段时间后,部分受试者会出现治疗抵抗、产生耐药[89]。目前发现的抗血管生成治疗的耐药机制包括通过发生EMT[90]、促进癌细胞扩散和转移[91]、抑制正常组织中血管生成[92]等。此外,在抗VEGF治疗中激活其他血管生成相关因子如MMP-9、HIF-1等也可能产生耐药性[93]。这些问题的存在很大程度上限制了抗肿瘤血管生成药物的临床使用药效。
相较于化学合成药物而言,天然产物的结构多样、具有多成分、多靶点的独特优势,较单用某种靶向促血管生成因子的药物疗效更佳。同时天然产物的毒副作用小、耐受性好,是研发新型药物的重要方向。近年来,越来越多具有抑制血管生成活性的天然产物被发现,并被开发成为潜在的靶向型抗肿瘤药物。然而,还存在因天然产物中活性成分的复杂性导致的提取加工困难、作用机制不明确等诸多问题。因此可以通过1)修饰结构、利用计算机辅助设计技术及新型药物递送技术优化天然产物存在的缺陷,并为开发基于天然产物的靶向血管生成药物的开发提供借鉴和帮助;2)利用高通量筛选、基因组学分析等方法发现更多的靶向血管生成的天然产物,并深入研究其中的活性成分及作用机理;3)临床上可以通过天然产物联合放化疗的联合治疗等方式提高疗效。现如今自然界拥有丰富的天然产物资源,如何更合理的开发利用这些资源,使其最大限度发挥作用,在今后的研究中还有待研究者们一起努力。

