基于网络药理学与分子对接技术的清瘟护肺颗粒防治新型冠状病毒肺炎(COVID-19)的潜在药效物质研究
刘琪琪,李 纯,周 洁,孙婷婷,狄志彪,李 晔,,刘 洋*,张 红*
1陕西中医药大学药学院,咸阳 712046;2陕西省中医药研究院,西安 710003
2019年12月以来,由新型冠状病毒(SARS-CoV-2)感染引起的急性肺炎在全世界相继爆发,截止2020年10月22日,新型冠状病毒肺炎(COVID-19)累计确诊人数达1 288万余人,死亡率在某些国家已超过10%,目前尚未发现特效药[1]。中医药抗击瘟疫已有千年的历史,并在抗击COVID-19中取得了瞩目的疗效,COVID-19初起表现为发热、干咳、乏力,与温病上焦卫气同病证相似;出现昏迷、甚至死亡与“逆传心包证”相吻合;恢复期乏力的表现与肺胃阴伤的温病学证候特点相似[2],据患者不同体质对症下药,标本兼治,可以有效改善患者的症状。国家卫健委及国家中医药管理局颁发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中推荐不同的复方和中成药对症治疗[3]。从疗效、安全性、经济性等方面分析,中医药在防治COVID-19 都具有很大的优势。因此研究防治新冠肺炎的中药复方及其作用机理,具有重要意义。
清瘟护肺颗粒是陕西省中医药研究院针对本次新冠疫情研发的防治COVID-19的院内制剂,已通过了省药品监督管理局的审批(陕药监函[2020]60号),于2月17日生产上市,销量良好[4]。该复方是在银翘散、玄麦甘桔汤和四君子汤基础上进行加减而成,由金银花、连翘、大青叶、玄参、杏仁、浙贝母、桔梗、苏叶、防风、炒白术、茯苓、茵陈、党参、竹叶、麦冬、生甘草十六味药组成[5]。清瘟护肺颗粒具有疏风解热,清肺止咳的功效,主治瘟病初起,见有发热、干咳、咽痛、食少等症状,适用于新型冠状病毒感染疑似及新型冠状病毒感染的轻症。现代药理学研究表明本方中多味中药可通过抑制机体固有免疫的激活,抗炎解热,减轻肺脏等组织损伤[6]。
2007年,英国药理学家Hopkins在Nature Biotechnology杂志中首次提出“网络药理学(network pharmacology)”的概念,其对药物-药物、药物-疾病网络进行了分析,阐释了中药治疗疾病的机理,不再局限于单个成分、单个靶标、单一疾病的研究思想,为中医药的研究与发展提供了新的思路[7]。基于几何匹配和能量匹配的“锁-钥原理”的分子对接技术,可用来分析蛋白质-配体识别,已经成为中医药现代化研究的有力工具。分子对接的可靠性取决于所采用的评分函数的准确性,计分功能可用于确定配体的结合模式和位点,预测结合亲和力,并识别给定蛋白靶标的潜在药物先导[8]。研究已证实COVID-19病毒有效靶点SARS-CoV-2 3CL水解酶在病毒多蛋白的蛋白水解过程中起关键作用,是病毒复制和功能所必需的蛋白,被认为是关键的药物靶点。血管紧张素转化酶II(ACE2)在介导SARS-CoV-2入侵细胞、促进病毒复制、加重急性肺损伤方面发挥重要作用,也是潜在的药物筛选靶点可以作为一种新型的生物疗法来拦截病毒,可抑制感染的进展,减轻肺损伤。RNA依赖的RNA聚合酶(RdRp)是病毒RNA复制的关键酶,可抑制病毒RNA的复制[9]。本研究基于网络药理学方法和分子对接技术探讨清瘟护肺颗粒药效成分、作用靶点及信号通路,为深入研究其防治COVID-19的药效物质基础提供参考。
1 材料与方法
1.1 中药化学成分和疾病相关靶点筛选
利用中药系统药理学分析平台(TCMSP,http://lsp.Nwu.edu.cn /tcmsp.Php)、BATMAN-TCM(A Bioinformatics Analysis Tool for Molecular MechANis of Traditional Chinese Medicine,http://bionet.ncpsb.org/)及中医药整合药理学研究平台(TCMIP,http://www.tcmip.cn/)数据库筛选清瘟护肺颗粒中十六味中药材的活性成分及相关靶点。利用UniProt数据库(https://www.uniprot.org)将所有蛋白的名称进行标准化,得到靶标蛋白所对应的基因名称。
1.2 疾病靶点筛选
利用GeneCards(https://www.genecards.org/)和OMIM(https://www.omim.org/)数据库分别以“novel coronavirus”、“Coronavirus 2019 ”、“novel coronavirus pneumonia”为关键词检索疾病相关靶点。
1.3 靶点映射与靶蛋白互作分析
本实验将药物靶点与疾病靶点上传至venny2.1.0 (https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,得到药材活性成分相关靶点与疾病靶点的交集靶点。将清瘟护肺颗粒防治COVID-19的交集靶点导入String数据库(https://string-db.org /)进行分析,并利用Cytoscape3.7.1软件构建蛋白互作网络图(protein protein interaction network,PPI)。利用软件中“Network Analyzer”功能,并根据拓扑学参数中的degree值和score值设置节点大小及颜色反应。其中degree值是网络分析中刻画节点中心性的最直接度量指标。节点degree值越大,该节点越重要。Score值反映了该节点及周边节点的密集程度,节点score值越大,该节点连接的节点数越多。
1.4 GO富集分析及KEGG通路富集分析
利用R3.6.0软件对药材与疾病的交集靶点进行GO(Gene Ontology)生物信息学富集,分别从基因靶点的分子功能(molecular function,MF)、所处的细胞位置(cellular component,CC)和参与的生物过程(biological process,BP)三个方面分析,P值设为P≤ 0.05,利用Origin软件作条形图可视化分析。利用R语言中Cluster profiler数据包对药材与疾病的交集靶点进行KEGG通路富集分析。通过查阅文献及degree排名,筛选20条相关KEGG通路,采用ggplot2数据包对KEGG通路富集结果进行可视化分析。
1.5 网络构建与分析
利用Cytoscape3.7.1软件,将清瘟护肺颗粒药材、活性成分及疾病交集靶点导入软件进行可视化分析,利用Cytoscape3.7.1软件中的Merge功能,构建药材-成分-靶点(herb-compounds-target)网络关系图,根据网络拓扑学参数中的紧密中心性(closeness centrality,CC)、介数中心性(betweenness centrality,BC)和度值(degree)进行分析。根据KEGG富集结果筛选出的20条通路,利用Cytoscape3.7.1软件中的Merge功能构建靶点-通路(target-pathway),根据网络中的拓扑学参数BC、CC、Degree进行分析,得出清瘟护肺颗粒防治COVID-19的主要活性成分和重要靶点。
1.6 分子对接
利用RCSB PDB数据库(https://www.rcsb.org/)下载由上海科技大学饶子和杨海涛团队提供的COVID-19病毒有效靶点SARS-CoV-2 3CL水解酶(SARS-CoV 3CLpro)(PDB ID:6LU7)、血管紧张素转化酶II(ACE2) (PDB ID:1R42)和RNA依赖的RNA聚合酶(RdRp)(PDB ID:6L4R)的PDB格式文件用于分子对接研究,下载清瘟护肺颗粒中槲皮素、β-谷甾醇、汉黄芪素、木犀草素的mol2格式文件。利用AutoDock4.2.1软件进行分子对接,预测配体与受体之间最佳的结合模式[10]。
2 结果与分析
2.1 清瘟护肺颗粒活性成分的筛选
本研究通过TCMSP数据库,BATMAN-TCM数据库及TCMIP数据库得到清瘟护肺颗粒16味药材的化学成分,其中金银花63个、连翘67个、大青叶34个、玄参39个、杏仁82个、浙贝母57个、桔梗39个、苏叶48个、防风50个、炒白术27个、茯苓48个、茵陈85个、党参83个、竹叶7个、麦冬2个、生甘草92个合计823个化学成分,筛选重复后得到473个化学成分。其相关作用靶点共13 101个,筛选重复后得到878个靶点。
2.2 疾病靶点的筛选
通过OMIM和GeneCards数据库分别以“novel coronavirus”、“coronavirus 2019”、“novel coronavirus pneumonia”为关键词检索疾病靶点,分别检索到529、438、791个靶点,筛选重复后得到787个疾病靶点。
2.3 交集靶点收集与PPI网络图的构建
将药材成分靶点与疾病靶点通过韦恩图映射,得到123个疾病与药材成分的交集靶点,结果见图1。将交集靶点导入STRING数据库,利用Cytoscape3.7.1软件构建PPI网络图,如图2所示,该网络图共有82个节点,241条边,其degree 值越大,节点越大;Combine score 值越小,颜色越明亮;degree 值越小,线条越细。

图1 成分与疾病靶点交集分布Fig.1 Distribution of Intersection Compounds and Disease Target
2.4 GO生物过程和KEGG通路富集分析
本研究为更好阐明清瘟护肺颗粒防治COVID-19的作用机制,将药材与疾病的交集靶点导入R3.6.0软件中,对靶蛋白进行GO生物学功能分析,P≤0.05,利用origin软件可视化分析,结果见图3。GO分为分子功能MF、BP和CC三个部分。其中横坐标表示富集靶点的数目,纵坐标代表GO富集分析的过程。利用R语言对靶蛋白进行KEGG通路分析,富集到136条通路,通过查阅文献及degree排名,筛选出20条主要相关通路,包括MAPK、PI3K/AKT、IL-17、HIF-1等信号通路。采用ggplot2数据包对KEGG通路富集结果进行可视化分析,连接度越高,圆圈越大,P值越高,颜色越偏向红色,结果见图4。
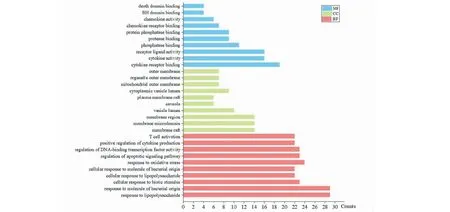
图3 清瘟护肺颗粒防治COVID-19的GO功能分析Fig.3 GO function analysis of Qingwen Hufei granules in the treatment of COVID-19
2.5 药材-成分-靶点网络构建分析
将药材、药材活性成分、交集靶点与疾病生成关联表,导入Cytoscape3.7.1软件构建清瘟护肺颗粒的“药材-成分-靶点”关联网络,结果见图5。构建的关联网络包括251个节点和1143个边。根据拓扑学参数分析,得出同时满足大于BC、CC、degree三个均值筛选得到槲皮素、汉黄芪素等15个药效成分,结果见表1。
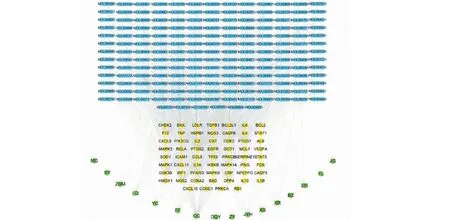
图5 清瘟护肺颗粒防治COVID-19药材-成分-靶点网络图Fig.5 Herb-compound-targe tnetwork of Qingwen Hufei granules in the treatment of COVID-19注:绿色椭圆:中药材;蓝色方块:活性成分;黄色菱形:靶点。Note:Green ellipse:Herb;Blue diamond:Compound;Yellow rhombus:Target.

表1 清瘟护肺颗粒防治COVID-19的药效成分
2.6 靶点-通路网络构建分析
根据KEGG富集分析结果及查阅文献筛选得到20条通路,导入Cytoscape3.7.1软件构建清瘟护肺颗粒的“靶点-通路”关联网络,结果见图6,图中包括74个节点,334条边。根据拓扑学参数分析,得出同时满足大于BC、CC、degree三个均值的15个靶点,分别为MAPK1、MAPK3、RELA、IL6、MAPK8、BCL2、TNF、MAPK14、PRKCB、CCND1、STAT3、IL1β、CASP3、PRKCA、EGFR,结果见表2。

图7 SARS-CoV-2 3CL水解酶、ACE2及RdRp与药效成分的分子对接图Fig.7 Molecular docking diagram of 7SARS-CoV-23CL hydrolase,ACE2 and RdRp with active compounds注:a.ACE2-β-谷甾醇;b.ACE2-汉黄芪素;c.ACE2-木犀草素;d.ACE2-槲皮素;e.SARS-CoV-23CL水解酶-β-谷甾醇;f.SARS-CoV-23CL水解酶-汉黄芪素g.SARS-CoV-23CL水解酶-木犀草素;h.SARS-CoV-23CL水解酶-槲皮素;i.RdRp-β-谷甾醇;j.RdRp-汉黄芪素;k.RdRp-木犀草素;l.RdRp-槲皮素。Note:a.ACE2-β-sitosterol;b.ACE2-wogonin;c.ACE2-luteolin;d.ACE2-quercetin;e.SARS-CoV-2 3CL hydrolase-β-sitosterol;f.SARS-CoV-2 3CL hydrolase-wogonin;g.SARS-CoV-2 3CL hydrolase-luteolin;h.SARS-CoV-2 3CL hydrolase-quercetin;i.RdRp-β-sitosterol;j.RdRp-wogonin;k.RdRp-luteolin;l.RdRp- quercetin.
2.7 潜在药效成分与ACE2、SARS-CoV-23CL水解酶和RdRp的分子对接结果分析
根据拓扑学分析清瘟护肺颗粒在“药材-成分-靶点”网络图得到排名较高的药效成分,通过Autodock4.2.1软件将药效成分汉黄芩素、槲皮素、木犀草素、β-谷甾醇与SARS-CoV-2 3CL水解酶和ACE2进行分子对接,结果见图7。 其中清瘟护肺颗粒中化合物汉黄芩素、槲皮素、木犀草素、β-谷甾醇与SARS-CoV-2 3CL水解酶、ACE2和RdRp均小于-5 kcal/mol,表明均有较好的亲和性,结果见表3。
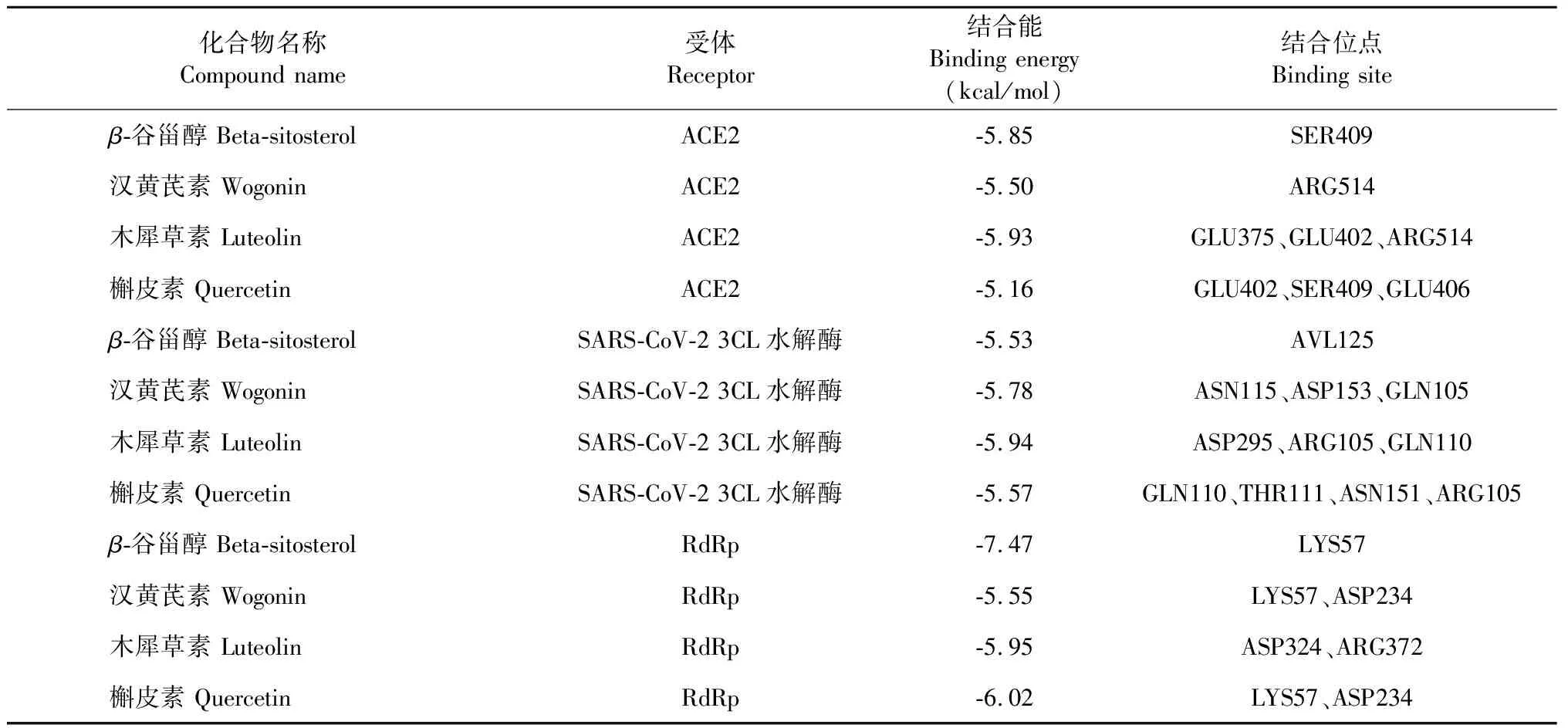
表3 清瘟护肺颗粒核心化合物与 SARS-CoV-2 3CL水解酶、ACE2和RdRp的结合能力
3 讨论
根据新型冠状病毒肺炎临床症状可知,病因多以湿热浊毒为主,在我国抗疫历史中,中医药起到了不可或缺的作用。中药含多种有效成分可多靶点多环节作用,用量可随证加减,可调节免疫力和抗病毒,毒副作用较小,作用平和。清瘟护肺颗粒是由金银花、连翘、大青叶、玄参、杏仁、浙贝母、桔梗、苏叶、防风、炒白术、茯苓、茵陈、党参、竹叶、麦冬、生甘草十六味药组成。方中金银花、连翘、浙贝母清热解毒,清肺止渴为君药;大青叶、竹叶、桔梗具有清热解毒,疏风透邪的功效;党参、炒白术、茯苓固护后天之本;浙贝母、桔梗、紫苏叶及苦杏仁配伍可清热宣肺,党参与黄芪配伍可补益肺气,生津止渴,可治疗脾肺气虚,清热消渴[11,12]。
本研究通过拓扑学分析得到“药材-成分-靶点”网络图中清瘟护肺颗粒防治COVID-19的15个主要药效成分。研究表明,甘草酚、大黄豆素具有抑制病毒的作用[13,14]。芒柄花黄素可通过调节COX-2/PGE?的表达抑制肠道病毒的复制[15]。查阅文献得出耐甲氧西林金黄色葡萄球菌(MRSA)可引起的金黄色葡萄球菌肺炎,其中α毒素是一种必不可少的毒力因子,而柚皮素可显著抑制α毒素的表达从而减轻感染小鼠的肺损伤和炎症症状[16]。槲皮素具有抗菌、抗病毒、免疫调节的药理作用,其可有效减少肺炎组织炎症细胞浸润,抑制上皮细胞增生,有效改善肺炎小鼠肺组织病理学损伤,同时可减少病毒的复制,可有效预防和治疗病毒[17,18]。因此,清瘟护肺颗粒中的主要药效成分具有抑制病毒的作用。
本研究通过拓扑学分析得到“靶点-通路”网络图中清瘟护肺颗粒防治COVID-19的15个重要靶点。其中,RELA是一种抗病毒转录因子,Bais等人阐明了依赖RELA的生存因子,抑制了感染引起的细胞死亡,阻止了RERA缺陷细胞中Chandipura病毒(CHPV)的增殖[19]。在甲型流感病毒(IAV)感染过程中,IAV感染刺激了可溶性IL-6受体(sIL-6R)的表达,sIL-6R是一种参与IL-6信号转导的多功能蛋白,且sIL-6R的表达上调了其自身配体IL-6和促炎细胞因子IL-32的水平,认为IL-6是参与病毒感染急性炎症反应的关键细胞因子[20]。其中TNF-α和IL-1β是炎症因子,具有较强的致炎活性,可诱导血管内皮细胞通透性增加,促进炎症反应[21]。清瘟护肺颗粒可通过改善机体炎症反应,达到促炎因子与抗炎因子动态平衡。综上可得,筛选的重要靶点与COVID-19有密切关系,其可能为该制剂的有效作用靶点。
通过KEGG富集及文献研究筛选的20条通路,其中IL-17 信号通路与多种炎症肺病疾病有关,IL-17上调可导致肺损伤加重,IL-17抑制剂可显著减轻肺部炎症,并抑制NF-κB的表达和激活,降低促炎症因子的水平,可诱导VEGF表达上调,显著抑制肺组织和细胞的炎性细胞因子水平[22]。通过获得性肺炎(CAP)患儿支气T管肺泡灌洗液(BAL)的检测,发现重度CAP患儿的IL-17水平明显增高。Th17细胞在肺部炎症和纤维化中起关键作用,Th17细胞和IL-17A信号在宿主防御和疾病发展中的意义已在各种感染和自身免疫模型中得到证实[23]。大量研究表明,Th17细胞及其标志性细胞因子IL-17A在呼吸道抵抗各种细菌和真菌感染的免疫反应中起关键作用。IL-17A可作用于感染组织中的非免疫细胞,通过诱导抗菌蛋白、细胞因子和趋化因子的表达来增强先天免疫。Yang等[24]研究表明,抑制PI3K/AKT信号通路Beclin1过表达可阻断肺炎甲型流感病毒感染后肺炎链球菌的再感染。因此,清瘟护肺颗粒可能通过以上通路防治COVID-19。
分子对接结果表明,清瘟护肺颗粒中的药效成分木犀草素、槲皮素、汉黄芩素、β-谷甾醇与SARS-CoV-2 3CL水解酶、ACE2和RdRp的结合能均小于<-5 kcal/mol,推测清瘟护肺颗粒的药效成分可能通过阻止病毒进入宿主细胞与ACE2结合,阻断SARS-CoV-2病毒蛋白与SARS-CoV-2 3CL水解酶结合,阻断病毒RNA复制过程,从而发挥防治效果。
综上所述,本文运用网络药理学方法分析清瘟护肺颗粒防治新型冠状肺炎的潜在药效物质,分析筛选清瘟护肺颗粒防治COVID-19的15个药效成分以及15个重要靶点。基于KEGG富集和文献报道分析得到清瘟护肺颗粒防治COVID-19的20条相关信号通路;清瘟护肺颗粒的药效成分木犀草素、槲皮素、汉黄芩素等可能通过与SARS-CoV-2 3CL水解酶、ACE2和RdRp结合作用于MAPK1、MAPK3、RELA、IL6等15个重要靶点调控IL-17 信号通路、PI3K/AKT信号通路等多条信号通路,达到防治 COVID-19的作用。该研究为进一步研究清瘟护肺颗粒防治COVID-19的药效成分及作用机制提供了参考。

