飞机草地上部分化学成分及其抑菌活性研究
谭亚婷,左安建,何彦仪,罗雨薇,胡世俊,闫晓慧*
1西南林业大学生物多样性保护学院 云南省森林灾害预警与控制重点实验室;2西南林业大学林学院 西南地区生物多样性保育国家林业局重点实验室,昆明 650224
飞机草(ChromolaenaodorataL.)又名香泽兰,是一种多年生草本,属于菊科(Compositae)泽兰属(Eupatorium)[1]。原产地为中、南美洲,现分布地区有非洲、大洋洲、亚洲和西太平洋群岛大部分热带及亚热带地区[2]。通过有性生殖与无性生殖方式进行繁殖,其瘦果能借助冠毛随风长距离传播[3]。可分泌化感物质来抑制其周围其他植物的生长,对生物多样性造成极大的破坏[4]。因此,飞机草被列为世界各国重要检疫性杂草之一[5],飞机草主要化学成分有黄酮、萜类、生物碱等物质,具有抗肿瘤、抗菌、抗氧化等生物活性[6-8]。在我国民间作为一种全草入药且多外用的中草药,其性温,味道微酸,可用于跌打肿痛、疮疡肿毒、皮炎和外伤止血,还具有驱虫、杀虫的作用[9]。
核桃(JuglansregiaL.)的种植在云南省脱贫攻坚和美丽乡村建设中发挥巨大的作用[10],但近年来云南核桃种植地区的病害流行严重影响核桃的品质和产量,给种植户造成了极大的经济损失[11,12],传统化学防治存在环境污染、人畜安全、农药残留等安全隐患。随着“绿色食品”概念的加强[13],人们意识到对食品安全与人类健康息息相关[14],不断从植物中寻找具有生物活性的抗菌物质,开发对作物安全、高效、低毒、低残留,对人体安全的新型植物源农药[15]。因此,有效利用入侵植物的资源优势也是控制其危害的方法之一[16]。本研究以入侵植物飞机草地上部分为材料,分离并鉴定化合物10个,其中,化合物2和8均首次从飞机草中获得,抑菌活性成分集中于乙酸乙酯萃取物柱层析馏分2中,因此,进一步对该部分分离得到的化合物进行抑菌活性研究。为利用入侵植物飞机草,使其变废为宝,达到减少环境破坏的目的,具有一定的社会、生态及经济效益,同时为核桃真菌病害的绿色防治提供科学依据。
1 材料与方法
1.1 仪器与试剂
仪器:DFY-C快速开盖万能高速粉碎机(温岭市林大机械有限公司);LT502电子天平(常熟市大量仪器有限责任公司);N-1100旋转蒸发仪(上海爱朗仪器有限公司);DL-1万用电炉(天津市赛得利斯实验分析仪器制造厂);正相色谱硅胶(青岛海洋化工厂);MCI小孔树脂、40~70 μm葡聚糖凝胶Sephadex LH-20(瑞典Amersham Pharmacia Biotech AB公司);反相色谱硅胶(德国默克公司);ZF-6三用紫外分析仪(上海嘉鹏科技有限公司);Bruker DRX-500核磁共振波谱仪(瑞士布鲁克公司);WPL-230BE恒温电热培养箱(天津市泰斯特仪器有限公司);无菌超净工作台(苏净安泰工厂);自动压力蒸汽灭菌器(厦门致微仪器有限公司)。
试剂:工业纯硫酸、分析纯乙醇(云南杨林汕滇药业有限公司);工业纯乙醇、石油醚、乙酸乙酯、三氯甲烷、甲醇、丙酮经重蒸后使用(昆明锴泰纳工贸有限公司);氘代氯仿、氘代丙酮、氘代甲醇(美国Cam- bridge Isotope Laboratories 公司);水为实验室自制蒸馏水。
1.2 材料与菌种
飞机草地上部分于2011年8月采自云南红河,由西南林业大学胡世俊副教授鉴定为ChromolaenaodorataL.,植物标本存放于西南林业大学云南省森林灾害预警与控制重点实验室。植物材料3.7 kg风干粉碎,按料液比1∶3加入95%乙醇,加热回流提取4 h,共5次,提取液用旋转蒸发仪浓缩回收溶剂,得提取物520 g,4 ℃下冷藏用于后期研究。
供试菌种为叶点霉(Phyllostictasp.)、炭疽菌(Colletotrichumsp.)、壳二孢(Ascochytasp.)、拟茎点霉(Phomopsissp.),由西南林业大学生命科学学院陈玉惠教授提供,病原菌系从云南临沧、大理、楚雄、曲靖、保山和昭通等县(市)核桃主栽地区的398份感病核桃病叶和果实分离得到,用PDA培养基,于28 ℃培养箱中培养。
1.3 分离与鉴定
蒸馏水溶解粗提物,依次用等量石油醚、乙酸乙酯萃取三次,过滤,减压浓缩得石油醚浸膏(114.38 g)、乙酸乙酯浸膏(145.78 g),水萃取浸膏(167.32 g)。乙酸乙酯浸膏以石油醚/丙酮系统硅胶柱层析,湿法装柱,干法上样,依次用10∶1、5∶1、3∶1、2∶1、1∶1、0∶1梯度洗脱,浓缩得Fr.1(9.78 g)、Fr.2(8.69 g)、Fr.3(5.86 g)、Fr.4(7.56 g)、Fr.5(6.97 g)、Fr.6(10.62 g)。Fr.1经MCI色谱柱甲醇-水(10%→95%)分离,60%~70%部分采用葡萄糖凝胶色谱柱(丙酮)纯化得无色透明块状结晶、白色粉末,为化合物1(683 mg)、2(592 mg),剩余部分采用葡萄糖凝胶色谱柱(氯仿∶甲醇=1∶1)纯化得白色粉末,为化合物3(168 mg)。Fr.2经MCI色谱柱甲醇-水(25%→100%)分离,其中25%-55%部分采用葡萄糖凝胶色谱柱(甲醇)纯化得白色粉末,为化合物4(98 mg);70%部分经重结晶析出白色针状结晶,为化合物5(76 mg),采用硅胶柱色谱分离70%部分,以石油醚-乙酸乙酯作为洗脱剂,洗脱梯度为30∶1、20∶1、10∶1、5∶1、3∶1、2∶1、1∶1,5∶1部分经重结晶析出白色片状结晶,为化合物6(42 mg);70%~90%部分采用葡萄糖凝胶色谱(氯仿∶甲醇=1∶1)纯化得到白色片状结晶,为化合物7(56 mg)。Fr.4经MCI色谱柱甲醇-水(20%→100%)分离,采用硅胶柱色谱分离60%部分,石油醚/氯仿/甲醇作为洗脱剂,洗脱梯度为62.5∶62.5∶1、30∶30∶1、15∶15∶1、8∶8∶1、4∶4∶1、2∶2∶1,62.5∶62.5∶1部分采用葡萄糖凝胶色谱(甲醇)淋洗后经硅胶柱色谱分离,石油醚/乙酸乙酯作洗脱剂,洗脱梯度为10∶1、5∶1、3∶1、2∶1、1∶1,5∶1部分经重结晶析出黄色颗粒结晶,化合物8(426 mg);30∶30∶1部分采用葡萄糖凝胶色谱(甲醇)纯化得到无色透明结晶,为化合物9(354 mg);15∶15∶1部分采用葡萄糖凝胶色谱(氯仿∶甲醇=1∶1)纯化得到黄色粉末,为化合物10(656 mg)。
采用1H NMR、13C NMR、MS等光谱学方法,各化合物在TLC中比移值以及表现出的物理化学特征等对所得单体化合物进行结构鉴定,并参照文献,确定以上化合物化学结构。
1.4 飞机草粗提物抑菌活性检测
分别称取0.50 g供试植物乙醇提取物、不同萃取物、乙酸乙酯柱层析馏分溶解于分析DMSO溶液中,超声辅助溶解制成100 mg/mL的粗提物母液。采用菌丝生长速率法对供试核桃病原真菌的抑制率进行测定。在无菌操作条件下,于50~60 ℃的PDA培养基中加入飞机草粗提物母液,稀释为1 mg/mL的含药培养基,同时以含等体积的DMSO溶剂的培养基的作为对照,含50 μg/mL苯醚甲环唑-DMSO溶液的培养基作为阳性对照,用直径为4 mm打孔器在菌落边缘生长一致的部分打取菌饼,将菌饼(有菌丝的面朝下)转接于含药平板中央,每个处理共5个重复,置于28 ℃恒温培养箱中暗培养。采用十字交叉法每2天对各处理菌落生长直径进行测定,对照菌落长满至培养皿边缘时结束测定,根据下列公式计算抑菌率:
对照纯生长量(mm)=
对照组菌落直径-菌饼直径
(1)
处理纯生长量(mm)=组菌落直径-菌饼直径
(2)

(3)
1.5 飞机草化学成分毒力测定
分别称取3种化合物0.10 g,加入分析纯DMSO溶液,超声辅助溶解制成10 mg/mL的化合物母液。采用梯度法稀释法分别在150 mL的PDA培养基中于50~60 ℃时加入0.75、1.50、2.25、3.00 mL化合物母液,稀释成浓度为50、100、150、200 μg/mL的4个浓度梯度的含药培养基,以加入等梯度的等体积DMSO为对照,每个处理共5个重复,接种与培养方式同“1.4”。参照陈丽华室内离体抑菌活性测定方法[17],以药剂质量浓度对数为横坐标(x),抑菌活性概率值为纵坐标(y),采用数据软件绘制毒力曲线,求得毒力回归方程和相关系数,计算EC50,对不同植物粗提物的毒力大小进行比较。
1.6 数据处理
以上数据均采用Excel 2010软件进行数据统计,运用SPSS17.0统计软件(One-way ANOVA,Duncan post hoc test,P<0.05)进行多重比较分析。
2 结果与分析
2.1 结构鉴定
化合物1无色透明块状结晶;ESI-MS:m/z345 [M+H]+得出化合物分子量为344,可判定该化合物分子式为C19H20O6。1H NMR(500 MHz,CDCl3)δ:7.38(2H,d,J=8.7 Hz,H-2′,6′),6.94 (2H,d,J=8.8 Hz,H-3′,5′),6.33(1H,d,H-8),5.34(1H,dd,J=2.8,13.4 Hz,H-2),3.94,3.86,3.83,3.82(各3H,s,4×OCH3),3.02(1H,dd,J=13.4,16.7 Hz,H-3α),2.75(1H,dd,J=2.9,16.7 Hz,H-3β)L13C NMR(125 MHz,CDCl3)δ:79.2(C-2),45.4(C-3),189.6(C-4),154.3(C-5),137.5(C-6),159.5(C-7),96.4(C-8),160.0(C-9),109.2(C-10),130.7(C-1′),127.7(C-2′,6′),114.3(C-3′,5′),159.8(C-4′),61.7,61.4,56.1,55.4(4×OCH3)。上述数据与文献[18]报道的已知化合物一致,因此鉴定为5,6,7,4′-四甲氧基黄烷酮。
化合物2白色无定形粉末;ESI-MS:m/z317 [M+H]+得出化合物分子量为316,可判定该化合物分子式为C17H16O6。1H NMR(500 MHz,CDCl3)δ:12.02(1H,s,5-OH),7.04(H,d,J=2.1 Hz,H-2′),6.93(2H,d,J=2.1,8.3 Hz,H-6′),6.88(1H,d,J=8.3 Hz,H-5′),6.06(1H,d,J=2.3 Hz,H-6),6.04(1H,d,J=2.3 Hz,H-8),5.32(1H,dd,J=3.0,13.0 Hz,H-2),3.91(3H,s,OCH3),3.80(3H,s,OCH3),3.07(1H,dd,J=13.0,17.2 Hz,H-3α),2.78(1H,dd,J=3.1,17.2 Hz,H-3β);13C NMR(125 MHz,CDCl3)δ:79.0(C-2),43.2(C-3),196.0(C-4),164.1(C-5),95.1(C-6),168.0(C-7),94.3(C-8),162.9(C-9),103.2(C-10),131.5(C-1′),112.7(C-2′),145.9(C-3′),145.0(C-4′),110.7(C-5′),118.2(C-6′),56.1,55.7(2×OCH3)。上述数据与文献[19]报道的已知化合物一致,圣草素-7,4′-二甲醚。
化合物3白色粉末;ESI-MS:m/z317 [M+H]+得出化合物分子量为316,可判定该化合物分子式为C17H16O6。1H NMR(500 MHz,CDCl3)δ:12.19(1H,s,5-OH),7.37(2H,d,J=8.8 Hz,H-2′,H-6′),6.95(2H,d,J=8.7 Hz,H-3′,H-5′),6.11(1H,s,H-8),5.34(1H,dd,J=2.9,13.1 Hz,H-2),3.94(3H,s,6-OCH3),3.83(3H,s ,4′-OCH3),3.09(1H,dd,J=13.1,17.2 Hz,H-3α),2.78(1H,dd,J=3.0,17.2 Hz,H-3β);13C NMR(125 MHz,CDCl3)δ:79.1(C-2),43.2(C-3),196.9(C-4),154.4(C-5),128.3(C-6),157.5(C-7),94.6(C-8),158.7(C-9),103.1(C-10),130.2(C-1′)),127.7(C-2′,6′),114.2(C-3′,5′),160.1(C-4′),61.0(6-OCH3),55.4(4′-OCH3)。上述数据与文献[20]报道的已知化合物一致,判定该化合物为5,7-二羟基-6,4′-二甲氧基二氢黄酮。
化合物4白色絮状粉末;ESI-MS:m/z303 [M+H]+得出化合物分子量为302,可判定该化合物分子式为C16H14O6。1H NMR(500 MHz,(CD3)2CO)δ:7.51(2H,d,J=8.6 Hz,H-2′,H-6′),6.99(2H,d,J=8.8 Hz,H-3′,H-5′),5.99(1H,d,J=2.2 Hz,H-6),5.95(1H,d,J=2.2 Hz,H-8),5.12(1H,d,J=11.3,H-2),4.68(1H,d,J=11.6,H-3),3.83(3H,s,4′-OCH3);13C NMR(125 MHz,(CD3)2CO)δ:84.1(C-2),73.1(C-3),198.2(C-4),165.0(C-5),97.1(C-6),167.7(C-7),96.0(C-8),164.1(C-9),101.5(C-10),130.2(C-2′,6′),114.4(C-3′,5′),55.6(4′-OCH3)。上述数据与文献报道[21]的已知化合物一致,判定该化合物为二氢山柰素。
化合物5白色针状结晶;ESI-MS:m/z287 [M+H]+得出化合物分子量为286,可判定该化合物分子式为C16H14O5。1H NMR(500 MHz,CDCl3)δ:7.37(2H,d,J=8.7 Hz,H-2′,H-6′),6.95(2H,d,J=8.8 Hz,H-3′,H-5′),5.97(1H,d,J=2.1 Hz,H-6),5.99(1H,d,J=2.1 Hz,H-8),5.37(1H,dd,J=3.0,13.1 Hz,H-2),3.10(1H,dd,J=13.1,17.2 Hz,H-3α),2.79(1H,dd,J=3.0,17.0 Hz,H-3β),3.83(3H,s,4′-OCH3),12.05(1H,s,5-OH);13C NMR(125 MHz,CDCl3)δ:79.0(C-2),43.1(C-3),196.1(C-4),164.4(C-5),96.7(C-6),164.3(C-7),95.4(C-8),164.4(C-9),103.3(C-10),130.3(C-1′),127.8(C-2′,6′),114.3(C-3′,-5′),160.1(C-4′),55.4(4′-OCH3)。上述数据与文献报道[22]的已知化合物一致,因此鉴定为异野樱素。
化合物6白色片状结晶,ESI-MS:m/z331 [M+H]+得出化合物分子量为330,可判定该化合物分子式为C18H18O6。1H NMR(500 MHz,CDCl3)δ:7.33(2H,d,J=8.4 Hz,H-2′,6′),6.87(2H,d,J=8.6 Hz,H-3′,5′),6.34(1H,s,H-8),5.33(1H,dd,J=2.8,13.4 Hz,H-2),3.94,3.86,3.82(各3H,s,3×OCH3),3.02(1H,dd,J=13.4,16.7 Hz,H-3α),2.76(1H,dd,J=2.9,16.7 Hz,H-3β);13C NMR(125 MHz,CDCl3)δ:79.2(C-2),45.3(C-3),189.8(C-4),154.3(C-5),137.5(C-6),158.6(C-7),96.4(C-8),159.9(C-9),109.1(C-10),130.7(C-1′),128.0(C-2′,6′),115.7(C-3′,5′),156.2(C-4′),61.7,61.4,56.2(3×OCH3)。上述数据与文献[18]报道的已知化合物一致,因此鉴定为4′-羟基-5,6,7-三甲氧基黄烷酮。
化合物7白色片状结晶;ESI-MS:m/z37 ([M+H]+得出化合物分子量为374,可判定该化合物分子式为C20H22O7。1H NMR(500 MHz,CDCl3)δ:7.25(2H,d,J=2.1 Hz,H-2′),6.94(2H,dd,J=2.2,8.8 Hz,H-6′),6.90(1H,d,J=8.8 Hz,H-5′),5.34(1H,dd,J=2.7,13.4 Hz,H-2),3.04(1H,dd,J=13.5,16.7 Hz,H-3α),2.77(1H,dd,J=2.8,16.7 Hz,H-3β),3.87,3.82,3.94,3.92,3.90(各3H,s,5×OCH3);13C NMR(125 MHz,CDCl3)δ:79.5(C-2),45.5(C-3),189.3(C-4),154.3(C-5),137.6(C-6),159.8(C-7),96.4(C-8),159.5(C-9),109.2(C-10),131.1(C-1′),109.4(C-2′),149.3(C-3′),149.5(C-4′),111.2(C-5′),118.9(C-6′),61.7,61.4,56.2,56.0,56.0(5×OCH3)。上述数据与文献报道[21]的已知化合物一致,判定该化合物为5,6,7,3′,4′-五甲氧基黄烷酮。
化合物8黄色颗粒结晶;ESI-MS:m/z359 [M+H]+得出化合物分子量为358,可判定该化合物分子式为C19H18O7。1H NMR(500 MHz,CD3OD)δ:7.48(1H,d,J=8.5 Hz,H-6′),7.39(1H,s,H-2′),7.06(1H,s,H-6),7.05(1H,d,J=8.4 Hz,H-5′),6.56(1H,s,H-3),3.93,3.91,3.85,3.84(各3H,s,4×OCH3);13C NMR(125 MHz,CD3OD)δ:164.0(C-2),106.9(C-3),179.6(C-4),153.3(C-5),97.9(C-6),160.0(C-7),141.8(C-8),156.1(C-9),112.6(C-10),124.9(C-1′),113.0(C-2′),148.8(C-3′),152.4(C-4′),113.8(C-5′),119.7(C-6′),62.6,61.8,57.0,56.5(4×OCH3)。上述数据与文献[22]报道的已知化合物一致,判定该化合物为3′-羟基-5,7,8,4′-四甲氧基黄烷酮。
化合物9无色透明针状结晶;ESI-MS:m/z301 [M+H]+得出化合物分子量为300,可判定该化合物分子式为C16H12O6。1H NMR(500 MHz,(CD3)2CO)δ:7.56(1H,dd,J=2.3,8.5 Hz,H-2′),7.49(1H,d,J=2.3 Hz,H-6′),7.13(1H,d,J=8.6 Hz,H-3′),6.64(1H,s,H-3),6.55(1H,d,J=2.0 Hz,H-8),6.25(1H,d,J=2.0 Hz,H-6),3.94(3H,s,4′-OCH3),2.86(1H,s,5-OH);13C NMR(125 MHz,(CD3)2CO)δ:163.3(C-2),104.6(C-3),183.0(C-4),99.7(C-6),164.9(C-7),94.7(C-8),158.8(C-9),104.6(C-10),124.8(C-1′),119.7(C-2′),112.4(C-3′),151.7(C-4′),147.8(C-5′),113.6(C-6′),56.4(4′-OCH3)。上述数据与文献[23]报道的已知化合物一致,判定该化合物为香叶木素。
化合物10黄色粉末;ESI-MS:m/z285 [M-H]-得出化合物分子量为286,可判定该化合物分子式为C15H10O6。1H NMR(500 MHz,CD3OD)δ:8.07(2H,d,J=8.9 Hz,H-2′,6′),6.89(2H,d,J=8.9 Hz,H-3′,5′),6.38(1H,d,J=2.1 Hz,H-8),6.17(1H,d,J=2.1 Hz,H-6);13C NMR(125 MHz,CD3OD)δ:148.0(C-2),137.1(C-3),177.4(C-4),158.3(C-5),99.3(C-6),165.6(C-7),94.4(C-8),162.5(C-9),104.5(C-10),123.7(C-1′),130.7(C-2′,6′),116.3(C-3′,5′),160.6(C-4′)。上述数据与文献[24]报道的已知化合物一致,判定该化合物为山柰酚。
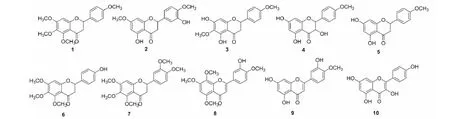
图1 化合物1~10的化学结构Fig.1 The chemical structures of the compounds 1-10
2.2 飞机草粗提物抑菌活性筛选
采用生长速率法测定了飞机草不同粗提物对四株核桃病原菌叶点霉、炭疽菌、壳二孢和拟茎点霉的抑菌活性,结果见表1。飞机草乙醇提取物、石油醚萃取物和乙酸乙酯萃取物对叶点霉均表现出一定的抑菌活性抑菌率在45.45%~60.05%,其中,乙酸乙酯萃取物对叶点霉的抑菌作用最强,而水萃取物对叶点霉无抑菌活性。飞机草各提取物对炭疽菌和拟茎点霉的抑菌活性均较弱,抑菌率在6.74%~26.97%之间,其中水萃取物对拟茎点霉无抑菌活性。飞机草不同提取物对壳二孢均表现出较强的抑菌活性,抑菌率均在50%以上,其中,乙酸乙酯萃取物对壳二孢的抑菌率高达79.06%。上述结果表明,飞机草对供试四株核桃病原菌的,抑菌活性成分主要集中在乙酸乙酯萃取物中。因此,我们进一步对乙酸乙酯萃取物的抑菌成分进行了研究。
2.3 飞机草乙酸乙酯萃取物不同馏分的抑菌筛选
采用硅胶柱层析对飞机草乙酸乙酯萃取物进行了成分分离,获得6个馏分,并对各个馏分的抑菌活性进行了测定。由表2可知,不同馏分对4种核桃病原真菌的抑菌作用表现出明显差异。馏分1~3均能明显抑制叶点霉的菌丝生长,馏分4~6对叶点霉的菌丝生长无影响,馏分2(石油醚∶丙酮=5∶1)部分对该病原菌菌丝生长抑制效果最强;馏分1-6均能抑制炭疽菌的菌丝生长,其中馏分2部分对炭疽菌抑菌活性最好;馏分1~3对壳二孢表现出良好的抑制作用,其中,馏分3的抑菌活性相对较高,馏分4~6对壳二孢无抑菌效果;馏分1~5均能对拟茎点霉表现出一定的抑制作用,抑菌率在11.22%~58.50%之间,其中馏分2的抑菌率最高,对菌丝生长的抑制作用最强,而馏分6对该病原菌无抑菌效果。综上所述,有效抑制叶点霉、炭疽菌、壳二孢3种病原菌的成分主要集中在馏分2部分,抑制壳二孢的成分主要集中在馏分3部分。
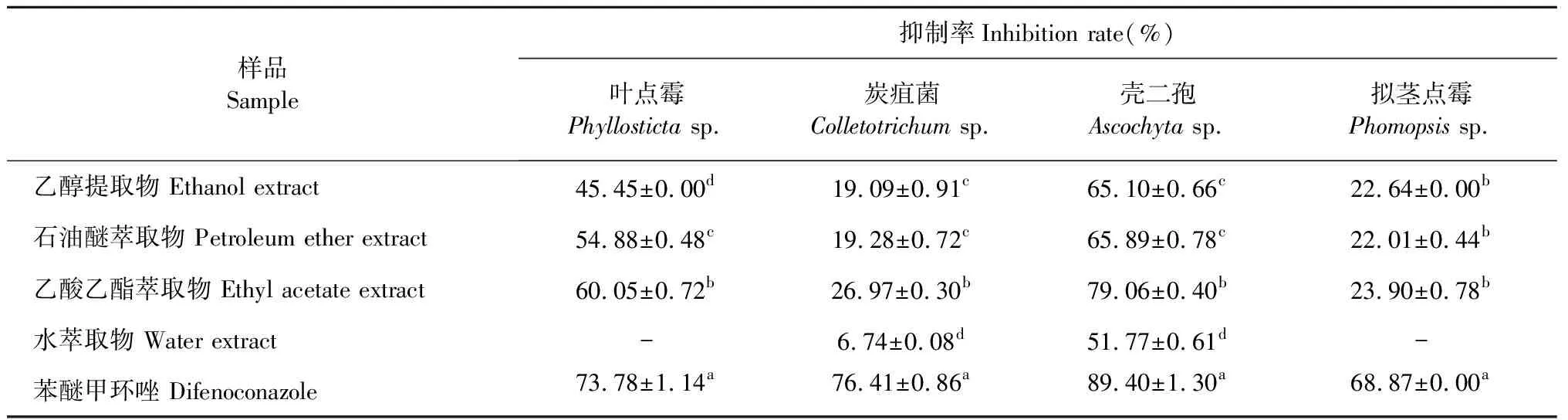
表1 飞机草不同粗提物对4种核桃病原菌的抑菌活性
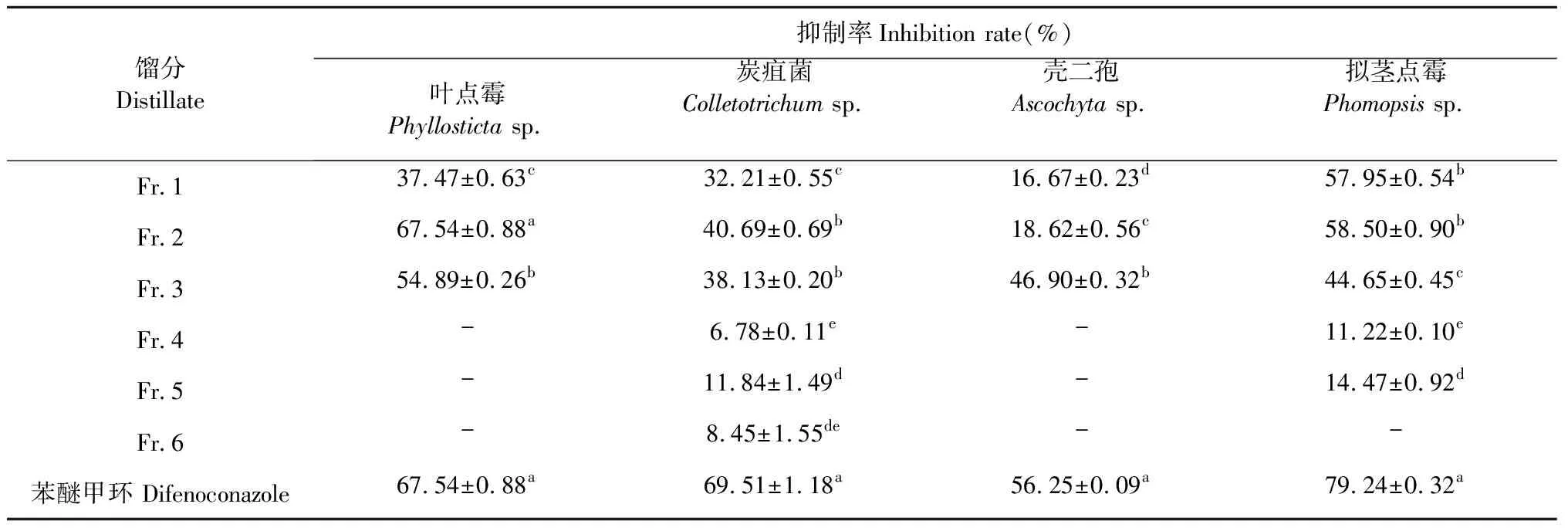
表2 飞机草乙酸乙酯萃取物不同馏分对4种核桃病原菌的抑菌活性
2.4 不同化合物对供试病原菌的抑菌活性
进一步以抑菌活性较好的馏分2部分离得到3个量大的化合物4、5、7为供试化合物,测定其对4种核桃病原真菌的抑菌毒力,结果表明不同化合物对各病原菌的毒力之间的差别显著(表3)。其中,3个化合物对叶点霉、炭疽菌、壳二孢的抑菌活性强弱依次为:化合物5>化合物4>化合物7,其中抑菌活性最强的化合物5对上述三种菌的EC50分别为0.154 3、0.202 9、0.268 7 mg/mL,但仍均与阳性对照差异较大;对拟茎点霉的抑菌活性最强的仍是化合物5,其次为化合物7和化合物4,EC50分别为0.106 2、0.404 2、0.587 0 mg/mL,其中,化合物5(异野樱素)对4种核桃病原菌均表现出较好的抑菌作用,该化合物对拟茎点霉菌丝生长抑制作用最强(图2D-1)。4种菌株在PDA培养基中于28 ℃恒温培养箱中暗培养,菌丝长势均良好(图2A~D)。菌丝初期均为白色,菌落中间的颜色在4天后出现变化,6天时最为明显,且添加药剂的菌落颜色较深于对照。叶点霉菌落中间为淡墨绿色,白色绒毛状菌丝附于外围,炭疽菌菌落中间为淡橘红色,外围菌丝呈白色,壳二孢菌落中间为墨绿色且占比例较大,外围仅有一圈白色绒毛状菌丝,拟茎点霉菌落出现明显的颜色分圈,苯醚甲环唑处理后能明显抑制各病原菌菌丝生长。
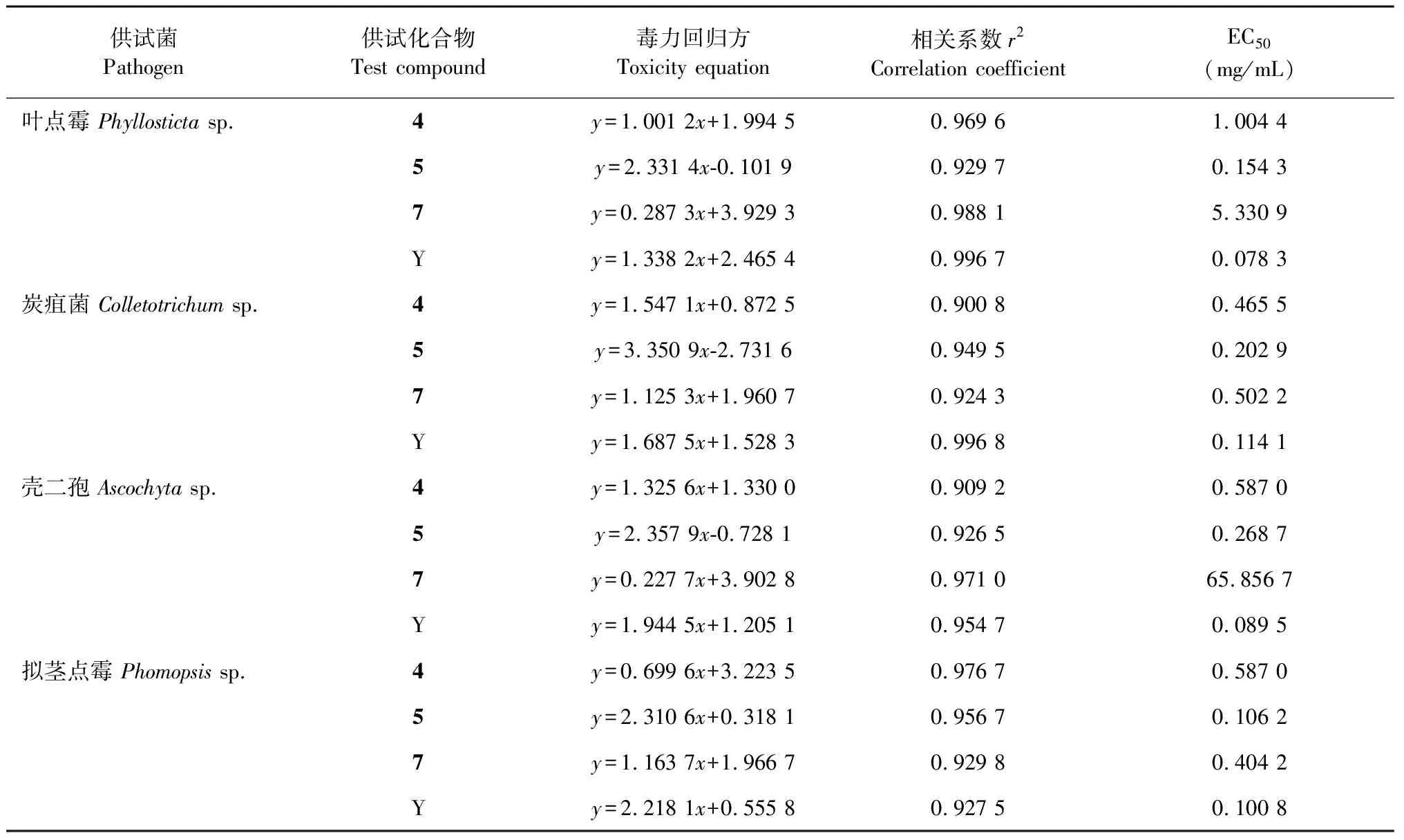
表3 3种化合物对4种核桃病原菌的相对毒力
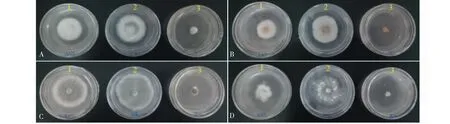
图2 150 μg/mL异野樱素对核桃病原菌的抑制效果Fig.2 Inhibitory effect of 150 μg/mL of isosakuranetin on pathogenic fungi from J.regia注:A~D:叶点霉、炭疽菌、壳二孢,拟茎点霉;1~3:异野樱素、对照、阳性对照。Note:A-D:Phyllosticta sp.,Colletotrichum sp.,Ascochyta sp.,Phomopsis sp.;1-3:Isosakuranetin,control group and positive control group.
3 讨论与结论
本研究为进一步探究飞机草的抑菌活性,对飞机草地上部分进行系统的分离,从乙酸乙酯层共分离得到10个化合物,包括6个二氢黄酮、1个二氢黄酮醇、2个黄酮、1个黄酮醇,其中有化合物2、8首次从飞机草中分离获得。研究报道,黄酮化合物是飞机草叶片中主要次生代谢物质,在飞机草的防御和竞争中具有重要作用,能使飞机草在入侵过程通过强抗性和强化感活性去突破新天敌和新的竞争者的阻碍[25]。因此,推测黄酮化合物是飞机草成功入侵的特征成分。植物为抵御来自于环境或其它生物物种的外来伤害逐渐形成了基于特异性的作用机制形成的化学防御物质,使其在长期进化和自然选择中占有明显优势[26],植物源活性物质可作为抑菌主要成分[27],对今后开发为新型的天然抗菌剂具有重要意义。
目前常用乙醇提取植物中次生代谢,但不同的提取溶剂对植物抑菌效果具有不同影响[28]。本研究对飞机草各粗提物进行抑菌活性筛选,发现1 mg/mL乙酸乙酯萃取物对4种核桃病原真菌的抑制活性高于乙醇提取物、石油醚萃取物、水萃取物,可能是抑制核桃病原菌的活性成分极性与乙酸乙酯极性相似。该萃取物经硅胶柱色谱分离划段得到6个馏分,比较发现馏分2部分能够有效抑制叶点霉、炭疽菌、拟茎点霉病原菌,抑制率分别为67.54%、40.69%、58.50%,抑制壳二孢的成分主要集中在馏分3部分,进一步测定了馏分2部分分离得到的量大的化合物4、5、7对4种核桃病原真菌的抑菌毒力。化合物4、5对4株病原菌的整体抑制作用优于化合物7,其中,化合物5对4种核桃病原菌的抑菌活性均较好,其对各病原菌的EC50分别为拟茎点霉0.106 2 mg/mL、叶点霉0.154 3 mg/mL、炭疽菌0.202 9 mg/mL、壳二孢0.268 7 mg/mL,该结果与已报道的A环的5-OH、7-OH为重要抗菌活性基团相吻合[23]。此外,化合物结构中的甲氧基存在,也是其抑菌的活性基团,研究报道该类化合物可有效抑制菌胶包炭疽菌,且抑菌效果随浓度的增加而增强[29]。黄酮类化合物因其具有较高的抑菌活性,很早就被应用于抑菌治疗[30]。
综上所述,飞机草乙醇提取物中抑核桃病原菌的活性成分集中于乙酸乙酯层,而异野樱素是该萃取层的主要活性物质。飞机草富含黄酮化学成分,黄酮类抑菌活性显著[39]。今后可进一步围绕黄酮类成分进行抑菌先导化合物的开发,为飞机草的治理和综合利用奠定基础,也为开发为新型杀菌剂提供理论依据。
致谢:感谢西南林业大学生命科学学院陈玉惠教授提供供试菌种。

