不同油茶无性系炭疽病抗性及主要生理指标分析
卢丽俐
(1. 厦门市园林植物园,福建 厦门 361003;2. 福建省龙岩市林业科学研究所,福建 龙岩 364000)
油茶炭疽病(Colletotrichum gloeosporioides)是油茶(Camellia oleifera)的重要病害,可引起严重的落蕾、落果,甚至整株死亡,降低油茶产量,造成严重的经济损失[1—2]。筛选抗病的种质材料,培育抗病品种是油茶炭疽病的重要防治措施之一[3—4]。闽西地区是油茶主要分布区域之一,具有丰富的种质资源和悠久的栽培历史[5—6]。近年来,随着全国油茶产业的大力发展,闽西地区油茶种植业迎来蓬勃发展的势头。然而,由于长期粗放经营,对油茶种业缺乏重视,许多优质的野生油茶种质资源得不到有效地保护和利用,从而造成闽西本地的油茶品种匮乏、优质苗木短缺等突出问题。近年来新造油茶林,多是从江西、湖南等地引进的品种,不仅存在引种适应性风险,也进一步挤压了本地油茶种质资源的发展空间。因此,对闽西本地油茶种质资源的保护和利用显得尤为迫切。卢丽俐等[6]从2010年开始,开展了闽西地区油茶种质资源收集和优良品种选育,获得一批高产、高抗的闽西当地的优良无性系。在此基础上,本文从中选择5个油茶无性系,通过林间抗性调查和叶片生理指标测定,对比不同抗病性油茶无性系叶片内含物含量及酶活性指标的差异,旨在探索油茶炭疽病抗性与其主要生理指标的相关性,筛选抗炭疽病的油茶无性系,为闽西地区油茶无性系良种选育奠定基础,并为油茶炭疽病抗性机制研究提供依据。
1 试验地概况
试验地位于福建省龙岩市上杭县太拔镇太拔村,地处 116°59′E、24°59′N,海拔约 400 m,属于亚热带季风气候,年平均气温18~21 ℃,年均无霜期 280~310 d,雨量充沛,年均降水量 1700~2000 mm。试验林内立地条件基本一致,东北坡向,中坡位,土壤为山地红壤,土层深厚,立地条件好[6]。试验地前茬种植树种为茶树(Camellia sinensis)。
2 材料与方法
2.1 材料
供试材料为龙岩市老科学技术工作者协会提供的闽西当地5个油茶无性系(武平2号、漳平2号、红山1号、河田2号和新罗2号)。2011年5月采用芽苗砧嫁接法进行育苗,2013年3月选择长势一致的2年生壮苗造林[6]。
2.2 方法
2.2.1 造林设计与林分管护
试验林地于 2012 年秋季整地和挖穴。采用梯带式整地,并在内侧开设水平竹节沟。种植穴的株行距为2.3 m×3 m,造林密度约1440 株·hm-2。各无性系按随机区组试验设计进行定植,每个无性系 6个重复,每重复5株,并在每个试验区块间设置2行红叶石楠(Photinia×fraseri)作为隔离带[6—7]。2013年 3月进行造林,定植前 1~2个月,每穴施基肥2.5 kg鸡粪和0.1 kg过磷酸钙。造林后每年5~6月、9~10 月各进行一次除草培蔸,结合除草进行施肥,每次每株施复合肥0.2 kg[8]。
2.2.2 油茶炭疽病抗性的林间调查
于 8月油茶炭疽病高发季每个无性系随机调查10株,每株分别在东、南、西、北4个方向各抽查25片叶,然后统计病叶数、划分病级、计算感病指数[9]。

2.2.3 抗病性等级划分

表1 油茶炭疽病发病分级标准Table 1 Grading standards of severity to anthracnose inCamellia oleifera
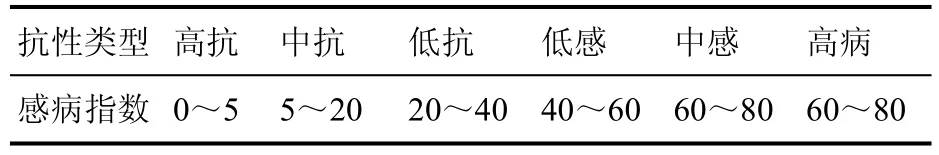
表2 抗性划分标准Table 2 Grading standard for disease resistance
2.2.4 生理生化指标测定
各无性系选取3株,取每株顶芽往下第3~8片完全展开叶,按东西南北朝向各采5片,用清水洗净叶片污垢后保存于液氮中,试验时即取即用[10]。
采用愈创木酚比色法测定过氧化物酶(Peroxidase,POD)活性,采用氮蓝四唑法测定超氧化物歧化酶(Superoxide Dismutase,SOD)活性,采用高锰酸钾滴定法测定过氧化氢酶(Catalase,CAT)活性,采用考马斯亮蓝G -250染色法测定可溶性蛋白含量[11]。
2.3 数据分析
采用Excel 2018和SPSS 13.0软件统计分析,采用单因素方差分析和方差齐性检验(F检验)对不同油茶无性系的生理指标差异进行分析,采用LSD法进行多重比较分析,采用Pearson相关系数法分析生理指标与感病指数之间的相关性。
3 结果与分析
3.1 不同油茶无性系的炭疽病抗性比较
调查表明,林间不同油茶无性系对炭疽病的抗性差异明显(表3)。新罗2号无性系抗性最强,其感病指数仅为3.94,抗性等级为高抗;漳平2号、红山1号和河田2号三个无性系的抗性中等,其感病指数在5~20之间,抗性等级为中抗;而武平2号抗性最差,其感病指数高达44.60,抗性等级为低感。由此可见,从不同种源的油茶种质资源中可以筛选出抗油茶炭疽病的无性系材料,为进一步培育抗炭疽病的油茶良种奠定基础。

表3 不同油茶无性系在林间的发病情况Table 3 Incidence of Anthracnose among different Camellia oleifera clones in forests
3.2 油茶无性系叶片生理指标变化
3.2.1 过氧化物酶活性
由图1可见,5个油茶无性系叶片的POD活性排序为:新罗2号>河田2号>红山1号>漳平2号>武平 2号,其中新罗 2号 POD活性最高,达39.67 U·mg-1,武平 2号 POD 活性最低,仅为13.93 U·mg-1。方差分析显示,其F值为11.93>F0.01(2,18)=6.01,达极显著差异水平。LSD 多重比较表明,新罗2号POD活性除与河田2号差异不显著外,与红山1号、漳平2号和武平2号差异均显著;武平2号POD活性除了与漳平2号差异不显著外,与其他3个无性系差异均达极显著水平。
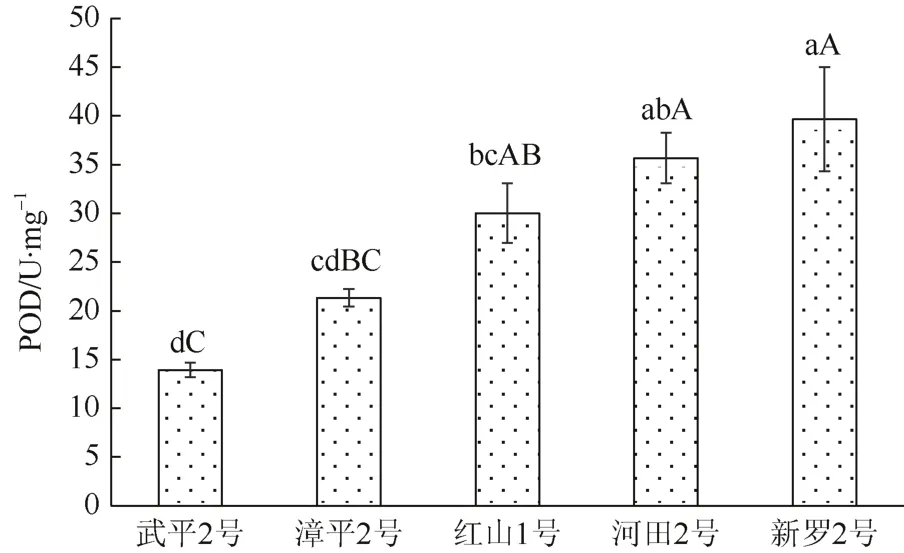
图1 不同油茶无性系叶片POD活性比较Fig. 1 Comparison of POD activity in leaves of different Camellia oleifera clones
3.2.2 超氧化物歧化酶活性
本文采用改进神经网络PID控制器研究车辆转向控制系统,建立车辆转向机构运动简图模型,推导车辆摆动角速度与转角之间关系式.修改传统PID控制器,添加人工神经网络模型,引用改进PSO对PID控制器参数进行优化和在线调整,在Matlab软件中对优化后人工神经网络PID控制器参数进行仿真,并且与PID控制器进行比较.仿真曲线显示:常规工况路面,PID控制器和改进人工神经网络PID控制器都能很好地实现摆动角速度跟踪任务,但是对于复杂工况路面,改进人工神经网络PID控制明显优于PID控制器,能够快速、精确地实现跟踪任务,提高车辆行驶的稳定性.
不同油茶无性系叶片超氧化物歧化酶(SOD)活性比较表明,武平2号的最低,为470.48 U·mg-1;其他4个无性系之间也有所不同(图2)。对SOD活性检测数据进行方差分析发现,其F值为7.03>F0.01(2,18)=6.01,说明不同油茶无性系对其叶片SOD活性的影响达到极显著水平。LSD多重比较显示,新罗2号、河田2号、红山1号和漳平2号4个无性系的SOD活性差异不显著,漳平2号和武平2号之间SOD活性差异也不显著;但新罗2号与武平2号之间有极显著差异,河田2号、红山1号两者与武平2号差异也达显著水平。

图2 不同油茶无性系叶片的SOD活性比较Fig. 2 Comparison of SOD activity in leaves of different Camellia oleifera clones
3.2.3 过氧化氢酶活性
对不同油茶无性系CAT活性的数据进行方差分析,结果显示其F值为97.13>F0.01(2,18) =6.01,说明不同无性系对其叶片 CAT活性的影响极显著。LSD多重比较结果显示,CAT活性最高的新罗2号与河田2号两者之间差异不显著,但两者均与红山1号、漳平2号和武平2号差异极显著;漳平2号、红山1号和武平2号三者之间差异均达到显著水平;CAT活性最低的武平2号与其他4个无性系的差异均达到极显著。由此可见,5个油茶无性系叶片的过氧化氢酶(CAT)活性排序为:河田2号、新罗2号>红山1号>漳平2号>武平2号(图3)。其中河田2号和新罗 2号的 CAT活性无显著差异,分别为66.10 U·mg-1和 65.33 U·mg-1;武平 2 号的 CAT 活性最低,只有 22.43 U·mg-1(图3)。
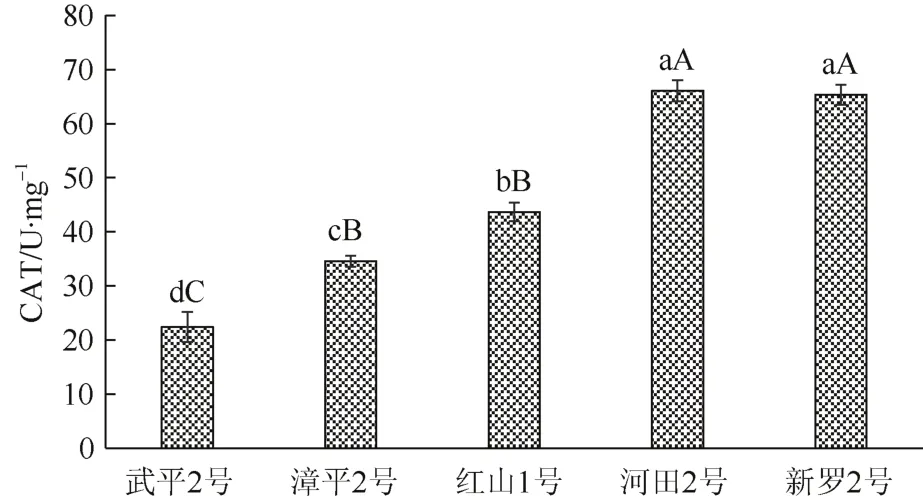
图3 不同油茶无性系叶片的CAT活性比较Fig. 3 Comparison of CAT activity in leaves of different Camellia oleifera clones
3.2.4 可溶性蛋白含量
不同油茶无性系叶片的可溶性蛋白含量比较显示,林间抗性无性系的可溶性蛋白含量略高于低感品种,其中新罗 2号的可溶性蛋白含量较高,达63.94 mg·g-1;河田2号、红山1号和漳平2号可溶性蛋白含量在47.23~60.30 mg·g-1之间,武平2号的活性最低,仅为35.44 mg·g-1(图4)。不同无性系的可溶性蛋白含量的方差分析F值为7.63>F0.01(2,18)=6.01,表明油茶无性系的不同,极显著地影响其体内可溶性蛋白含量。LSD多重比较分析显示,新罗2号和河田2号的可溶性蛋白含量最高,两者之间差异不显著,但与漳平2号的差异均达显著水平,与武平2号之间达极显著差异;武平2号的可溶性蛋白含量最低,除了与漳平2号之间差异不显著之外,与其余三个无性系之间均差异显著(图4)。

图4 不同油茶无性系叶片的可溶性蛋白含量比较Fig. 4 Comparison of soluble protein content in leaves of different Camellia oleifera clones
3.3 不同油茶无性系生理指标与感病指数的相关性分析
相关性分析表明(表4),炭疽病感病指数与叶片SOD活性呈极显著负相关,相关系数为-0.972;与叶片POD活性、可溶性蛋白含量呈显著负相关,相关系数分别为-0.914和-0.933;与叶片CAT活性的相关性未达到显著水平,相关系数为-0.853。由此可见,油茶无性系叶片的生理指标越高,其抵抗炭疽病的能力越强,可以在油茶抗病选育中作为参考依据。

表4 不同油茶无性系生理指标与炭疽病感病指数的相关系数Table 4 Correlation analysis between physiological indexes and the disease indexes of different Camellia oleifera clones
4 结论与讨论
4.1 林间不同油茶无性系对炭疽病的抗性
油茶炭疽病的抗性研究一直是油茶研究的热点之一,对其抗病性鉴定、评价等有不同的方法,在抗病性鉴定上主要有林间自然鉴定法和室内接种鉴定法[4,12—13],评价方法主要有平均病斑直径法[14]、聚类分析法[15]和病情指数法[9,16]等。此外,油茶对炭疽病的感病情况,不仅与油茶种质有密切关系,还受到油茶种植密度、林地管理及气候等因素的影响[17—18]。本文在林分立地条件、密度及管护措施一致的情况下,采用林间自然鉴定法和病情指数法,对5个闽西当地的油茶无性系的炭疽病抗性进行调查分析,充分反应了不同油茶种质对炭疽病抗性的差异。5个无性系之间的抗性表现各不相同,其中高抗无性系1个(新罗2号)、中抗无性系3个(河田2号、红山1号、漳平2号)、低感无性系1个(武平2号)。不同油茶种质材料对炭疽病表现出不同的抗性,印证了黄迪等[13]、杨华等[19]的研究。这为油茶抗病品种选育提供了重要的育种材料。
4.2 油茶炭疽病抗性与其生理指标的关系
植物体受到病原菌侵染时,其机体会作出迅速反应,相关代谢途径会发生明显的改变,酶活性与植物抗性呈一定的相关性[20—21]。本研究表明,闽西5个油茶无性系叶片POD活性和可溶性蛋白含量与油茶炭疽病感病指数呈显著负相关,SOD活性与感病指数呈极显著负相关,CAT活性与感病指数相关性不显著。这与常明山等[21]的研究结果基本一致,油茶体内的防御酶具有抵抗病原菌的能力,随着病原菌的侵入,相关防御酶活性也相应增加,但不同酶的表现各不相同。本研究中CAT活性与感病指数相关性虽不显著,但也达中度相关(相关系数r=-0.853)。高抗的新罗2号无性系,其POD活性、SOD活性、可溶性蛋白含量最高;中抗的河田2号无性系,其CAT活性与新罗2号无性系差异不显著,说明其抗病能力也相对较强。该结果与前人研究基本一致[10,22—24],说明油茶防御性酶的活性可作为早期筛选油茶抗炭疽病的指标,为油茶抗病育种提供依据。
综上所述,本研究对所筛选的5个闽西当地的油茶无性系进行抗炭疽病评价,并分析不同无性系叶片POD、SOD、CAT活性及可溶性蛋白含量的差异,最后分析生理指标与炭疽病感病指数的相关性,初步获得新罗2号和河田2号两个抗性较强的无性系,为油茶抗性育种奠定基础,也为进一步研究油茶抗炭疽病机理提供参考。

