SBF2-AS1 在食管鳞癌中的表达变化及其对肿瘤细胞KYSE410增殖、放疗敏感性的影响
李晓敏,查文娟,铁小伟,李皓,高飞,刘阳晨
蚌埠医学院附属泰兴市人民医院,江苏泰州225400
食管癌是常见的恶性肿瘤之一[1]。我国食管癌病理类型主要为鳞状细胞癌[2]。因食管癌早期症状缺乏特异性,且易发生侵袭及转移,大多数患者确诊已为晚期,失去手术机会,5 年生存率<30%。放疗是中晚期食管癌的主要治疗手段[3]。然而,晚期食管癌患者放疗后局部控制不理想或复发者占50%~60%[4]。放疗抵抗是影响肿瘤治疗效果和患者预后的重要因素。因此,寻找食管癌放疗敏感性相关分子标志物,有望提高放疗敏感性。研究证实,长链非编码RNA(lncRNA)与多种恶性肿瘤(如非小细胞肺癌、食管鳞癌、胃癌、鼻咽癌等)的增殖、迁移、侵袭、转移、化疗耐药、放疗敏感性等有关[5-9]。SBF2-AS1是一种新发现的lncRNA,位于染色体11p15.1,是SBF2的一个2 708 nt的反义RNA[10]。研究发现其在多种肿瘤中高表达,参与调控肿瘤的发生发展[11-12]。2019 年10 月—2020 年6 月,本研究观察了SBF2-AS1在食管鳞癌中的表达变化及其对食管鳞癌细胞KYSE410 增殖、放疗敏感性的影响,探讨可能的作用机制。现报告如下。
1 材料与方法
1.1 组织、细胞及主要实验材料 食管鳞癌切除手术中留取的食管鳞癌组织及其配对的癌旁(距肿瘤组织边缘>5 cm)正常组织87例。患者男56 例、女21例,年龄18~70(61.33 ± 7.06)岁,肿瘤直径≤5 cm 56 例、>5 cm 31 例,TNM 分期T1~T2期35 例、T3~T4期52 例,淋巴结转移为N0~N156 例,N2~N331 例,分化程度为低分化45 例、中高分化42 例。患者为初诊,术前未接受任何抗肿瘤治疗,经术后组织病理检查证实诊断,临床病理资料和随访资料完整。排除合并其他部位恶性肿瘤者,合并严重肝、肾等重要脏器功能不全者。食管鳞癌细胞KYSE410、食管正常上皮细胞HEEPIC 由蚌埠医学院附属泰兴市人民医院实验室冻存。RPMI1640、胎牛血清购自美国Gibco公司。 TRIzol、PrimeScriptTMRT Master Mix(Perfect Real Time)逆转录试剂盒、SYBR Premix Ex TaqTMⅡ试剂盒购自日本TaKaRa 公司。siRNA-SBF2-AS1 及引物购自上海生物工程有限公司。Lipofectamine RNA iMAX Reagent 购自美国Invitrogen 公司。CCK-8、EdU、0.1% 结晶紫、胰蛋白酶、Western blotting 试剂盒购自上海碧云天生物科技有限公司。Annexin V-FITC 凋亡检测试剂盒购自BD Biosciences 公司。本研究经医院医学伦理委员会批准,患者或其家属知情同意。
1.2 食管鳞癌组织、细胞中SBF2-AS1 检测 采用TRIzol 试剂提取食管鳞癌组织、癌旁正常组织及KYSE410 细 胞 和HEEPIC 细 胞 的 总RNA。 按 照PrimeScriptTMRT Master Mix(Perfect Real Time)逆转录试剂盒说明书将RNA 逆转录为cDNA。 采用SYBR Premix Ex TaqTMⅡ试剂盒进行荧光定量PCR扩增,以GAPDH 作为内参照。SBF2-AS1 上游引物序列为5′-CACGACCCAGAAAGAvGTCTAC-3′,下游引 物 序 列 为5′-CCCGGTACCTTCCTGTCATA-3′;GAPDH 上游引物序列为5′-CTGGGCTACACTGAG⁃CACC-3′,下 游 引 物 序 列 为5′-AAGTGGTCGTT⁃GAGGGCAATG-3′。以2-ΔΔCt计算目的基因相对表达量。实验重复3次,取平均值。
1.3 下调SBF2-AS1表达对食管鳞癌细胞增殖能力的影响观察
1.3.1 细胞分组 KYSE410 细胞用含10% 胎牛血清和1% 双抗的RPMI1640 培养液于37 ℃、5% CO2培养箱中培养,取处于对数生长期的细胞,分为siR⁃NA-SBF2-AS1 组、NC 组。 使 用Lipofectamine RNA iMAX Reagent分别将siRNA-SBF2-AS1、NC转染siR⁃NA-SBF2-AS1 组、NC 组细胞。qRT-PCR 检测siR⁃NA-SBF2-AS1组细胞中SBF2-AS1表达较NC组显著下降(分别为0.33 ± 0.02、1.00 ± 0.00)。
1.3.2 细胞增殖能力检测 采用CCK-8实验。将siRNA-SBF2-AS1组、NC组的细胞按2×103/孔接种于96 孔板中,分别于0、24、48、72、96 h 后每孔加入CCK-8溶液10 µL,37 ℃孵育2 h,酶标仪于450 nm波长处测定光密度(OD)值。每组设置3个复孔,取平均值。
1.4 下调SBF2-AS1表达对食管鳞癌细胞放疗敏感性的影响观察
1.4.1 细胞分组及放疗方法 分组及操作参照“1.3.1”。将siRNA-SBF2-AS1 组、NC 组处于对数生长期的细胞以5×104/孔接种于6 孔板中,贴壁后用4 Gy的X射线照射,6 mV射线,剂量率为300 mU/min,机架角为180°,SSD源皮距100 cm,继续培养48 h。
1.4.2 细胞增殖能力观察 采用EdU 实验。用细胞培养液1∶500稀释EdU,37 ℃预热5 min;放疗处理细胞后,将6孔板中细胞培养液留至1 mL,每孔加入稀释预热后的EdU,细胞培养箱中孵育2 h,弃去培养液;按照EdU 试剂盒说明书每孔加入固定液、通透液、洗涤液,弃去洗涤液;每孔加入用PBS 1∶1 000稀释的Hoechst33342反应液,室温避光孵育10 min,弃去反应液,洗涤液洗涤3 次、每次3~5 min;荧光显微镜下观察,有绿色荧光为增殖细胞。
1.4.3 细胞凋亡率测算 采用流式细胞术。将经放疗处理后的细胞用预冷的PBS 漂洗1 次,胰酶消化细胞,离心后去上清,PBS 漂洗2 次,收集1×106个细胞,重悬细胞于100 µL 结合缓冲液中,加入An⁃nexinV-FITC 5 µL 混匀后加入PI 5 µL 混匀,室温避光孵育20 min,加入结合缓冲液400 µL 滤过滤网,流氏细胞仪测算两组细胞凋亡率。
1.4.4 放疗敏感性评价 采用克隆形成实验。取siRNA-SBF2-AS1组、NC组细胞分别以2×102、5×102、1×103、2×103、5×103/孔接种于96 孔板中,给予0、2、4、6、8 Gy 的射线照射,照射条件同“1.4.1”,每组设置3 个复孔;继续培养细胞10~14 d,待形成肉眼可见的菌落时,弃去培养基,PBS 漂洗2 遍,用90% 乙醇固定细胞15 min,弃去乙醇,PBS 漂洗2 遍,用0.1% 结晶紫染色20 min,显微镜下计数单克隆数(≥50 个细胞计为1 个单克隆)。计算两组细胞存活分数(SF)和细胞克隆形成率(PE)。SF=(受照射组PE/对照组细胞PE)×100%。PE=(克隆细胞数/接种细胞数)×100%。绘制单击多靶模型拟合细胞存活曲线。根据细胞存活曲线得出D0(终斜率的倒数)、Dq(准阈剂量)、SF2(离体肿瘤培养细胞经2 Gy照射后的SF),并计算放射增敏比。放射增敏比=si-NC组D0/siRNA-SBF2-AS1组D0。
1.4.5 细胞中E2F 转录因子1(E2F1)蛋白检测采用Western blotting 法。用含有PMSF 的PIPA 裂解液提取siRNA-SBF2-AS1组、NC 组细胞总蛋白,冰上孵育30 min,4 ℃、12 000 g 离心15 min,取上清液。用BCA 蛋白分析试剂盒进行蛋白定量。将蛋白样品与5×loading buffer混匀,金属浴100 ℃煮沸5 min。用10% SDS-PAGE 凝胶电泳分离蛋白质,然后转移至聚氟乙烯(PVDF)膜上,封闭2 h,洗涤液洗膜3次。加入稀释的抗E2F1 抗体(1∶1 000)4 ℃孵育过夜,然后用稀释的辣根过氧化物标记的二抗室温下孵育2 h。取ECL荧光检测试剂盒,在暗室中加入适量A 液、B 液的混合液,滴于膜上,凝胶成像系统扫描成像,分析各组E2F1蛋白相对表达水平。
1.5 统计学方法 采用SPSS23.0 统计软件。计量资料以表示,两组间比较采用独立样本t检验。计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 食管鳞癌SBF2-AS1表达变化及与肿瘤临床病理参数的关系 食管鳞癌组织、癌旁正常组织中SBF2-AS1 相对表达量分别为1.94 ± 1.24、0.95 ±0.64,KYSE410 细胞、HEEPIC 细胞中SBF2-AS1 相对表达量分别为5.18 ± 0.07、1.00 ± 0.00,食管鳞癌组织和细胞中SBF2-AS1 表达高于癌旁正常组织和正常食管上皮细胞(P均<0.05)。肿瘤直径>5 cm者、T3~T4期者SBF2-AS1 相对表达量分别高于直径≤5 cm者、T1~T2期者(P均<0.05)。见表1。
表1 不同临床病理参数的食管鳞癌组织中SBF2-AS1表达比较()
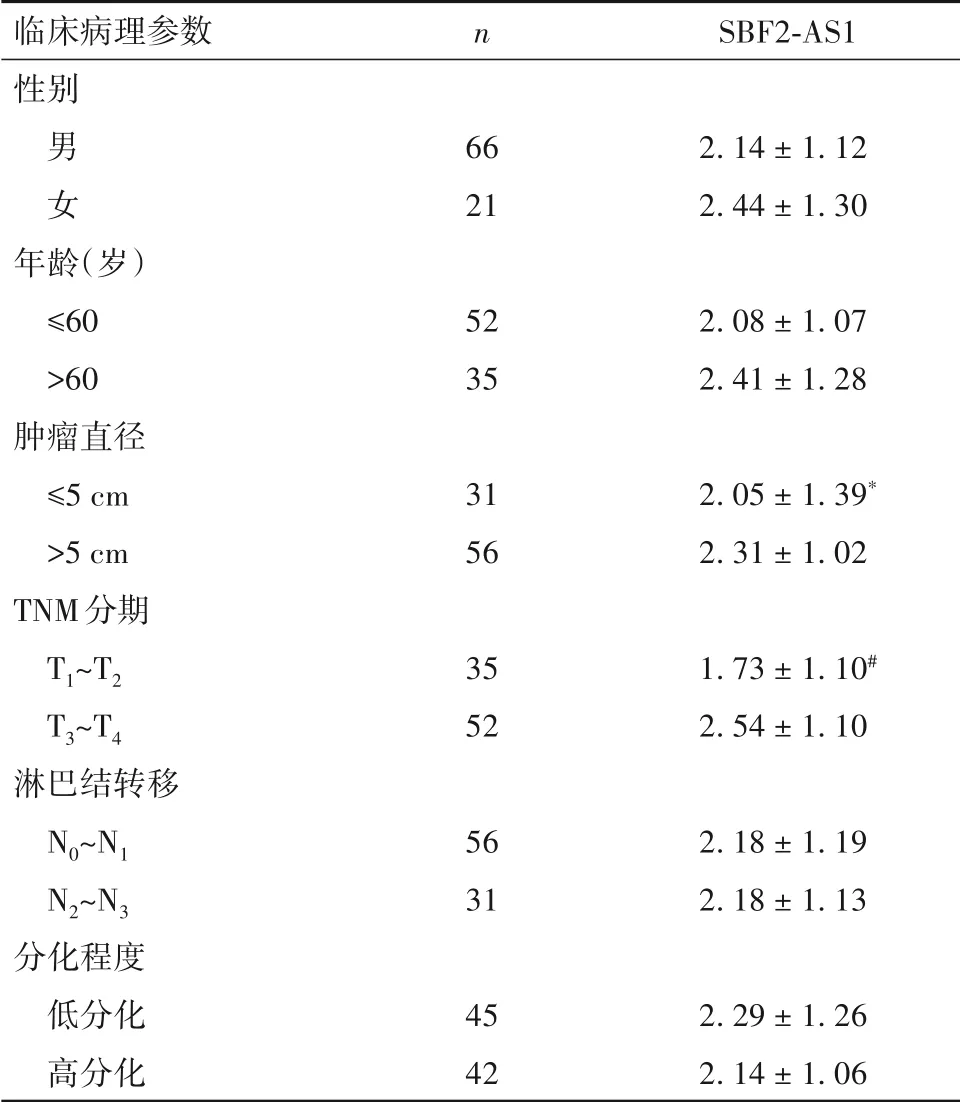
表1 不同临床病理参数的食管鳞癌组织中SBF2-AS1表达比较()
注:与肿瘤直径>5 cm者相比,*P<0.05;与T3~T4期者相比,#P<0.05。
临床病理参数性别n SBF2-AS1男女66 21 2.14 ± 1.12 2.44 ± 1.30年龄(岁)≤60>60肿瘤直径≤5 cm>5 cm TNM分期T1~T2 T3~T4淋巴结转移N0~N1 N2~N3分化程度低分化高分化52 35 2.08 ± 1.07 2.41 ± 1.28 31 56 2.05 ± 1.39*2.31 ± 1.02 35 52 1.73 ± 1.10#2.54 ± 1.10 56 31 2.18 ± 1.19 2.18 ± 1.13 2.29 ± 1.26 2.14 ± 1.06 45 42
2.2 下调SBF2-AS1 表达对食管鳞癌细胞增殖能力的影响 转染24、48、72、96 h 后siRNA-SBF2-AS1 组细胞增殖能力低于NC 组(P均<0.05)。见表2。
表2 转染不同时点siRNA-SBF2-AS1组、NC组细胞增殖能力比较()

表2 转染不同时点siRNA-SBF2-AS1组、NC组细胞增殖能力比较()
注:与同时点NC组相比,*P<0.05。
组别siRNA-SBF2-AS1组NC组细胞增殖能力96 h 1.52 ± 0.09*2.27 ± 0.05 0 h 0.21 ± 0.00*0.21 ± 0.00 24 h 0.51 ± 0.09*1.04 ± 0.06 48 h 1.00 ± 0.09*1.63 ± 0.07 72 h 1.36 ± 0.06*1.96 ± 0.05
2.3 下调SBF2-AS1表达对食管鳞癌细胞放疗敏感性的影响 不同X 线照射条件的siRNA-SBF2-AS1组细胞增殖率、E2F1蛋白表达均低于NC 组,细胞凋亡率高于NC 组;照射后细胞增殖率和E2F1 蛋白表达低于未照射细胞,细胞凋亡率高于未照射细胞(P均<0.05)。详见表3。siRNA-SBF2-AS1 组细胞D0、Dq、SF2低于NC 组(P均<0.05),单击多靶模型参数值计算其放射增敏比为2.00 ± 0.10。见表4。
表3 siRNA-SBF2-AS1组、NC组不同X线照射条件下细胞增殖率、凋亡率及E2F1蛋白表达比较()
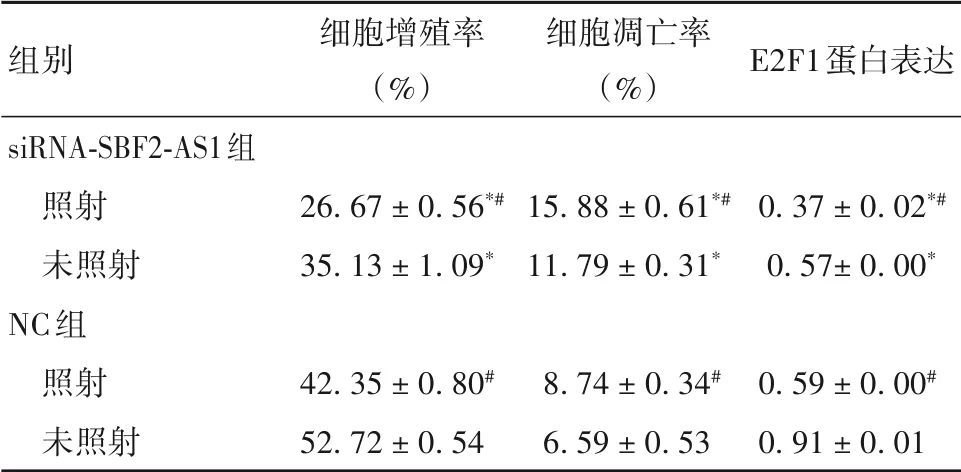
表3 siRNA-SBF2-AS1组、NC组不同X线照射条件下细胞增殖率、凋亡率及E2F1蛋白表达比较()
注:与相同条件NC 组相比,*P<0.05;与同组未照射细胞相比,#P<0.05。
组别细胞增殖率(%)细胞凋亡率(%)E2F1蛋白表达siRNA-SBF2-AS1组照射未照射NC组照射未照射26.67 ± 0.56*#35.13 ± 1.09*15.88 ± 0.61*#11.79 ± 0.31*0.37 ± 0.02*#0.57± 0.00*0.59 ± 0.00#0.91 ± 0.01 42.35 ± 0.80#52.72 ± 0.54 8.74 ± 0.34#6.59 ± 0.53
表4 siRNA-SBF2-AS1组、NC组单击多靶模型拟合细胞存活曲线参数比较()

表4 siRNA-SBF2-AS1组、NC组单击多靶模型拟合细胞存活曲线参数比较()
注:与NC组相比,*P<0.05。
组别siRNA-SBF2-AS1组NC组SF2 0.59 ± 0.09*0.72 ± 0.18 D0 Dq 0.58 ± 0.02*1.17 ± 0.10 1.24 ± 0.05*2.55 ± 0.12
3 讨论
尽管近年来食管癌的诊断和治疗方法已有所改进,但晚期食管癌患者的生存率仍然很低[13]。食管癌的诊治是目前研究的难点和热点。探索食管癌发生发展的相关基因及可能的机制有助于为食管癌的诊治提供新的方向。
lncRNA 表达失调在肿瘤的发生发展过程中发挥重要作用。SBF2-AS1 已被证实在多种肿瘤中发挥促癌作用,参与肿瘤的发生发展,其机制可能是作为“ceRNA”靶向调控下游靶点,从而调控细胞的增殖、侵袭、转移等生物学过程。如SBF2-AS1 可通过竞争性抑制miR-30a 来靶向调节叉头框蛋白家族成员A1表达,促进骨肉瘤的增殖、侵袭和迁移,发挥促癌作用[14]。SBF2-AS1 可竞争性集合miR-140-5p 靶向调节转化生长因子β 受体1 从而促进肝癌细胞的增殖和侵袭[15]。研究证实,SBF2-AS1在食管鳞癌细胞ECA109 中高表达;沉默SBF2-AS1 后,细胞的增殖能力、集落形成能力、侵袭和迁移能力均显著受到抑制[16]。本研究发现,SBF2-AS1在食管癌组织和细胞中显著高表达,且其表达水平与肿瘤大小、TNM分期有关,与患者性别、年龄、淋巴结转移情况、肿瘤分化程度无关;下调SBF2-AS1 表达后,KYSE410 细胞的增殖能力显著受到抑制,表明SBF2-AS1在食管癌中发挥促癌作用。
放疗是上段食管癌及中晚期食管癌的主要治疗手段。随着放疗技术的不断发展,食管癌放疗疗效不断提高,但由于肿瘤遗传特性改变、恶性肿瘤组织对放疗的敏感性差异及周围正常组织对放射剂量耐受性限制等因素,影响放疗效果,导致肿瘤局部复发或转移[17]。因此,探索影响肿瘤细胞放射抵抗的分子机制,改善肿瘤的放疗敏感性,可为改善食管癌的治疗效果及预后提供帮助。
大量研究证实,lncRNA 可调控食管癌放疗敏感性。沉默Rpph1 可增加食管癌细胞的放疗敏感性[18]。结肠癌相关转录本2 可诱导食管癌细胞的放疗抵抗[19]。最近有研究表明,SBF2-AS1可诱导非小细胞肺癌的放疗耐受,下调SBF2-AS1 可通过抑制miR-302a/MBNL3 axis 轴增强非小细胞肺癌细胞的放疗敏感性[20],但在其他肿瘤中未见报道。本研究结果显示,下调SBF2-AS1 表达后,KYSE410 细胞的增殖能力下降,给予X 线照射后的细胞增殖率和存活分数下降、凋亡率和放射增敏比增高,提示下调SBF2-AS1表达可增加食管癌细胞的放疗敏感性,与SBF2-AS1在其他恶性肿瘤中的相关研究结果一致。
E2F1 是E2F 转录因子家族的成员,其可通过调控多种lncRNA 参与细胞增殖、侵袭、转移等多项生物学过程[21-23]。有研究证实,在宫颈癌中下调E2F1的表达,细胞存活率降低,细胞凋亡率增加,其高表达与放疗敏感性降低及预后不良有关[24]。还有学者发现,在非小细胞肺癌中E2F1 可诱导SBF2-AS1 表达上调,促进细胞的增殖、侵袭和转移[25]。本研究结果显示,对SBF2-AS1表达下调的食管鳞癌细胞进行X 线照射后,细胞增殖抑制,细胞凋亡增多,E2F1 蛋白表达水平降低。
综上所述,SBF2-AS1 在食管癌组织和细胞中高表达;下调SBF2-AS1 表达可抑制食管鳞癌细胞增殖,提高放疗敏感性,其机制可能与调控E2F1 蛋白表达有关,具体作用机制有待进一步研究。

