血清ox-LDL、Gal-3和DKK-1与ACI患者颈动脉粥样斑块的关系分析
李灵真,高立功,金俊
(驻马店市中心医院神经内科,河南 驻马店 463000)
近年,颈动脉粥样硬化被认为与急性脑梗死(acute cerebral infarction,ACI)的发病密切相关,颈动脉粥样斑块破裂、出血、血栓形成是ACI发病的重要机制[1]。氧化型低密度脂蛋白(oxidized lowdensity lipoprotein,ox-LDL)可激活巨噬细胞及淋巴细胞,活化的巨噬细胞聚集ox-LDL成为含脂泡沫细胞,与平滑肌细胞一起形成钙化的动脉粥样斑块,是公认的动脉粥样硬化前体颗粒[2]。半乳糖凝集素3(galectin-3,Gal-3)能参与氧化低密度脂蛋白诱导血管平滑肌细胞表型转化,使血管内皮细胞及巨噬细胞摄取脂质能力增强,而促动脉粥样斑块形成[3]。分泌型蛋白Dickkopf-1(Dickkopf-1,DKK1)为Wnt信号通路拮抗分子,参与炎症调节,可影响血管内皮细胞及血小板间的炎症反应,促动脉粥样硬化[4]。因此,本研究就血清ox-LDL、Gal-3、DKK-1水平与ACI患者颈动脉粥样斑块的关系展开分析。
1 资料与方法
1.1 一般资料 回顾性分析2018年3月至2019年12月我院126例ACI患者临床资料。纳入标准:⑴经影像学检查确诊且符合《中国急性缺血性脑卒中诊治指南》[5]中ACI诊断标准;⑵首次发作且发病至入院时间≤48 h;⑶年龄>18岁;⑷影像学检查、实验室结果等资料完整。排除标准:⑴合并脑出血、感染性疾病;⑵血管先天发育异常致脑血管疾病;⑶合并血管畸形、动脉瘤或恶性肿瘤;⑷伴严重心、肝、肾等器官功能障碍;⑸发病2周内服用维生素B、叶酸、抗氧化剂。并纳入48例同期健康体检者作为健康对照组。
1.2 方法ACI患者均收集入院2 h内外周肘静脉血5 ml,健康对照组则收集体检时空腹外周肘静脉血5 ml,经3000 r/min低温离心10 min,取上清液,采用酶联免疫分析法(ELISA法,武汉博士德生物工程有限公司)检测血清ox-LDL水平;采用ELISA法(美国BD公司)检测Gal-3及DKK-1水平。ACI患者在入院24 h内行颈动脉彩色多普勒超声检查,仪器为荷兰飞利浦公司HD11 XE,探头频率5~12 MHz,将颈动脉内-中膜厚度≥1.5 mm视为有斑块,纳入斑块组;<1.5 mm为无斑块,纳入无斑块组。与周围组织相比,强回声、表面光滑的硬斑、扁平斑视为稳定型斑块,纳入稳定型斑块组;低回声或两组回声同时存在、表面粗糙的软斑、硬斑、混合斑等视为不稳定型斑块,纳入不稳定型斑块组。
1.3 统计学方法 应用SPSS 21.0软件进行统计学分析;计量资料以(±s)表示,三组间比较采用单因素方差分析,两两比较采用SNK-Q检验,两组组间比较使用t检验;计数资料以n(%)表示,采用χ2检验;采用受试者工作特征(receiver operator characteristic,ROC)曲线评估诊断价值,计算曲线下面积(area under curve,AUC),AUC值越高,诊断价值越高;相关性则采用Spearman秩相关分析;以P<0.05为差异有统计学意义。
2 结果
2.1 各组基线资料比较 斑块组与无斑块组高血压、糖尿病情况及白细胞水平比较,差异均无统计学意义(P>0.05),但两组白细胞水平均高于健康对照组(P<0.05),见表1。
表1 各组基线资料比较[(±s),n(%)]

表1 各组基线资料比较[(±s),n(%)]
注:与健康对照组比较,*P<0.05。
?
2.2 3组血清ox-LDL、Gal-3和DKK-1水平比较斑块组血清ox-LDL、Gal-3和DKK-1水平均显著高于无斑块组及健康对照组(P<0.05),而无斑块组上述指标水平又高于健康对照组(P<0.05),见表2。
表2 3组血清ox-LDL、Gal-3和DKK-1水平比较(±s)

表2 3组血清ox-LDL、Gal-3和DKK-1水平比较(±s)
注:与健康对照组比较,*P<0.05;与无斑块组比较,#P<0.05。
?
2.3 血清ox-LDL、Gal-3和DKK-1水平对ACI患者合并颈动脉粥样斑块的诊断价值分析 经ROC曲线分析,血清ox-LDL、Gal-3和DKK-1水平对ACI患者合并颈动脉粥样斑块均有较高诊断价值(P<0.05),其截断值为211.60μg/ml、3.85 ng/ml、5.19 ng/ml,且3项指标联合检测诊断价值最高,见表3、图1。
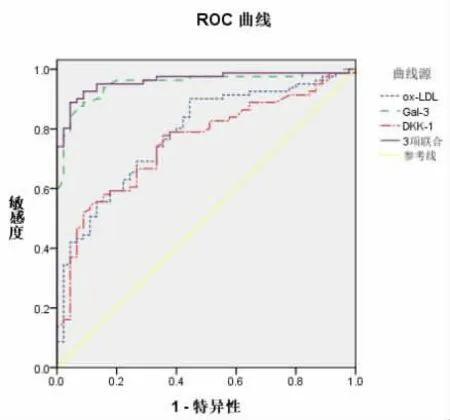
图1 各指标诊断ACI患者合并颈动脉粥样斑块的ROC曲线

表3 各指标对ACI患者合并颈动脉粥样斑块的诊断价值分析
2.4 血清ox-LDL、Gal-3和DKK-1水平与ACI患者颈动脉粥样斑块稳定性的关系 不稳定型斑块组血清ox-LDL、Gal-3和DKK-1水平均显著高于稳定型斑块组(P<0.05),见表4;经Spearman秩相关分析,发现血清ox-LDL、Gal-3和DKK-1水平与ACI患者颈动脉粥样斑块稳定性呈负相关(r=-0.341、-0.385、-0.332,P<0.05)。
表4 不同斑块稳定性患者血清ox-LDL、Gal-3和DKK-1水平比较(±s)
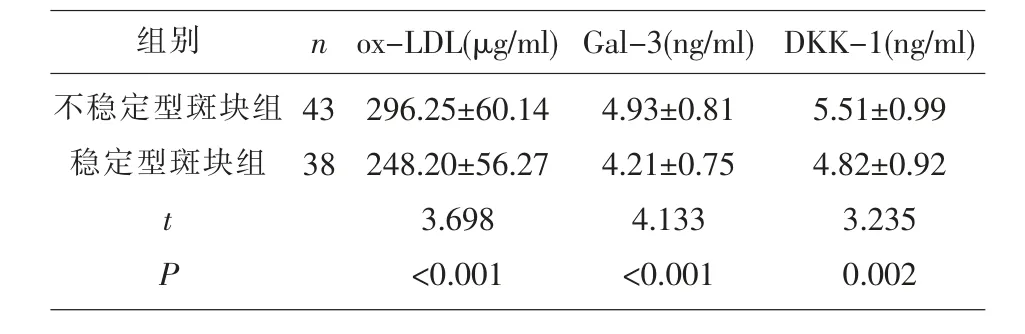
表4 不同斑块稳定性患者血清ox-LDL、Gal-3和DKK-1水平比较(±s)
?
3 讨论
有研究指出[6-7],颈动脉粥样斑块的负荷及成分可评估颅内新发梗死灶发生风险,还与梗死灶体积相关,评估颈动脉粥样斑块形成及性质对判断ACI病情进展有利。据文献报道[8],ox-LDL可诱导血管内皮细胞凋亡,加强血小板聚集能力,促进血栓、粥样斑块形成;并募集巨噬细胞,诱导泡沫细胞形成,加速动脉粥样硬化进展。本研究中,斑块组血清ox-LDL水平显著高于无斑块组,且血清ox-LDL水平对ACI颈动脉粥样斑块具有较高诊断价值,提示ox-LDL可能参与ACI颈动脉粥样斑块形成过程,与上述报道一致。且血清ox-LDL水平与ACI颈动脉粥样斑块稳定性呈负相关,提示血清ox-LDL水平越高者,斑块稳定性越差,新发梗死灶风险越高,临床应积极予以防控措施。
Gal-3为促炎因子,不仅能通过促炎反应加速动脉粥样进程,还能增强巨噬细胞摄取脂质能力,诱导斑块形成,已有学者证实[9],Gal-3与2型糖尿病的颈动脉粥样硬化相关。本研究结果显示,斑块组血清Gal-3水平高于无斑块组,且血清Gal-3水平可辅助诊断ACI颈动脉粥样斑块形成,提示Gal-3与ACI的颈动脉粥样硬化也具有紧密联系。另外,血清Gal-3水平与ACI颈动脉粥样斑块稳定性呈负相关,也表明血清Gal-3水平较高者,斑块破裂风险更高,易出现新发梗死灶。考虑该结果与Gal-3强大的促炎作用,并促巨噬细胞形成泡沫细胞,分泌促使细胞外基质降解的蛋白酶,破坏斑块纤维帽,而影响斑块稳定性有关。
DKK-1可作为血小板诱导的内皮活化的新媒介,促进内皮细胞的内皮间质转化,并通过炎症反应参与动脉粥样硬化;且能上调基质金属蛋白酶表达,加速细胞外基质降解,破坏纤维帽成分,促进斑块破裂[10]。本研究也发现,血清DKK-1水平对辅助诊断ACI颈动脉粥样斑块形成有利,且与ACI患者颈动脉粥样斑块稳定性呈负相关。说明DKK-1可参与颈动脉粥样斑块的形成及发展[11]。不仅如此,血清ox-LDL、Gal-3、DKK-1联合检测对ACI颈动脉粥样斑块诊断价值最高,也提示积极检测3项指标对评估ACI病情有利。
综上所述,血清ox-LDL、Gal-3和DKK-1水平对判断ACI患者颈动脉粥样斑块形成有利,还能辅助评估斑块稳定性,有望作为ACI临床常规检测项目。

