儿童TEL-AML1阳性急性B系淋巴细胞白血病的临床特点及基因表达研究
熊枫,黄慧,樊金星,吴艳,徐红艳,曾松涛,林媛媛,杨文萍
(江西省儿童医院病理科,江西 南昌 330006)
TEL-AML1融合基因由t(12;21)(p13;q22)易位形成,是儿童ALL中最常见的染色体易位异常,占儿童B系ALL(B-ALL)的25%左右[1],对化疗比较敏感,预后较好[2]。本研究拟应用核型分析和荧光原位杂交技术(Fluorescence In Situ Hybridization,FISH)对初诊TEL-AML1阳性患儿的基因表达特征进行研究,并初步探讨其与TEL-AML1阳性患儿预后之间的相关性。
1 材料与方法
1.1 标本来源 收集江西省儿童医院2016年1月至2017年12月,结合临床表现、骨髓细胞学检查及免疫分型确诊的B-ALL患儿骨髓或外周血标本238例,其中男性143例,女性95例,年龄为1岁至15岁。
1.2 主要试剂与仪器 主要试剂:TEL-AML1、BCR-ABL、PBX1-TCF3基因、MLL断裂、CMYC断裂基因探针均购自广州安必平公司;RPMI 1640培养液、新生牛血清,秋水酰胺、吉姆萨染色液(BASO)等。主要仪器:荧光显微镜(尼康80i)、染色体工作站(蔡司Axio Imager Z)、变性杂交仪(美国雅培)等。
1.3 染色体分析 肝素抗凝骨髓液2ml,G显带分析20个分裂相中期细胞。按《人类细胞遗传学国际命名体制ISCN(2009)》进行核型描述。
1.4 FISH检测及判读 检测方法参照安必平公司的操作说明书,Nikon80i荧光显微镜观察,计数200个细胞。计数方法参考文献[3]。
1.5 随访统计 化疗开始后采用电话或者查阅病例资料的方式进行资料统计,随访截止日期为2020年12月31日,随访时间为0.5~58个月。
1.6 数据分析 采用SPSS19.0统计学软件进行分析,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 FISH结果TEL-AML1阳性患儿和阴性患儿在性别和发病年龄上无显著差别(P>0.05);TELAML1阳性患儿中常发生TEL基因等位丢失,较TEL-AML1阴性患儿差异显著(P<0.05)。而AML1基因获得和CMYC基因获得常发生于TEL-AML1阴性患儿中,较TEL-AML1阳性患儿差异显著(P<0.05),AML1基因扩增则只发生在TEL-AML1阴性患儿中(见表1~2、图1~2)。
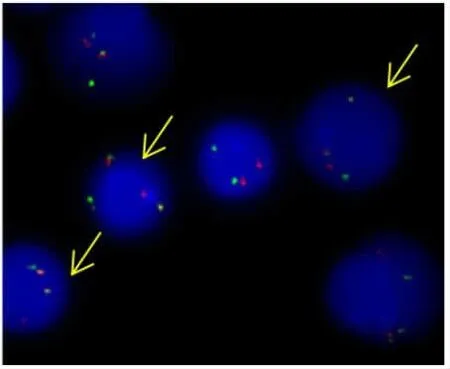
图1 TEL-AML1融合阳性信号(1R1G2Y)

表1 TEL-AML1阳性患儿组和阴性患儿组临床资料及基因检测比较
2.2 核型分析结果 对41例TEL-AML1阳性患儿进行核型分析,正常核型22例,未见分裂相16例,异常核型3例,其核型结果分别为:44-46,XY,+2,6p-,7q-,-12,-21;46,XY,add(5)(q35);48,XY,del(6)(q22),add(12)(p13),+14,+16[14]/46,XY[8]。均未发现t(12;21)。
2.3 随访208例患儿随访到了141例,其中TELAML1阳性患儿34例,TEL-AML1阴性患儿107例(含7例AML1扩增患儿)。持续完全缓解125例;复发16例,其中TEL-AML1阳性患儿1例;TEL-AML1阴性患儿15例,4例发生于AML1扩增患儿中。AML1扩增患儿的复发率较TEL-AML1阳性患儿高,差异具有统计学意义(P<0.05),见表3。
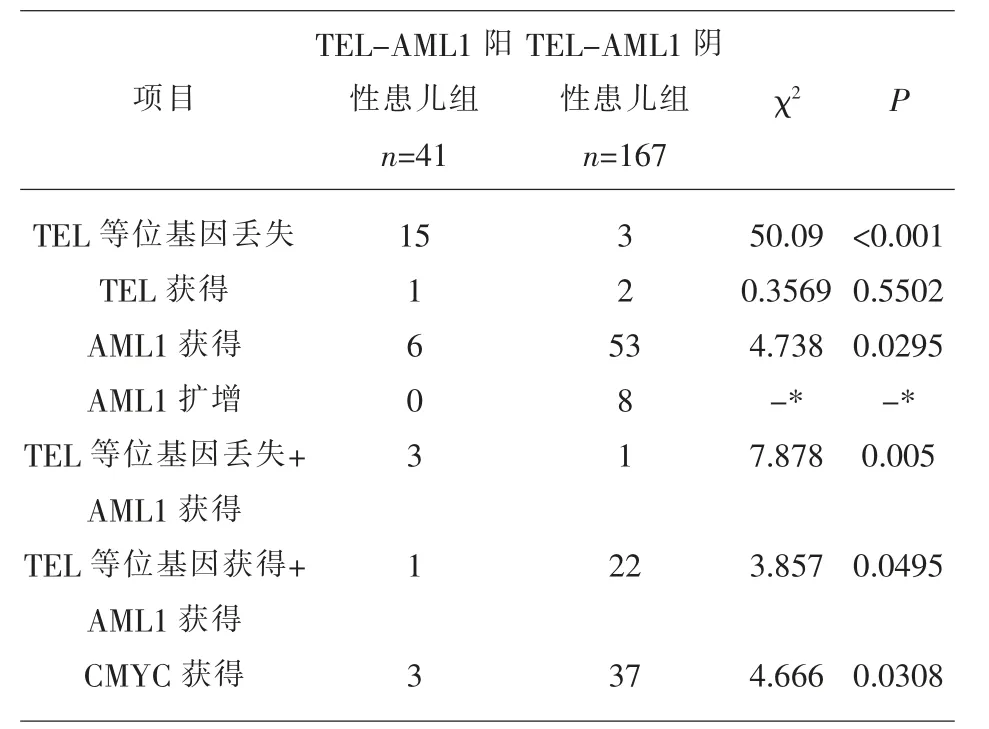
表2 TEL-AML1阳性患儿组和阴性患儿组基因表达比较

表3 TEL-AML1阳性患儿组和阴性患儿组预后比较
3 讨论
TEL-AML1融合基因型是儿童ALL常见的融合类型,发病率在15%~25%[4],发病高峰年龄为1~5岁,TEL-AML1男女比例为0.9~1.4:1[4-6]。随着年龄的增加,TEL-AML1融合发生的频率也随着降低[7]。本研究的TEL-AML1融合阳性率在17.2%,多见于B-ALL中,高峰发病年龄在2~5岁,男女比例为:1:1(20:21),与国外结果基本一致。此外,TEL-AML1阳性组和阴性组之间在发病年龄和男女性别上无显著差别(P>0.05)。
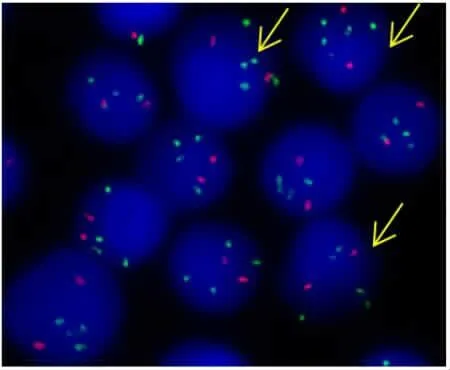
图2 AML1扩增信号(G信号》5个)
t(12;21)是儿童ALL中最常见的染色体结构异常,但由于染色体重排的片段从大小和形态非常相似,故常规细胞遗传学手段难以辨认[8]。41例TEL-AMLl阳性ALL患儿除16例染色体分析未见分裂相外,其余病例中22例具有正常核型,常规染色体分析均未发现t(12;21),这与文献报道的一致。这时必须通过分子手段,如FISH、PCR和Southern杂交等方可检出TEL-AMLl基因融合。
本研究中41例TEL-AML1阳性患儿无一例检测到BCR-ABL、PBX1-TCF3和MLL断裂重排,国外的多种研究亦没有发现TEL-AMLl阳性病例合并存在以上异常[9-11],这几种易位同时存在的可能性很小。
国外报道TEL-AML1患儿常有TEL等位基因缺失(20%~77%)[12],21号染色体或AMLl基因多拷贝也常见(15%~33%)[13],极少数患者的阳性细胞还可见3~4个TEL-AMLl融合基因。这些异常被认为是t(12;21)的继发性遗传学改变,与白血病的发生和发展相关。我们在41例初治TEL-AML1阳性患儿中也发现了类似的现象。15例患儿(36.6%)有TEL基因缺失;10例(24.4%)有AMLl基因拷贝数增加(1~2个);1例有3个融合基因信号(1G3Y,2.4%)。这些遗传学改变可同时出现于同一患者中。此外,本组研究发现AML1扩增几乎只存在于TEL-AML1阴性患儿中,其复发率较TEL-AML1阳性患儿高,这与Niini等[14]报道基本一致。AML1扩增的患儿预后更差,更容易复发,需要用更强的化疗方案来提高生存率[15]。
TEL-AML1基因阳性的患儿一般预后比较好,对化疗反应敏感,首次完全缓解(complete remission,CR)期长,但有约10%~20%的TEL-AML1阳性患儿在停药2年左右发生晚期复发[16],我们的研究结果显示有2.9%的患儿复发,复发率偏低的原因可能跟样本量、随访到病例数和随访时间相关。下一步我们将进一步积累病例及远期疗效追踪。

