TGF-β通路相关基因在绵羊性腺轴组织的表达分析
李芝丰 ,孙 伟, ,储明星
(1.中国农业科学院北京畜牧兽医研究所/农业农村部动物遗传育种与繁殖重点实验室,北京 100193;2.扬州大学动物科学与技术学院,江苏 扬州 225009;3.教育部农业与农产品安全国际合作联合实验室,江苏 扬州 225009)
发情周期和产羔数是影响绵羊产业经济效益关键因素。研究影响产羔数和发情周期关键基因可节约育种成本,缩短世代间隔。TGF-β信号通路广泛参与、调控机体各类生物过程,转化生长因子-β(TGF-β)超家族主要包括转化生长因子-β、骨形态发生蛋白、生长和分化因子、激活素和抑制素等。SMAD4(SMAD family member 4)是TGF-β/SMAD信号通路中关键信号转导分子,在哺乳动物卵泡发育和颗粒细胞增殖、分化中发挥重要作用。研究发现,卵巢中特异性敲除SMAD4 基因导致小鼠卵泡过早衰竭、颗粒细胞过早黄体化和产仔数下降[1]。此外,敲除SMAD4后,小鼠在胚胎期死亡[2],miRNA也可通过靶向调控SMAD4影响颗粒细胞和卵巢功能[3]。
TGFBR2负责编码一种跨膜糖蛋白受体,可与TGF-β配体结合,与TGFBR1 共同传递信号。Ahn等研究表明,敲除TGFBR2会使TGF-β信号通路传导失效[4]。Wang等研究发现TGFBR2一处同义突变(g.5058476C>T)与湖羊产羔数显著相关[5],且二花脸猪卵巢中该基因表达量显著高于商品猪,可能是影响其高繁殖力的候选基因[6]。
BMPs(Bone morphogenetic protein)家 族 属于TGF-β超家族,在骨成形、胚胎发育以及生殖过程中均发挥重要作用。BMPs 通过BMPⅡ型受体磷酸化BMPⅠ型受体,参与BMP/SMAD 信号通路,进入核内发挥生物学作用。BMP6最初提取于小鼠胚胎,与BMP 家族同源性较高,命名为BMP6。BMP6 对于调控哺乳动物卵泡发育具有重要作用。此外,BMP6遗传缺失小鼠排卵率下降,卵母细胞质量低,产仔数也变少[7]。
抑制素(Inhibin,INH)是由一个共同α亚基和两个不同但同源β链(βA 或βB)之一组成的异构体,有抑制素A和抑制素B两种,隶属于TGF-β超家族。抑制素B(Inhibin subunit beta B,INHBB)基因负责编码由卵巢颗粒细胞分泌的INHBB 蛋白,其对哺乳动物卵泡发育和繁殖具有重要作用。卵泡发育包括颗粒细胞增殖、细胞周期调控和分化。卵泡早期FSH(促卵泡激素)增加促进颗粒细胞分泌INHBB,进入血液循环后,抑制垂体分泌FSH[8]。此外,INHBB在颗粒细胞的细胞周期和凋亡中发挥重要作用[9]。
S 期激酶相关蛋白1(S-phase kinase association protein 1,SKP1)是泛素连接酶复合物SCF 蛋白中核心蛋白,最早在酵母中分离得到,编码丝粒蛋白,可调控细胞周期,泛素化降解[10]。研究表明,敲除SKP1 小鼠二月龄时卵巢仅有少量卵母细胞,四月龄时消失[11]。过表达SKP1 蛋白小鼠胚胎发育受影响,阻断SKP1 则促进胚胎发育[12]。该基因也是TGF-β/Smads 通路下游调控因子,在哺乳动物卵泡发育以及排卵中发挥重要作用,推测可能影响绵羊繁殖力。
成纤维细胞生长因子18(Fibroblast growth fac⁃tor 18,FGF18)是一种分泌性信号分子,以内分泌或旁分泌方式在胚胎发育尤其是骨骼、软骨发育过程中具有重要意义[13]。此外,体外培养颗粒细胞中添加高剂量FGF18 抑制编码类固醇基因表达及雌二醇和孕酮合成[14]。FGF18在闭锁卵泡中表达显著高于健康卵泡,体内注射FGF18 导致优势卵泡凋亡,体外培养颗粒细胞可提高caspase-3 水平,导致细胞凋亡[15]。表明FGF18可能通过调控颗粒细胞影响绵羊繁殖过程。
FecB是在BMPRIB基因中发现与绵羊产羔数显著相关突变(A746G),小尾寒羊中也检测到该突变。研究发现,FecB突变具有累加效应,每增加一个拷贝可提高1.5 个排卵数、1~1.5 个产羔数。本研究选取无FecB突变FecB++型小尾寒羊卵泡期和黄体期生殖轴相关组织,探究候选基因INH⁃BB、SMAD4 和FGF18 对发情性状的影响;选取FecB++和FecBBB型小尾寒羊卵泡期相关组织,探究候选基因BMP6、TGFBR2和SKP1对排卵数和产羔数的影响,在小尾寒羊下丘脑、垂体、卵巢、输卵管和子宫组织中建立组织表达谱,以期阐述其在绵羊繁殖中作用,为影响绵羊繁殖力候选基因筛选提供参考。
1 材料与方法
1.1 试验动物选择
本试验选择体重和体型一致小尾寒羊,均为3产母羊。饲养于山东郓城种羊场,定时投喂,自由饮水。
根据前期试验分型结果[16],选择20只FecB++型和FecBBB型母羊。
1.2 发情处理和样品采集
利用CIDR阴道栓(澳大利亚Zoetis公司,含有300 mg孕酮)作母羊同期发情处理。此外,除肌注5 mL VAD,无任何外源激素影响。所有母羊撤栓后45~48 h,选择FecB++型和FecBBB型母羊各3只屠宰并采集其下丘脑、垂体、卵巢、输卵管和子宫组织,此时为卵泡期;撤栓7 d 后屠宰3 只FecB++型母羊并取其下丘脑、垂体、卵巢、输卵管和子宫组织,此为黄体期。所有采集组织保存于液氮备用。
选择可能和发情性状相关候选基因INHBB、SMAD4 和FGF18,将FecB++卵泡期和FecB++黄体期作比较;选择和产羔数相关候选基因BMP6、TGF⁃BR2 和SKP1,将FecB++卵泡期和FecBBB卵泡期作比较。
1.3 RNA提取和cDNA合成
将所采集性腺轴相关组织加液氮研磨后,采用Trizol 法(Invitrogen,美国)提取总RNA,并用1.5%琼脂糖凝胶电泳和Agilent 2100 分析仪(Agi⁃lent Technologies,美国)检测RNA质量和浓度。
使用PrimeScriptTMRT 反转录试剂盒(TaKaRa Bio Inc.,大连)合成第一链cDNA。反应体系(20 μL)如下:PrimeScript RT 酶1.0 μL、Random 6 mers 1.0 μL、5×PrimeScript Buffer(for Real Time)4.0 μL、总RNA 1.0 μL 和ddH2O 13 μL。于37 ℃15 min、85 ℃5 s条件下反转录。
1.4 引物设计和荧光定量
使用Primer-BLAST 在线引物设计工具,根据INHBB、SMAD4、FGF18、BMP6、TGFBR2和SKP1 在GenBank 中序列,设计6 个引物(见表1)。此外,选择β-actin为内参基因作标准化。由北京天一辉远生物技术有限公司(北京,中国)合成。
荧光定量反应体系如下:SYBR Premix EXTaqII(TaKaRa Bio Inc, Dalian, China)10 μL、上下游引物各0.8 μL、ddH2O 6.4 μL 和cDNA 2 μL。反应程序如下:95 ℃变性5 min、40个循环95 ℃10 s和60 ℃30 s,分析溶解曲线。
1.5 数据分析与处理
采用2-ΔΔCt法计算相对表达量[17],使用SPSS 22.0(IBM,Armonk,NY,USA)处理数据。采用单因素方差分析(one-way ANOVA)基因表达水平显著性,采用Fisher's least significant difference test 作多重比较检验衡量比较组间差异,以P<0.05 为差异显著,P<0.01 为差异极显著,所有数据以平均值±SEM表示。

表1 引物信息Table 1 Information of primers
2 结果与分析
2.1 RNA质量鉴定
使用1.5%琼脂糖电泳检测提取RNA 完整性和浓度。28S 和18S 条带清晰,OD260/OD280为1.8~2.0,可用于后续试验(见图1)。
图1 RNA电泳检测Fig.1 Electrophoresis of RNA
2.2 INHBB组织表达分析
如图2 所示,INHBB在小尾寒羊5个组织中均表达,垂体和卵巢中表达量最高。其中,卵泡期卵巢中INHBB表达量极显著高于黄体期卵巢(P<0.01),卵泡期子宫中表达量极显著高于黄体期子宫(P<0.01),黄体期输卵管中表达量极显著高于卵泡期输卵管(P<0.01),下丘脑和黄体期子宫中表达量较少。
2.3 SMAD4组织表达分析
如图3所示,SMAD4在小尾寒羊5个组织两个时期均表达,垂体中表达量最高。其中,黄体期子宫中SMAD4 表达量极显著高于卵泡期子宫(P<0.01)。

图2 INHBB在小尾寒羊不同发情时期各组织表达Fig.2 Expression of INHBB in tissues of different estrus cycle of STH
2.4 FGF18组织表达分析
如图4 所示,在小尾寒羊5 个组织中,FGF18在输卵管中表达量最高,垂体中表达量较低,卵泡期输卵管中该基因表达量极显著高于黄体期(P<0.01)。
2.5 BMP6组织表达分析
如图5 所示,BMP6 在小尾寒羊5 个组织中均表达,在垂体中该基因表达量最高,FecBBB型下丘脑中BMP6表达量极显著高于FecB++(P<0.01)。
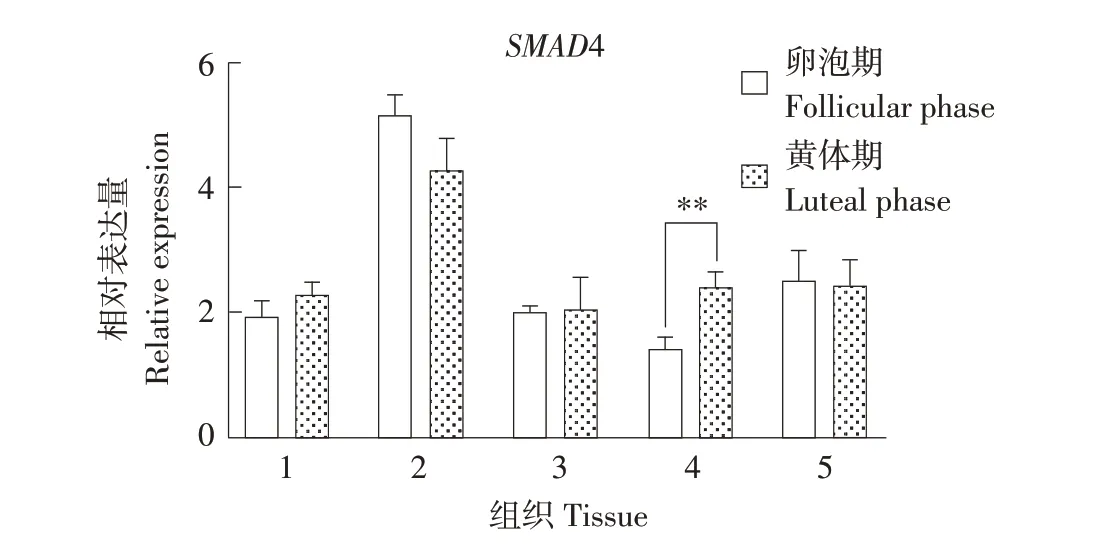
图3 SMAD4在小尾寒羊不同发情时期各组织表达Fig.3 Expression of SMAD4 in tissues of different estrus cycle of STH
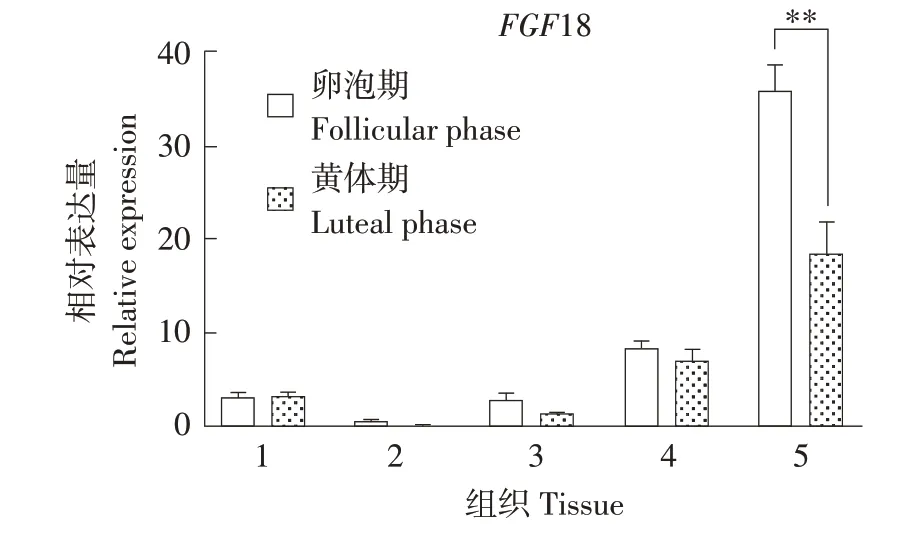
图4 FGF18在小尾寒羊不同发情时期各组织表达Fig.4 Expression of FGF18 in tissues of different estrus cycle of STH
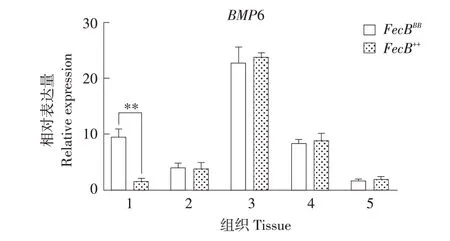
图5 BMP6在不同基因型小尾寒羊各组织表达Fig.5 Expression of BMP6 in tissues of different genotypes of STH
2.6 TGFBR2组织表达分析
如图6 所示,TGFBR2 在小尾寒羊5 个组织中均表达,卵巢中该基因表达量最高,FecB++型子宫中TGFBR2表达量极显著高于FecBBB型(P<0.01)。
2.7 SKP1组织表达分析
如图7 所示,SKP1在小尾寒羊5个组织中均表达,下丘脑和垂体中该基因表达量最高,FecBBB型垂体中SKP1表达量极显著高于FecB++型(P<0.01)。
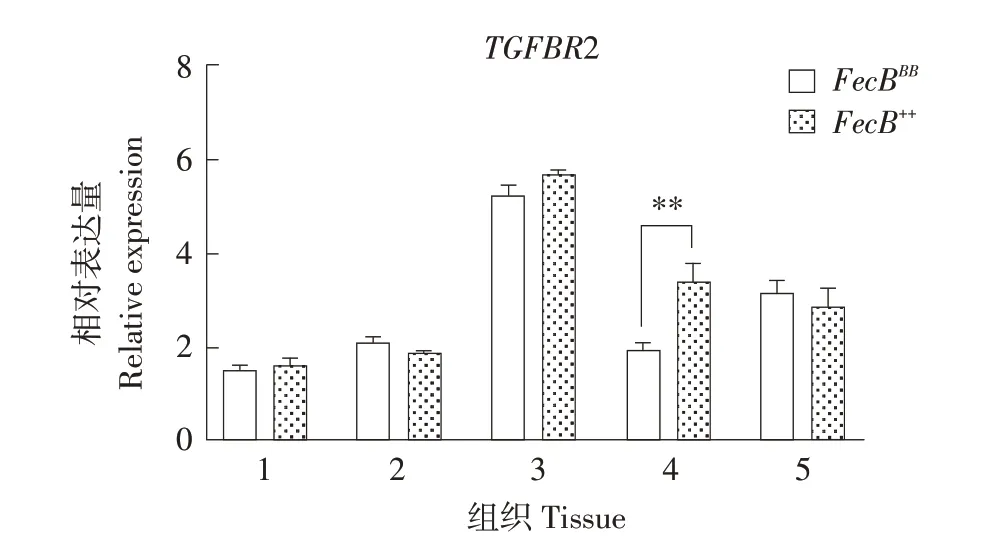
图6 TGFBR2在不同基因型小尾寒羊各组织表达Fig.6 Expression of TGFBR2 in tissues of different genotypes of STH
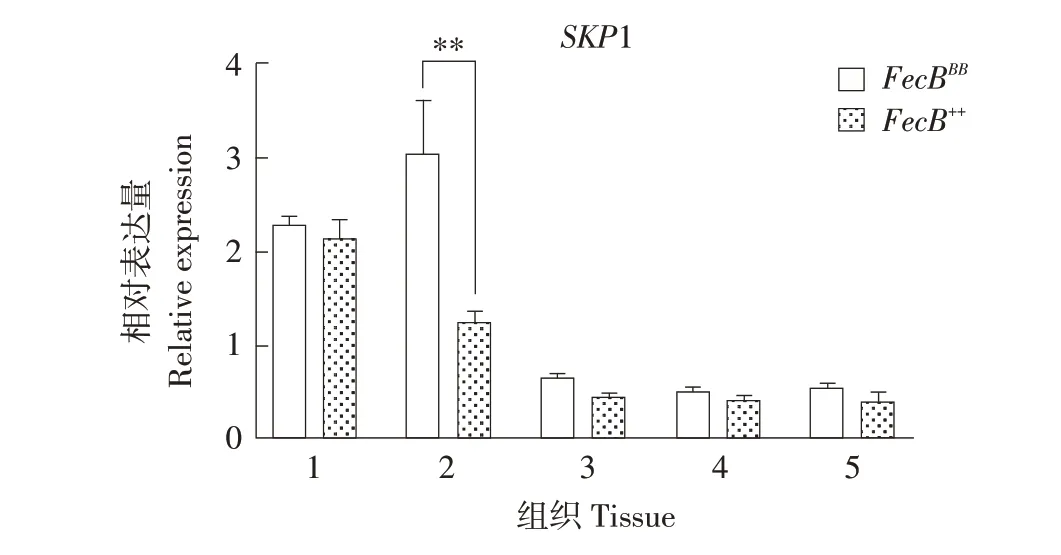
图7 SKP1在不同基因型小尾寒羊各组织表达Fig.7 Expression of SKP1 in tissues of different genotypes of STH
3 讨 论
3.1 INHBB、SMAD4和FGF18对发情周期的影响
研究表明,INHBB在绵羊下丘脑和垂体中表达。在卵泡期早期,随FSH 和E2 活跃,刺激卵巢颗粒细胞开始分泌INHBB,随卵泡募集,表达量明显增加[8],并在卵泡中期达到最高,与卵泡生长趋势一致[18]。本试验中,该基因在小尾寒羊下丘脑和垂体中均表达,且在卵泡期卵巢中表达极显著高于黄体期,与上述研究结果一致。此外,黄体形成后INHBB 分泌抑制垂体FSH 合成,这是INH⁃BB负反馈作用,可能导致垂体中抑制素表达量升高。敲除INHBB导致小鼠颗粒细胞停滞在G1 期,其细胞凋亡率上升[19],暗示抑制素B在卵泡发育中调控作用可能通过调控颗粒细胞实现,推测可能在绵羊发情周期中有一定影响。
SMAD4 在牦牛下丘脑、垂体、卵巢、子宫和输卵管中均表达[20],大鼠不同发情阶段中子宫内膜和卵巢颗粒细胞中表达量无显著差异[21]。盖玉强等发现卵巢中SMAD4 mRNA 在发情间期最低,发情期最高,且颗粒细胞和卵母细胞中也有蛋白表达[22]。本试验中SMAD4 在绵羊5 个组织中均表达,与上述研究结果一致,但黄体期子宫中SMAD4表达量极显著高于卵泡期子宫,与大鼠子宫中表达规律不一致,可能因物种不同有关。此外,SMAD4为介导TGF-β信号通路唯一Co-SMAD[2]。SMAD4 可能通过调控卵泡和颗粒细胞发育影响绵羊发情过程。
研究发现子宫中FGF18 表达量在妊娠期最高,其次是黄体期和卵泡期,而在输卵管中表达量在卵泡期最高,其次是黄体期和妊娠期[23]。本试验中,FGF18在输卵管中表达量最高,且卵泡期输卵管中该基因表达量极显著高于黄体期,与上述研究结果一致。这可能与FGF18 抑制雌激素分泌与诱导卵泡凋亡有关[14],卵巢中该基因低表达有利于卵泡发育,而输卵管中高表达则可能与FGF18维持胚胎发育有关[13]。
3.2 BMP6、TGFBR2和SKP1对繁殖力的影响
研究发现BMP6 仅在发情湖羊卵巢、输卵管、肾脏和肌肉中表达[24],单多羔绵羊卵巢中表达量无显著差异。本试验中,BMP6在下丘脑、垂体、卵巢、子宫和输卵管中均表达,卵巢中表达量最高,不同基因型卵巢中表达量无显著差异。BMP6可刺激LβT2 细胞增加FSH 分泌,抗体中和BMP6后分泌大幅下降,可能影响FSH合成和分泌[25]。在体外培养猪卵巢膜细胞中,BMP6也可抑制孕酮和cAMP产生,但不影响其增殖和存活[26],说明BMP6可能是黄体化抑制因子,推测BMP6在卵巢中高表达可抑制黄体化合成相关物质。此外,BMPR1B点突变(Q249R,FecB)导致其与BMP6 结合力下降,使BMP6 对cAMP 抑制能力降低,由此增强对FSH敏感性,导致繁殖力提高。
TGFBR2在哺乳动物各组织中广泛表达,但在卵巢、子宫和输卵管等生殖器官中具有高表达特征[27]。本试验中卵巢、子宫和输卵管表达量最高,表达特征一致。研究发现,高繁殖力湖羊卵巢中TGFBR2表达量显著高于低繁殖力湖羊,且表达量与排卵率呈正相关[24]。miR-1306 可靶向TGFBR2,使TGF-β/SMAD 通路失活,调控颗粒细胞凋亡[28]。在二花脸猪和湖羊中试验表明TGFBR2可能是影响繁殖力关键基因[5-6]。因此,TGFBR2可能对小尾寒羊繁殖力有一定影响。
SKP1 介导不同细胞周期蛋白泛素化降解,调控细胞周期。SKP1 蛋白过表达使小鼠胚胎发育受阻,死亡率提高[12]。SKP1 在卵母细胞中表达,胚胎中主要位于囊胚细胞核内,提示可能在卵母细胞成熟和胚胎发育中发挥作用[29]。本试验中,SKP1 在小尾寒羊5 个组织中均表达,下丘脑和垂体中该基因表达量最高。徐梦思等发现SKP1 在梅山猪输卵管和子宫中表达量最高[30],与本研究结果不一致,可能与物种不同有关。此外,猪不同卵泡差异表达序列标签中,TGF-β通路富集程度最高[31],推测SKP1 基因也与绵羊卵泡发育有关,需进一步试验验证。
4 结 论
本试验利用荧光定量PCR 检测小尾寒羊下丘脑、垂体、卵巢、输卵管和子宫中INHBB、SMAD4和FGF18(卵泡期和黄体期),以及BMP6、TGF⁃BR2和SKP1(FecB++和FecBBB)表达特征存在差异,6个基因对绵羊繁殖力有一定影响,为绵羊繁殖力相关候选基因研究提供参考。

