QuEChERS-分散固相萃取-液质联用法快速测定地龙中黄曲霉毒素
许晓辉,李晨曦,吴福祥,张虹艳,潘秀丽,李 赟,王小乔
(兰州市食品药品检验检测研究院,甘肃 兰州 730050)
黄曲霉毒素是黄曲霉和寄生曲霉等菌株产生的双呋喃环类毒素[1],其衍生物有20多种,最常见的有M1、B1、B2、G1等,其中B1毒性最大、致癌性最强[2]. 黄曲霉毒素M1是黄曲霉毒素B1羟基化的一种代谢产物,被世界卫生组织癌症研究机构列为一类致癌物质. 黄曲霉毒素主要存在于中药材、食品及动物饲料等相关产品中[3],比氰化物、砷化物和有机农药等的毒性大,当人体摄入量过大时,可发生急性中毒,出现出血性坏死、急性肝炎、肝细胞脂肪性病变和胆管增生等. 当人体微量摄入时,可造成慢性中毒、生长障碍和引起纤维性病变等[4]. 因黄曲霉毒素具有很强的毒性和致癌性,许多国家和组织均规定了多种食品和中药材中黄曲霉毒素的限量值,如2020年版《中国药典》规定地龙药材和饮片黄曲霉毒素B1不得超过5 μg/kg,黄曲霉毒素G2、黄曲霉毒素G1、黄曲霉毒素B2和黄曲霉毒素B1的总量不得超过10 μg/kg[5].
目前,常见的测定黄曲霉毒素的方法主要有高效液相色谱法、酶联免疫法和液质联用法等[6-8].前两种方法虽然检出限高,但在黄曲霉毒素浓度极低的样品中,难以从微量复杂组分中灵敏检出被检测目标化合物,而液质联用法能够解决这一问题. 如2020年版《中国药典》就收载了液质联用测定黄曲霉毒素的方法.四部通则中《2351 真菌毒素测定法黄曲霉毒素测定法》第一法中,试样经过70%甲醇水提取,提取液经稀释、离心后,使用高通量全自动固相萃取仪,滤液经过含有黄曲霉素特异抗体的免疫亲和柱净化和富集后,目标化合物通过带有三重四级杆质谱检测器的高效液相色谱仪进行测定. 另一方面,黄曲霉毒素的法定限量值极低,基质会影响其灵敏检测,因此去除基质干扰以增强复杂样品微量组分中的分析物信号是其检测需要解决的关键问题,而快捷有效去除基质的前处理方法是实现这一目的有效途径. 目前,检测黄曲霉毒素时,最常见去除杂质的净化方法是使用免疫亲和柱,但是这类净化柱使用流程多、价格昂贵,不利于大多数实验室快速高效筛查黄曲霉毒素[9-10]. 近年来,在中药材外源性风险因子检测中,QuEChERS方法结合固相萃取柱或分散固相萃取管得到了广泛应用. 然而,在分析脂肪含量较高的样品时,使用QuEChERS方法萃取并经过C18或N-丙基乙二胺(PSA)净化后,有可能出现不能有效去除脂质的现象,从而导致脂质聚集于管路中,甚至堵住色谱柱,造成色谱柱柱压升高、色谱图异常、重复性差及精密度降低等情况. 而增强型脂质去除净化材料(EMR-Lipid )是一种新型吸附剂,该产品结合了独特的体积排阻和疏水相互作用,可选择性去除样品中的主要脂类[11],且不会保留不需要的其他分析物,其适用于分散固相萃取(dSPE)步骤. 因而,EMR-Lipid dSPE和QuEChERS结合,提取净化处理会变得快捷高效.
地龙,锯蚓科动物参环毛蚓、通俗环毛蚓、威廉环毛蚓或栉盲环毛蚓的干燥体,是我国重要的中药材之一. 最早的中药学专著《神农本草经》中收载的67种动物药中就有蚯蚓,具有清热定惊、通络、平喘、利尿的功效[5,12]. 地龙在储存不当或因其他外界条件影响时,易受霉菌污染产生黄曲霉毒素,而服用黄曲霉毒素超标的地龙对人体的健康存在较大的危害,因此急需建立地龙药材中黄曲霉毒素的快速测定方法. 本文以QuEChERS萃取,EMR-Lipid dSPE 净化样品,建立了液质联用法测定中药材地龙中4种黄曲霉毒素的检测方法. 该方法去脂除杂效果良好,前处理过程简单、快捷,能够为检测中药材地龙的质量安全提供技术支撑.
1 试验部分
1. 1 仪器与试剂
1290-6460C超高效液相色谱-质谱联用仪:配有电喷雾离子源(美国安捷伦有限公司);分析天平(梅特勒);容量瓶(天玻仪器有限公司);涡旋混合器(美国Scientific);真空泵(天津市津腾实验设备有限公司);移液器:20、100 μL及1 mL(德国Eppendorf公司);离心机(德国Eppendorf公司);超声波清洗器(宁波新芝有限公司);超纯水(美国Millipore公司);乙腈(色谱纯,德国Merck公司);甲酸、乙酸铵(色谱纯,东京化成工业株式会社);氯化钠(国药集团化学试剂有限公司); 硫酸钠(国药集团化学试剂有限公司);乙二胺四乙酸(分析纯,国药集团化学试剂有限公司);EMR-Lipid分散固相萃取管(美国安捷伦有限公司).
对照品:黄曲霉毒素M1(批号:18377-004,纯度:100.0%)购自Bepure,混合标准溶液:黄曲霉毒素B1、B2、G1(批号:SSBG004,纯度:100.0%)购自FERMENTEK. 供试样品来源于市场购买的干燥地龙药材粉末.
1. 2 色谱条件
色谱柱:ACQUITY BEH C18柱(1.7 μm,2.1 mm×100 mm);进样量: 2 μL;柱温:35 ℃;流速:0.3 mL/min;流动相A:含0.1%甲酸-2 mmol/L乙酸铵的水溶液;流动相B:含0.1%甲酸的乙腈溶液,梯度洗脱:0~3 min,10%~30% B;3~5 min,30%~90% B;5~7 min,90% B;7~8 min,90%~10% B;8~9 min,10% B.
1. 3 质谱条件
离子源模式:电喷雾离子源正离子模式;监测模式:多反应监测模式(MRM);雾化气:N2;干燥气流速:8 L/min;喷雾电压:500 V;气流温度:325 ℃;毛细管电压:4 000 V;鞘气流速:12 L/min;鞘气温度:350 ℃. 质谱条件如表1所列.

表1 主要质谱参数Table 1 Main mass spectral parameters
1. 4 溶液制备
1. 4. 1 EDTA缓冲液配制
柠檬酸8.4 g,磷酸氢二钠7.1 g,Na2EDTA 19.5 g,溶于650 mL水中,超声溶解。
1. 4. 2 对照溶液制备
分别精密移取质量浓度为0.50 μg/mL的黄曲霉毒素M11.00 mL,质量浓度依次为0.51、0.50、0.51 μg/mL的黄曲霉毒素B1、B2、G1混合标准溶液 1.00 mL至10.00 mL棕色容量瓶,使用乙腈稀释,并定容至刻度,配制成M1、B1、B2、G1的质量浓度依次为50、51、50、51 ng/mL的混合标准中间溶液. 准确吸取上述混合标准中间溶液2.00 mL至5.00 mL棕色容量瓶中,使用乙腈稀释,并定容至刻度,配制质量浓度为 20 ng/mL的混合标准使用液,置4 ℃冷藏备用.
1. 4. 3 供试品溶液制备
提取:准确称取干燥样品1 g于50 mL离心管中,加入3 mL EDTA缓冲液和陶瓷均质子,涡旋1 min,准确加入10 mL乙腈,涡旋1 min,超声提取5 min,加入1 g 氯化钠和4 g 硫酸钠,充分涡旋2 min,5 000 r/min离心10 min,取上清液待净化.
净化:准确吸取上述上清液2.00 mL于 EMR-Lipid dSPE 净化管中,涡旋1 min,5 000 r/min离心10 min,取上层清液过0.22 μm滤膜至进样瓶中,上液质联用仪测定.
1. 4. 4 阴性样品溶液的制备
取未检出黄曲霉毒素的样品按照“1. 4. 3供试品溶液制备”步骤同法制成阴性样品溶液,即空白基质样品溶液.
2 结果与讨论
2. 1 前处理条件选择
动物源性中药材地龙主要富含蛋白质和脂类,因此,前处理主要是去除样品基质中的蛋白质和脂肪.常见去除蛋白质的方法是蛋白质沉淀,而蛋白质沉淀常见的是加盐层析,故在本研究中选择QuEChERS 盐包法.而EMR-Lipid分散固相萃取是一种新型增强型脂类去除手段,同时无需活化、清洗和洗脱等传统SPE步骤,简化了净化流程,节约了时间和成本,故本研究选择EMR-Lipid分散固相萃取管去除样品中的脂类成分.
由于4种黄曲霉毒素都在乙腈中具有良好的溶解性,另外,乙腈也能使蛋白质变性沉淀,因此以乙腈为提取溶剂. 为了使地龙干燥粉末样品在加入提取溶剂后具有良好的分散性,在加入乙腈之前,先加入3 mL EDTA缓冲盐溶液. 该缓冲盐溶液能够吸收地龙粉末样品中其他水溶性杂质,如糖类、维生素和无机盐等,在加入萃取盐包后,通过离心使水相和有机相分层,水相被吸附到盐中,同时,盐使蛋白质变性凝聚,通过离心从而有效去除杂质.
2. 2 色谱条件优化
由于黄曲霉毒素属于中等极性化合物,因此,选择了适用于各种分析物的ACQUITY BEH C18超高效色谱柱. 在流动相的选择和优化上,为了提高被分析物在电喷雾源正离子模式下的离子化效率,选择在水相和有机相中同时加入离子化剂甲酸. 为稳定水相和改善峰型,选择在水相中加入适宜浓度的乙酸铵. 最终本方法采用含有0.1%甲酸的乙腈溶液与含有0.1%甲酸-2 mmol乙酸铵的水溶液作为流动相.
2. 3 质谱条件优化
本研究选择将标准品直接注入质谱仪,在正离子模式下,进行Scan扫描,确定母离子,后进行SIM扫描,选取丰度比最高且相对稳定的两个碎片离子分别作为定性离子和定量离子,然后利用MassHunter采集软件,以手动和自动两种方式同时优化定性和定量离子、碰撞能量、裂解电压等参数,最后对影响离子化效率的毛细管电压、干燥器温度、鞘气温度、鞘气流量、雾化器压力等条件进行了优化,最终获得各化合物最佳的质谱条件.
2. 4 总离子流图及MRM
以MRM 模式监测4种黄曲霉毒素的定性和定量离子对,共有8个离子监测通道. 其标准品总离子流图如图 1所示.由图1可见,各个化合物峰形对称,每个检测通道无干扰,定量准确可靠.
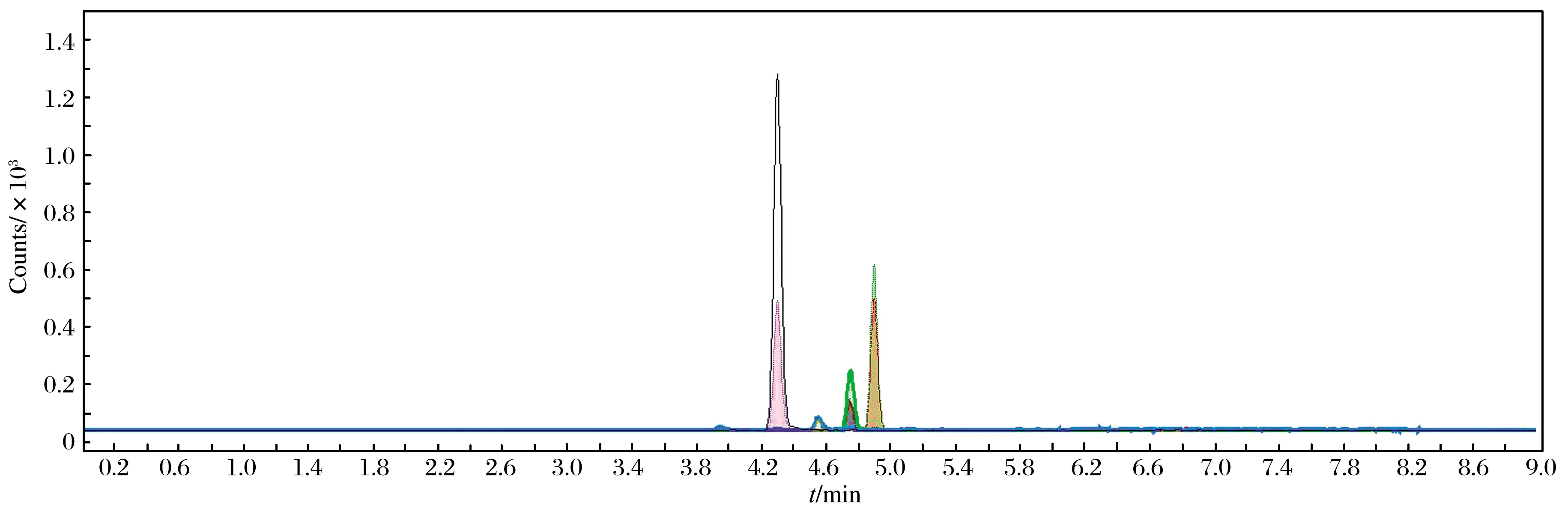
图1 黄曲霉毒素M1、B1、B2、G1标准品总离子流图Fig. 1 Total ion chromatograms of aflatoxin M1、B1、B2、G1
2. 5 线性关系、检出限及定量限
取混合标准使用液,使用空白基质样品溶液稀释配制成标准曲线溶液,得到质量浓度为0.00、0.02、0.04、0.10、0.20、0.40、0.80、1.20、1.60 ng/mL标准曲线点,外标法定量,以X轴为浓度,Y轴为峰面积的响应值,得到各个被分析物的线性回归方程,用于计算实际样品中待测物的浓度. 取阴性样品,混合标准使用溶液通过最小添加量,按“1. 4. 3”项下供试品溶液制备方法同法处理后上机进样,以3 倍信噪比计算各个被分析物的检出限(LOD ),以10 倍信噪比计算各个被分析物的定量限(LOQ ). 4种黄曲霉毒素的线性关系、检出限、定量限如表2所列. 结果显示,4种黄曲霉毒素在0.00~1.60 ng/mL范围内线性关系良好(R2>0.990 0),检出限范围为0.013~0.365 ng/g,定量限范围为0.044~0.913 ng/g.
2. 6 回收率及精密度考察
阴性样品中添加2、4、10 ng 3个水平的混合标准液,每个添加水平平行制备3份,按“1. 4. 3供试品溶液制备”进行处理,得到添加质量浓度分别为0.20、0.40、1.00 ng/mL的加标溶液,上机测试,结果如表2所列.由表2可见,4种被分析物的平均回收率为72.0%~113.0%,精密度为2.5%~3.3%.
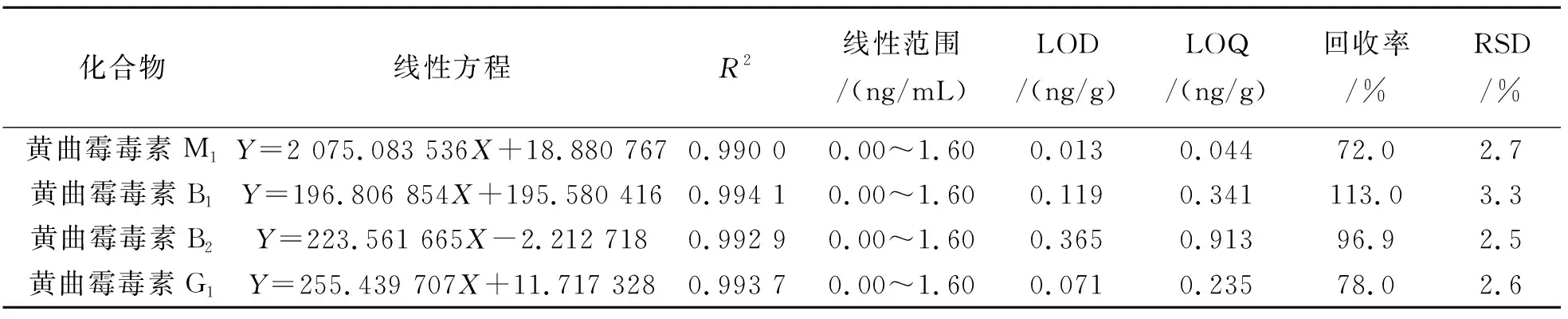
表2 4种黄曲霉毒素的线性关系、检出限、定量限、回收率、精密度Table 2 Linear relationships, LOD, LOQ, recoveries and precisions of 4 aflatoxins
2. 7 样品测定
实际测试样品购买于中药材流通市场,样品为干燥的地龙粉末,采用本研究方法测定10批地龙样品中的黄曲霉毒素,结果显示,测试样品中未检出上述4种黄曲霉毒素,部分测试样品的总离子流图如图2所示,测试样品信息如表3所列.
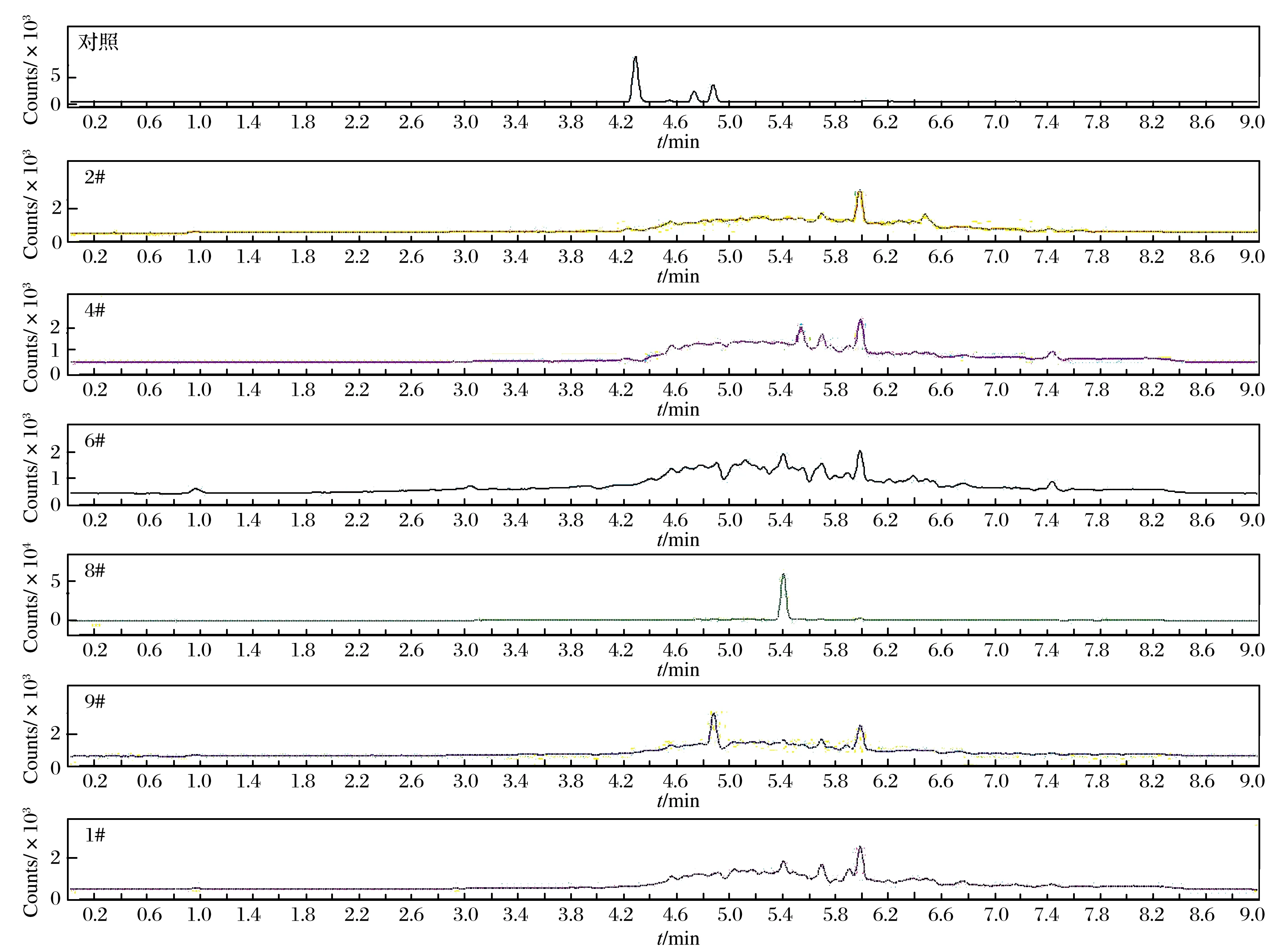
图2 测试样品总离子流图Fig. 2 Total ion chromatograms of test samples

表3 测试样品信息及测定结果Table 3 Information of test samples and determination results
3 结论
本文建立了一种基于QuEChERS和dSPE联用的前处理技术,结合超高效液相色谱-串联质谱同时测定动物源性中药材地龙中4种黄曲霉毒素. 方法学考察及实际样品检测证明,该方法去除基质效果良好,具有操作简单便捷、灵敏度高、适用性强等特点,同时节约了成本和时间,缩短了检测周期,能够满足对地龙中多种黄曲霉毒素的检测要求,适用于地龙中黄曲霉毒素的快速筛查.

