HIF-1α、IMA水平对射血分数正常的心力衰竭患者的预后评估价值
龚倩,罗彩东,黎东,李郁
射血分数正常心力衰竭也称舒张性心力衰竭,是临床常见的心力衰竭类型,占所有心力衰竭(心衰)患者的50%以上。研究显示,射血分数正常心衰患者病死率高于或等于射血分数减少心衰患者[1]。因而,对射血分数正常心衰患者预后进行研究成为临床上的热点。心肌受到损伤后缺血修饰白蛋白(IMA)会被很快释放入血液,IMA成为临床上诊断心肌损伤较为敏感的标志物。有文献报告[2]IMA水平在心肌缺血时快速升高,且随缺血时间的增加,IMA水平持续升高。吴明等[3]研究发现心衰患者经治疗后IMA水平明显降低。缺氧诱导因子-1α(HIF-1α)是调节细胞内氧代谢的重要氧平衡调节因子[4]。有文献报告[5]在缺血性心脏病导致的心衰中,HIF-1α水平增加。目前有关HIF-1α、IMA水平与射血分数正常的心衰患者预后关系的报道较少,本研究拟探讨两者在射血分数正常的心衰患者中的预后评估价值,旨在为早期预估患者预后提供依据,以便及时调整治疗方案。
1 资料与方法
1.1 研究对象与分组 选取2018年6月~2019年12月于四川省绵阳市中心医院心血管内科收治的心衰患者92例为研究对象(心力衰竭组),其中男性53例,女性39例,年龄50~72(61.53±5.92)岁。纳入标准:符合心衰的诊断标准[6];超声心动图提示左室射血分数(LVEF)>50%;配合随访完成本试验者;同意签署知情同意书和临床研究协议书。排除标准:有先天性心脏疾病患者;合并有严重感染性疾病、自身免疫性疾病患者;有严重心律失常患者(心动过速或室颤)患者;合并严重肝、肾功能障碍患者。根据美国纽约心脏疾病学会(NYHA)心功能分级为Ⅱ~Ⅳ级[7],Ⅱ级34例,Ⅲ级30例,Ⅳ级28例。选择同期在本院体检的健康者40例为对照组,其中男性22例,女性18例,年龄50~72(62.18±6.05)岁。本研究通过我院伦理委员会批准。
1.2 方法 所有研究对象清晨空腹时采静脉血5 ml,静置15 min后,4℃,3000 r/min,离心15 min,留取上清液,冻存于-80℃冰箱中待测。采用酶联免疫吸附(ELISA)法检测血清中HIF-1α、IMA水平,操作步骤严格依据HIF-1α ELISA试剂盒说明书(货号CSB-E12112h,武汉华美生物工程有限公司)、IMA ELISA试剂盒(货号SHR10322,南京赛泓瑞生物科技有限公司)进行操作。
对所有射血分数正常的心衰患者采用定期门诊和电话随访的方式随访6个月,详细记录心血管事件发生情况,包括心脏性死亡,卒中、反复性心绞痛住院、严重心律失常、心衰住院等。
1.3 统计学分析 所有数据均采用SPSS 25.0统计学软件分析。计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验,多组间均数的比较采用单因素方差分析,组间比较采用SNK-q检验;计数资料采用例数(构成比)表示,组间比较采用χ2检验或Fisher精确检验。采用受试者工作特征曲线(ROC)分析血清HIF-1α、IMA及二者联合对射血分数正常的心衰患者不良预后的预测价值,并对比曲线下面积(AUC);采用COX法分析影响心衰患者不良预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1 不同心功能心衰患者及对照组血清HIF-1α、IMA水平比较 与对照组相比,Ⅱ级、Ⅲ级、Ⅳ级患者血清HIF-1α、IMA水平较高(P<0.05);与Ⅱ级患者相比,Ⅲ级、Ⅳ级患者血清HIF-1α、IMA水平较高(P<0.05);与Ⅲ级患者相比,Ⅳ级患者血清HIF-1α、IMA水平较高(P<0.05,表1)。
2.2 预后不良与预后良好心衰患者的一般资料比较 随访射血分数正常的心衰患者6个月时间内不良心血管事件的发生情况,分为预后良好组(54例)和预后不良组(38例)。预后不良与预后良好心衰患者在性别、年龄、体质指数(BMI)、合并糖尿病、高血压、冠心病比例上差异均无统计学意义(P均>0.05,表2)。
2.3 预后不良与预后良好心衰患者血清HIF-1α、IMA水平比较 与预后良好组相比,预后不良组患者血清HIF-1α、IMA水平较高(P<0.05,表3)。
2.4 分析血清HIF-1α、IMA及二者联合对射血分数正常的心衰患者不良预后的预测价值 ROC结果显示,HIF-1α、IMA水平诊断射血分数正常的心衰患者不良预后的AUC分别为0.846、0.825,灵敏度分别为81.60%、84.20%,特异度分别为70.40%、68.50%。截断值分别为1613.40 ng/ml、82.68 U/ml,二者联合对射血分数正常的心衰患者不良预后AUC为0.924,灵敏度为88.90%,特异度为78.90%(图1)。
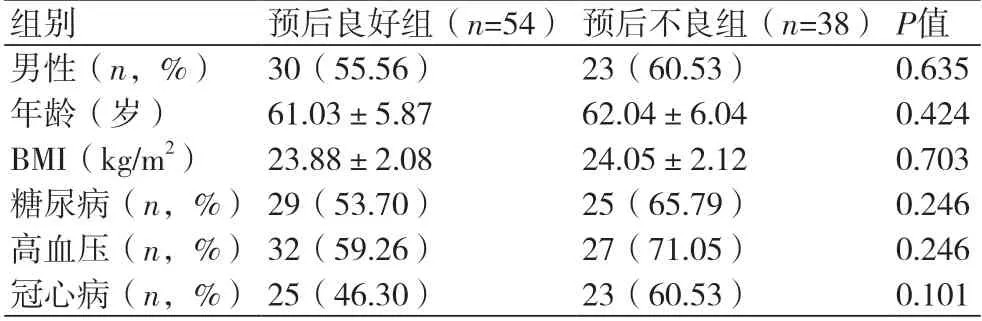
表2 预后不良与预后良好心力衰竭患者一般资料比较

表3 预后不良与预后良好心衰患者血清HIF-1α、IMA水平比较
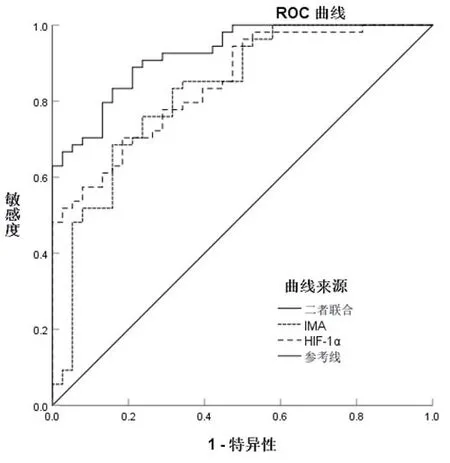
图1 血清HIF-1α、IMA及二者联合检测对射血分数正常的心衰患者不良预后的预测曲线图
2.5 影响射血分数正常的心衰患者不良预后的COX分析 单因素COX分析显示,HIF-1α、IMA均是影响射血分数正常的心衰患者预后的危险因素;多因素COX分析显示,高水平HIF-1α(HR=2.313,95%CI:1.534~3.487,P<0.01)、高水平IMA(HR=1.608,95%CI:1.628~3.629,P<0.01)是影响射血分数正常的心衰患者不良预后的独立危险因素(表4)。
3 讨论
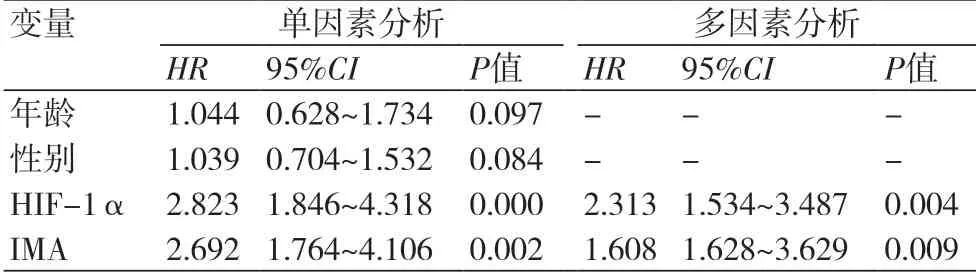
表4 影响射血分数正常的心衰患者不良预后的COX分析
心衰是心脏损害引起的心肌排血量减少,从而诱发循坏系统功能不全,影响全身代谢的综合征[8]。心衰在老年人群中更易高发,且易并发房颤、猝死等并发症,威胁患者生命安全,因此,尽早评估预后,及时调整治疗方案。
心衰的主要病理生理改变是心室重构和心肌纤维化,心室重构可使心肌细胞出现缺氧。心肌细胞缺氧可诱导心肌内皮细胞调亡,导致心脏疾病发生[9]。HIF是介导细胞缺氧反应时一种核转录调节因子,具有高度保守的特性。HIF具有HIF-1、HIF-2、HIF-3三种亚型。HIF-1α在组织缺氧反应中起到关键作用,在常氧条件下HIF-1α可被羟基化从而发生快速降解,当组织器官出现缺血缺氧表现时,HIF-1α由于降解过程发生障碍其水平显著增加。本研究发现HIF-1α在不同心功能分级(Ⅱ、Ⅲ、Ⅳ级)心衰患者血清中水平依次显著增加,提示HIF-1α可能与心衰严重程度有关。研究发现[10],心衰患者HIF-1α表达的增加,可募集M1巨噬细胞介导相关炎症反应,如释放IL-6、TNF-α和IL-1β,增加血小板反应蛋白等表达,炎症反应可加速心肌纤维化,损害心脏舒张功能。猜测HIF-1α可能通过影响患者机体炎症反应从而影响心衰患者病情。本研究还发现,预后不良组患者血清HIF-1α水平显著高于预后良好组患者,提示HIF-1α水平变化可反应心衰患者预后情况。ROC结果显示,HIF-1α水平诊断射血分数正常的心衰患者不良预后的AUC为0.846,灵敏度为81.60%,特异度为70.40%,提示血清HIF-1α水平变化在临床上可能对评估射血分数正常的心衰患者不良预后具有一定的参考价值。
IMA是在肝脏中合成的血清白蛋白,由585个氨基酸合成,是由血清白蛋白流经缺血组织时产生,有研究报告当心肌细胞缺血时,组织局部发生反应性变化,血清白蛋白N-末端结构发生改变而形成IMA[11]。由于心衰患者的心肌细胞血流灌注不足,导致心肌细胞出现缺氧现象,心肌细胞对缺血缺氧高度敏感,此时启动脂肪酸供能方式,促使IMA进入血液中,血液中IMA水平升高[12]。IMA在心肌损伤的早期缺血发生6~10 min内,其水平可发生明显变化,且持续数小时[13]。Ellidag等[14]研究发现IMA在慢性心衰患者中血清中水平明显高于健康者,说明IMA可能与慢性心衰患者心肌缺血有关。本研究发现IMA在不同心功能分级(Ⅱ、Ⅲ、Ⅳ级)心衰患者血清中水平依次显著增加,提示IMA可能与心衰病情加重有关。马裕斌等[15]对肺炎合并心衰患儿随访6个月后发现,发生死亡及心律失常患儿IMA水平较预后良好患儿高。本研究发现预后不良组患者血清IMA水平显著高于预后良好组患者,提示IMA水平与心衰患者预后情况有关。ROC结果显示,IMA水平诊断射血分数正常的心衰患者不良预后的AUC为0.825,灵敏度为84.20%,特异度为68.50%,IMA、HIF-1α联合对射血分数正常的心衰患者不良预后AUC为0.924,灵敏度为88.90%,特异度为78.90%,HIF-1α、IMA联合时灵敏度和特异度均高于二者单独检测时,提示血清IMA水平变化对诊断心衰患者不良预后在临床上具有一定的指导作用,二者联合时对评估患者不良预后可能效果更好。进一步COX分析显示,高水平HIF-1α、高水平IMA是影响射血分数正常的心衰患者不良预后的独立危险因素,提示在临床上应多监测患者HIF-1α、IMA水平,及早评估患者预后以及时调整治疗方案。
综上所述,血清HIF-1α、IMA水平在射血分数正常的心衰患者中随病情严重程度增加而显著增加,且在心衰不良预后患者中呈高表达,临床上对射血分数正常的心衰患者不良预后评估具有一定指导作用。本研究不足之处在于:尚未深入探讨HIF-1α、IMA如何影响射血分数正常的心衰患者不良预后的发生,有待后期深入分析。

