MicroRNA-29a调控心房颤动模型大鼠心房肌细胞凋亡的机制研究
朱丹,杨良瑞,应佐华
心房颤动(房颤,AF)是临床常见的心律失常之一,其发病率呈明显上升趋势[1]。近年来,随着对房颤基础理论及相关临床实践研究的不断深入,观察到心房电重构会引起有效不应期的缩短、延长或不协调,而结构的重构会引起电信号在心房内传导不及时,继而引起心房收缩功能障碍[2]。MicroRNA(miRNA)是近年来发现的一类高度保守的、可在转录后水平调节基因表达的非编码小分子RNA[3]。既往研究发现,microRNA参与细胞的增殖、分化及凋亡等多种信号过程[4]。新近研究表明,心肌细胞具有特异性的miRNA表达谱,且miRNA与心肌细胞的衰老及凋亡的发生、发展密切相关。miRNA在心肌细胞的生长发育以及多种心血管疾病特别是心律失常中发生发展中扮演着重要的角色[5,6]。在房颤的发生发展过程中,对于相关miRNA参与心肌细胞凋亡过程的机制研究也愈来愈重要。探寻miRNA参与及调控房颤患者心肌细胞凋亡的过程以及其作用机制,将为广大患者带来新颖和有效的治疗理念及方法。因此,本文就miR-29a对房颤模型大鼠心房肌细胞凋亡的作用及机制进行相关研究,现报告如下。
1 材料及方法
1.1 实验材料 6~8周SPF级SD大鼠25只,体重200~220 g,由杭州市动物实验中心提供[动物细胞质量合格证号:SCDK(湘)2019-0027]。采用乙酞胆碱-氯化钙(ACH-CaCl2)混合液尾静脉注射法对20只SD大鼠连续给药4周制作房颤动物模型(模型组),另5只常规饲养作为阴性对照组[7]。停药后记录大鼠的心电图,模型组大鼠出现P波消失,代替为小f波,频率在350~600 次/min的典型房颤心电图则表示大鼠房颤造模成功(图1)。所有大鼠采用尾静脉空气栓塞方式处死,取其心脏组织用于实验室提取和培养原代心房肌细胞,以供后续实验使用。MTT试剂盒(上海碧云天生物有限公司);Annexin-Ⅴ凋亡检测试剂盒(美国Sigma公司);SP600125(美国Sigma公司);Western Blotting 试剂盒(上海碧云天生物有限公司);BCA蛋白测定试剂盒(中国杭州四季青有限公司);其他试剂均由长沙塞维尔生物公司提供。
1.2 大鼠心肌细胞的培养、分组和转染 采用尾静脉空气栓塞方式处死大鼠,在无菌操作台上,分别取模型组及阴性对照组大鼠心脏置于培养皿中,加入适量PBS漂洗,清洗后取大鼠心房部位。剪碎成1~3 mm3的小块。向培养皿中加入0.1%的Ⅱ型胶原酶和0.1%的胰蛋白酶混合液,37℃恒温箱中消化25 min。将消化好的悬液置于15 ml离心管中1500 rpm/min低速离心10 min,去上清液获得原代心房肌细胞。将获得的原代心房肌细胞进行培养。细胞分组与处理方法如下:①阴性对照组:取对照组大鼠的原代心房肌细胞不加任何药物处理;②模型组:模型组大鼠原代心房肌细胞,不加任何药物处理;③miR-29a inhibitor组:给予大鼠的原代心房肌细胞转染终浓度为50 nmol/L的miR-29a inhibitor,具体转染方法依照转染试剂盒操作说明进行;④SP600125组:给予大鼠的原代心房肌细胞加入20 mmol/L的JNK抑制剂(SP600125);⑤SP600125+miR-29a inhibitor组:给予大鼠的原代心房肌细胞转染50 nmol/L的miR-29a inhibitor,并加入20 mmol/L的SP600125。此外,5组细胞均置于37℃,5%二氧化碳恒温培养箱中培养48 h。
1.3 MTT和Annexin-Ⅴ凋亡检测实验 各组细胞培养后,按照MTT试剂盒和Annexin-Ⅴ凋亡检测试剂盒分别检测细胞活力和细胞的凋亡情况。
1.4 Western blotting 各组细胞培养后,采用预冷的PBS溶液清洗3次,采用Western blot试剂盒对原代培养心房肌细胞进行蛋白定量分析。
1.5 统计学处理 采用SPSS 22.0统计学软件进行数据处理。所有实验数据均以均数±标准差表示,组间比较采用配对t检验。P<0.05为差异具有统计学意义。
2 结果
2.1 沉默miR-29a对房颤大鼠心房肌细胞凋亡及细胞活力的影响 将miR-29a inhibitor转染房颤大鼠心房肌细胞中作用48 h后,通过Annexin-Ⅴ/PI染色检测细胞凋亡情况,研究发现,与阴性对照组相比,模型组细胞凋亡明显上升;与模型组相比,miR-29a inhibitor组细胞凋亡明显下降(图2A)。采用MTT方法检测细胞活力,结果显示,与阴性对照组相比,模型组的细胞活力明显下降,与模型组相比,miR-29a inhibitor组细胞活力明显提高(图2B)。检测凋亡相关蛋白Bcl-2、Bax的表达,结果发现,与阴性对照组相比,模型组的Bcl-2蛋白的表达显著下降,Bax蛋白的表达显著上升(P<0.05,图3A),与模型组相比,miR-29a inhibitor组Bcl-2蛋白的表达显著升高,Bax蛋白的表达显著下降(P<0.05,图3B)。
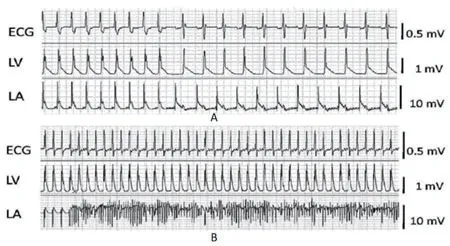
图1 正常大鼠及房颤大鼠心电图(A为正常大鼠心电图,B为房颤模型组大鼠心电图)

图2 miR-29a inhibitor对房颤大鼠心房肌细胞凋亡的影响

图3 miR-29a inhibitor对房颤大鼠心房肌细胞凋亡蛋白的影响
2.2 抑制JNK信号对房颤大鼠心房肌细胞凋亡及细胞活力的影响 将SP600125J(NK抑制剂)转染房颤大鼠心房肌细胞中作用48 h后,通过Annexin-Ⅴ/PI染色检测细胞凋亡,发现通过转染SP600125抑制JNK后,与阴性对照组相比,模型组细胞凋亡明显上升;与模型组相比,SP600125组细胞凋亡明显下降(图4A)。采用MTT方法检测细胞活力,结果显示,与阴性对照组相比,模型组细胞活力明显下降;与模型组相比,SP600125组细胞活力显著上升(图4B)。检测凋亡相关蛋白Bcl-2、Bax的表达,结果发现,与阴性对照组相比,模型组细胞的Bcl-2蛋白的表达显著下降(P<0.05,图5A),Bax蛋白的表达显著升高(P<0.05,图5B);与模型组相比,SP600125组细胞的Bcl-2蛋白的表达显著升高(P<0.05,图5A),而Bax蛋白的表达显著下降(P<0.05,图5B)。
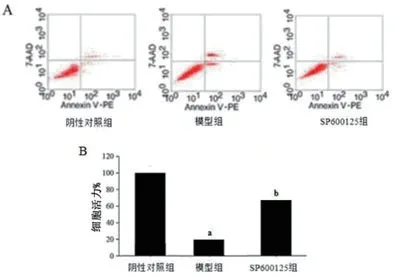
图4 SP600125对房颤大鼠心房肌细胞凋亡的影响
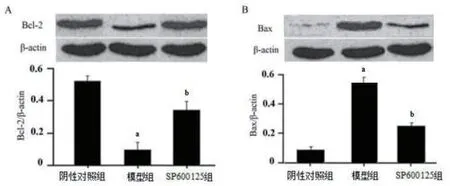
图5 SP600125对房颤大鼠心房肌细胞凋亡蛋白的影响
2.3 房颤大鼠心房肌细胞凋亡机制 与阴性对照组相比,模型组p-JNK表达显著上升(图6);与模型组相比,miR-29a inhibitor组、SP600125组和SP600125+miR-29a inhibitor 组的心房肌细胞p-JNK蛋白的表达均明显下降(图6)。以上结果表明miR-29a可能通过抑制JNK信号通路进而抑制房颤大鼠心房肌细胞的凋亡。

图6 房颤大鼠心房肌细胞p-JNK表达
3 讨论
目前,临床上对于房颤患者的治疗方法还是以药物转复、射频消融术等方法为主,或者另外以控制心室率及抗凝药物以及左心耳封堵预防血栓栓塞为主[8]。房颤经射频消融术最主要的并发症仍然是术后复发房颤,然而保守治疗除了一方面需要长期口服抗凝药物,另一方面是需患者有极高的依从性[9-11]。尽管目前抗凝治疗的方法能有效预防房颤后脑卒中的发生,但我国房颤患者的抗凝药物使用率仍然不理想[12]。最近研究表明,以microRNA为治疗靶点的治疗方式可成为治疗房颤的新策略[13]。大量研究表明miR-29a在成熟组织中表达,尤其是心脏、肾脏和肺组织中表达明显[14]。
MicroRNAs(miRNAs)是一种短序列的非编码RNA,可以特异性与靶向mRNA结合,通过降解或者抑制蛋白质的翻译来发挥调控的功能。在哺乳动物中,这些小的非编码RNAs参与了生物体的生长、发育、衰老及死亡的调控[15]。因此,miRNAs肯定也参与了房颤患者心房肌细胞凋亡的发生发展过程,且已被大量研究所证实[16,17]。近年来,miRNA调控机体细胞生理以及参与各种疾病的机制得到快速的发展。如miR-375在T2DM中通过调节胰岛素的分泌发挥重要的作用[16]。相关研究发现房颤患者心肌细胞中包括miR-29a在内的miRNAs的表达水平降低,且与心肌细胞凋亡的程度呈负相关[17]。研究证实过表达miR-29a对大鼠心肌细胞的凋亡有抑制作用,但对于miR-29a在房颤模型大鼠的心房肌细胞凋亡的作用机制,未见有详细报道。本实验通过对房颤模型大鼠的心房肌细胞转染miR-29a inhibitor后,进行细胞活力的检测,发现细胞活力显著上升,且抗凋亡相关蛋白Bcl-2表达量也明显上升(P<0.05),相反Bax凋亡相关蛋白表达量呈现下降趋势(P<0.05)。结果说明抑制miR-29a的表达可拮抗房颤模型大鼠的心房肌细胞细胞凋亡的发生发展。
早期大量研究报道,JNK信号通路可被多种细胞因子(如TNF-α、IL-6、EGF等)、应激(如紫外线、电离辐射、氧化应激等)以及某些G蛋白偶联受体激活,参与机体组织细胞的凋亡与坏死。当 JNK被不同的刺激因子激活后,其转移至细胞核内,激活其下游作用底物-核内转录因子(c-Jun),并磷酸化形成有活性的p-JNK,而这些被磷酸化后有活性的p-JNK进而导致细胞凋亡和分化。本实验通过对房颤模型大鼠的心房肌细胞转染SP600125(JNK抑制剂)后,JNK信号被抑制,通过检测细胞活力,发现细胞活力明显增高,且抗凋亡相关蛋白Bcl-2表达量上升明显(P<0.05),凋亡相关蛋白Bax的表达量呈现下降趋势(P<0.05)。结果说明,拮抗JNK信号的表达对房颤模型大鼠的心房肌细胞凋亡的发生发展具有一定的抑制作用。进一步说明JNK信号通路参与了miR-29a对房颤模型大鼠的心房肌细胞凋亡过程的调控,即抑制JNK信号通路可对房颤模型大鼠心房肌细胞的凋亡起抑制作用。
综上所述,阻断miR-29a具有抑制房颤模型大鼠心房肌细胞凋亡的作用,其作用机制可能通过JNK信号通路来抑制房颤大鼠模型的心房肌细胞的凋亡。

