类风湿关节炎患者血清HMGB1与疾病活动性、炎性因子及临床指标的相关性研究
王丹,黄健,陈彩霞,李策力格,刘伟
(1.内蒙古医科大学附属医院 老年病区,呼和浩特 010010;2.内蒙古医科大学第二附属医院 关节外科,呼和浩特 010030;3.内蒙古医科大学 临床医学研究中心,呼和浩特 010010)
RA是一种以关节病变为主要表现的累及全身多系统的慢性、非特异性、炎症性疾病,其关节病变呈进行性发展,不可逆性加重[1-2]。RA好发于中年人群,女性发病多于男性,发病机制尚不十分清楚,其基本病理表现为关节滑膜炎症浸润[3-4]。高迁移率族蛋白1(high mobility group box protein 1,HMGB1)作为一种潜在的炎症诱导因素与多种自身免疫性疾病相关,目前已有研究发现其与RA的发生、发展相关[5]。本研究通过检测RA患者血清HMGB1的水平,分析其与RA疾病活动性、炎性因子及临床检查指标的相关性,探讨HMGB1在RA病情发展演变中的作用。
1 资料与方法
1.1 研究对象及分组选取2017年12月至2018年6月于内蒙古医科大学第二附属医院关节外科住院治疗的RA患者60例纳入研究,其中男性49例、女性11例,年龄(49±8)岁,RA患者中活动期(急性期)组患者30例,非活动期(缓解期)组患者30例,疾病诊断与疾病分期标准符合2010年版美国风湿病学会/欧洲抗风湿病联盟的RA分类标准。健康对照组来源于同期内蒙古医科大学附属医院保健体检中心的健康体检者30例,均为随机纳入,其中男性24例、女性6例,年龄(50±11)岁。2组间性别及年龄构成差异无统计学意义(P>0.05)。排除标准:于纳入研究前6周内有影响免疫功能的药物服用史者,如服用激素者、服用免疫抑制剂者;于纳入研究前4周内有感染病史者。本研究中临床血液样本的采集均经医院伦理委员会批准且患者及家属签署了知情同意书。
1.2 试剂与仪器HMGB1 ELISA试剂盒(日本SHINO-TEST公司);IL-6、IL-8、基质金属蛋白酶3(matrix metalloproteinase 3,MMP-3)ELISA试剂盒(英国Abcam 公司);NEO HTS型全功能微孔板检测仪(美国Synergy公司);MONITOR-20自动标准化血沉仪(意大利Vital公司);ARCHITECT c4000全自动分析仪(美国Abbott公司)。
1.3 方法采集并记录纳入研究的RA患者及健康对照者的相关病史。抽取研究对象晨起空腹肘正中静脉血3~4 mL,以1 000×g离心10 min,取上清液于-20 ℃保存待测。所有研究对象的血清样本于其入院后1周内采集完毕。使用定量HMGB1 ELISA试剂盒测定血清HMGB1水平,NEO HTS型全功能微孔板检测仪读取光密度[D(450 nm)],通过绘制标准曲线间接计算HMGB1的含量。使用定量ELISA试剂盒测定血清IL-6、IL-8及MMP-3水平,NEO HTS型全功能微孔板检测仪检测D(450 nm),通过绘制标准曲线计算IL-6、IL-8及MMP-3的含量。血清ESR的测定采用红外线障碍法,仪器使用MONITOR-20自动标准化血沉仪。血清CRP、RF的测定采用免疫比浊法,仪器使用ARCHITECT c4000全自动分析仪。

2 结果
2.1 血清HMGB1表达水平与RA疾病活动性的相关性活动期组RA患者血清HMGB1表达水平[(10.13±1.45)ng/mL]显著高于非活动期组[(8.00±1.46) ng/mL]和健康对照组[(7.68±1.61)ng/mL](均P<0.01);非活动期组RA患者HMGB1水平略高于健康对照组,但2组间差异无统计学意义(P>0.05)。经Spearman相关性分析,血清HMGB1表达水平与RA疾病活动性呈正相关(r=0.547,P<0.05)。
2.2 血清IL-6、IL-8、MMP-3、ESR、CRP、RF表达水平与RA疾病活动性的相关性活动期组及非活动期组RA患者血清IL-6、IL-8、MMP-3、ESR、CRP、RF表达水平均高于健康对照组,且活动期组高于非活动期组,3组间比较,差异有统计学意义(P<0.05)(表1)。经Spearman相关性分析,血清IL-6、IL-8、MMP-3、ESR、CRP、RF表达水平与RA疾病活动性呈正相关(r值分别为0.938、0.939、0.916、0.915、0.907、0.927,均P<0.05)。
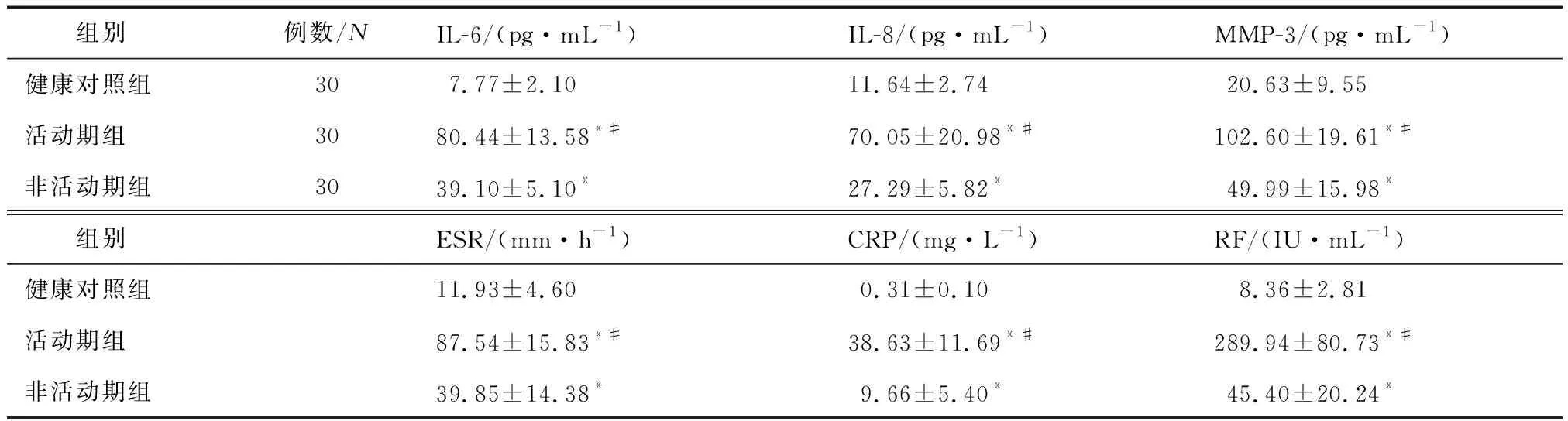
表1 各组血清IL-6、IL-8、MMP-3、ESR、CRP、RF表达水平的比较
2.3 血清HMGB1水平与IL-6、IL-8、MMP-3、ESR、CRP及RF表达水平的相关性经Spearman相关性分析,RA患者血清HMGB1水平与IL-6、IL-8、MMP-3、ESR、CRP、RF表达水平均呈正相关(r值分别为0.539、0.558、0.550、0.515、0.509、0.518,均P<0.05)。
3 讨论
HMGBl最初在20世纪60年代由Johns发现,因其在Western blotting的SDS-PAGE中迁移率高而得名,是一种在大多数真核细胞中广泛表达、高度保守的非组蛋白核蛋白,存在于细胞内及细胞外[5-6]。细胞内的HMGB1主要参与DNA的复制、转录、修复,类固醇激素调控和细胞分化成熟[7];细胞外的HMGB1可与内、外源性促炎因子结合形成复合物,以协同刺激的方式在炎症反应中起重要作用[8-9]。因此,HMGB1的异常表达对于相关疾病病情的发展及演变具有重要意义。相关研究证实,RA患者滑膜液中HMGB1的表达水平升高,但目前国内外学术界对于RA患者血清HMGB1的异常表达与否尚存争议[10]。早期有学者对30例RA患者的样本进行了研究,结果显示,RA患者血清HMGB1水平与正常对照组比较,差异无统计学意义(P>0.05)[11]。但另有相关研究对67例活动期RA患者和21例健康对照者进行了检测,结果显示,活动期RA患者血清HMGB1水平明显升高,与健康对照组比较,差异具有统计学意义(P<0.05)[12]。还有一项研究纳入105例样本,结果显示,RA患者血清HMGB1水平明显高于健康对照组,其活动期表达水平明显高于非活动期(P<0.05)[13]。本研究发现,活动期组RA患者血清HMGB1水平显著高于非活动期组和健康对照组(均P<0.05),非活动期组RA患者血清HMGB1水平与健康对照组比较,差异无统计学意义(P>0.05)。研究间差异可能与样本量及检测手段不同有关,但本研究及多数国内研究结果表明,活动期组RA患者血清HMGB1表达水平较非活动期组及健康对照组显著上调。这提示HMGB1在RA的疾病发展演变过程中发挥重要作用,其在血清中的表达水平与RA疾病活动性呈正相关,也为通过血清HMGB1水平反应临床RA活动性的设想提供了理论依据。
IL-6是关节疾病中研究得最多的炎性因子,其参与了多种自身免疫性疾病的病程。IL-6在病理情况下可通过多种分泌形式在全身发挥致病效应。研究显示,IL-6可刺激滑膜成纤维细胞和软骨细胞合成并分泌前列腺素E2(prostaglandin E2,PGE2)及胶原酶,作用于关节软骨及骨组织,引起并加重关节损伤[14]。IL-8又称趋化因子CXCL8,可募集并激活中性粒细胞,引起局部或全身的炎症反应。研究显示,IL-8可由RF刺激形成,其作用于关节滑膜组织引起滑膜炎性增生,且在关节滑膜慢性炎症的维持中起重要作用[1]。MMP为基质金属蛋白酶家族,是引起细胞外基质破坏的主要因素,参与组织侵蚀破坏性疾病的致病过程。其中胶原酶特异性地水解胶原蛋白,明胶酶参与分解明胶和基底膜胶原,基质溶解素在细胞基质的广泛水解中发挥重要作用[1]。研究证实,MMP-3通过细胞外基质的降解作用参与关节软骨、骨组织的侵蚀及血管翳形成过程中微血管基底膜和间质的破坏,从而引起关节软骨及骨组织不可逆性损伤[15]。ESR、CRP、RF是类风湿活动性及病程进展的关键临床指标,在指导临床用药及相关治疗中具有一定的参考作用。本研究结果显示,RA患者血清IL-6、IL-8、MMP-3、ESR、CRP及RF水平高于健康对照组,且活动期组高于非活动期组(均P<0.05);血清IL-6、IL-8、MMP-3、ESR、CRP、RF水平与RA疾病活动性呈正相关。由此说明,血清IL-6、IL-8、MMP-3的表达水平与RA的疾病发展演变过程密切相关,ESR、CRP、RF是临床监测RA活动性及病情变化的可靠指标。
在RA致病过程中,血清HMGB1表达水平与RA活动性高度相关。同时,血清相关促炎因子IL-6、IL-8、MMP-3及临床指标ESR、CRP、RF与RA活动性呈正相关。本研究结果显示,RA患者HMGB1表达水平与IL-6、IL-8、MMP-3、ESR、CRP、RF均呈正相关。由此推测,血清HMGB1与促炎因子IL-6、IL-8、MMP-3具有内在相关性,在RA病情演变过程中可能会促使滑膜慢性炎症反应的长期持续并加重,但他们相互作用的具体机制尚不清楚,有待于进一步探究。目前,很多学者尝试采取措施拮抗HMGB1及IL-6、IL-8、MMP-3以控制RA病情的发展及关节进行性损伤,已取得一定进展。随着后续动物实验及临床试验的进行,相信HMGB1及IL-6、IL-8、MMP-3可能成为RA治疗的新靶点。

