皮下免疫锚定蛋白Z抵抗小鼠肺炎链球菌感染的作用研究
刘德军,楚亚菲,李慧,赵静
(河南省人民医院 检验科,郑州 450003)
肺炎链球菌是一种普遍存在的传人病原体,肺炎链球菌性肺炎在世界范围内具有较高的发病率和死亡率。同时,它被认为是社区获得性肺炎和细菌性脑膜炎的最常见病因,也是中耳炎、鼻窦炎和支气管炎的主要原因[1]。据估计,全世界每年有近100万儿童死于肺炎链球菌感染。在疫苗使用率较高的国家, 肺炎球菌结合疫苗(pneumococcal conjugate vaccine, PCV)使覆盖地区的肺炎链球菌血清型相关侵袭性肺炎球菌病的发病急剧减少,并在接种肺炎链球菌疫苗的个体中诱导了显著的群体保护[2]。然而,疫苗诱导的肺炎链球菌免疫压力和自然遗传转化导致了全球范围内的血清型替换现象,致使由目前使用的肺炎链球菌疫苗不覆盖血清型引起的侵袭性肺炎链球菌病患者数迅速增加[3]。
用保守的肺炎链球菌表面蛋白代替多糖作为疫苗是一种很有前途的方法[4]。许多保守的肺炎链球菌表面蛋白在临床前和临床试验中都被研究过,比如肺炎链球菌胆碱结合蛋白A、基因编辑去除毒性的肺炎溶菌素、化学方法去除毒性的肺炎链球菌溶血素,以及肺炎链球菌组氨酸三联体D和E,它们均是近年来的研究热点,并被纳入多组分蛋白疫苗制剂[5]。为了进一步推进肺炎链球菌蛋白疫苗的迭代和临床效果改善,筛选出更多的疫苗候选蛋白是必要的。
锚定蛋白Z(midcell anchored protein Z, MapZ)是肺炎链球菌二分裂时的细胞赤道面分子信标。肺炎链球菌分裂时,MapZ在细胞赤道处形成环状结构,并随着细胞拉长而分开,形成分裂位点的永久信标[6]。二分裂是细菌最常见的分裂方式,演变过程中细菌进化出不同的机制以筛选分裂位点。MapZ和丝氨酸/苏氨酸蛋白激酶STK组成的系统是肺炎链球菌细胞分裂位点选择和形态发生的关键靶点[7-8]。在肺炎链球菌中,Z环在分裂位点的定位是通过双位膜蛋白MapZ和Ftsz间的直接相互作用介导的。它不仅可以标记Ftsz的分裂位点和位置,还可以控制Z环闭合。MapZ的缺失会导致肺炎链球菌的二分裂障碍,影响细菌增殖[9]。同时,之前的研究表明,这种调节机制在许多种类细菌中普遍存在,且肺炎链球菌中的MapZ具有较高的保守性[10]。鉴于MapZ在肺炎链球菌分裂增殖中的关键作用以及其较高的保守性,其具备成为肺炎链球菌候选蛋白疫苗的潜质。因此,研究将验证皮下免疫MapZ对感染肺炎链球菌小鼠的保护作用,以筛选出更有效的肺炎链球菌候选蛋白疫苗。
1 材料与方法
1.1 实验材料
1.1.1 实验菌株 肺炎链球菌标准菌株D39(NCTC 7466,血清型2型),购自欧洲标准菌库中心;肺炎链球菌标准菌株TIGR4(血清型4型),购自美国菌种保藏中心;肺炎链球菌CMCC31436(血清型3型)、CMCC31207(血清型6B型)、CMCC31614(血清型14型)及CMCC31693(血清型19F型),购自中国药品生物制品检定所医学菌种保藏中心。非小细胞肺癌细胞株A549、大肠埃希菌BL21(DE3)、DH5α和pET-28a(+)载体由科室实验室保存。
1.1.2 实验动物 6~8周龄健康雌性C57BL/6小鼠,体质量(18±2) g,购自北京华阜康生物科技股份有限公司。小鼠饲养于SPF级动物房,共33只。所有动物实验按照郑州大学实验动物中心的要求规范操作。
1.1.3 实验试剂 PrimeSTAR HS高保真DNA聚合酶、dNTPs、5×上样缓冲液(含Mg2+)、DL2000 DNA marker、限制性核酸内切酶NcoⅠ、SalⅠ、DNA小量纯化试剂盒,购自TaKaRa公司;质粒小量抽提试剂盒,购自Omega Bio-Tek股份有限公司;T4 DNA连接酶、铝佐剂,购自Thermo Fisher Scientific公司;LPS去除试剂盒,购自南京金斯瑞生物科技有限公司;SDS-PAGE 试剂盒,购自上海碧云天生物技术有限公司;Ni-NTA亲和层析预装柱,购自GE公司。
1.2 实验方法
1.2.1 MapZ的表达纯化与LPS清除 提取肺炎链球菌标准菌株D39基因组DNA;以此为模板采用正、反向引物(5′-CCCATATGAGTAAAAAAA-3′和5′-GCGTCGACGTAGTCCAAG-3′)进行MapZ片段PCR扩增。重组质粒pET-28a(+)-MapZ的构建及后续重组蛋白MapZ的表达和纯化参考文献[10]。使用LPS去除试剂盒清除蛋白溶液中LPS。紫外分光光度法测定纯化蛋白的浓度后将样本置于-80 ℃条件下50%甘油中保存。
1.2.2 MapZ重组蛋白抗血清的制备 免疫前于小鼠尾静脉取血,分离血清作为阴性对照,于-20 ℃保存。每只小鼠经皮下注射抗原(50 μg目的蛋白和50 μL 铝佐剂),每隔14 d加强免疫1次,共免疫3次。末次免疫后7 d抽取小鼠心腔血,分离抗血清,于-20 ℃保存备用。
1.2.3 Western blotting分析MapZ在肺炎链球菌不同血清型中的同源性 肺炎链球菌标准菌株D39(2型)、CMCC31436(3型)、TIGR4(4型)、CMCC31207(6B型)、CMCC31614(14型)及CMCC31693 (19F型)全菌裂解物的制备方法参考文献[11]。全菌裂解物经SDS-PAGE分离后转膜。5% BSA封闭膜载体1 h后,以MapZ特异性抗血清为一抗(1∶2 000),羊抗鼠IgG-HRP为二抗(1∶5 000),4 ℃过夜孵育;洗膜后用ECL免疫印迹检测系统检测免疫复合物的沉积情况。待显色后通过Image Lab软件摄片并保存,分析MapZ在肺炎链球菌不同血清型中的同源性,即MapZ是否在多种血清型肺炎链球菌中均表达。
1.2.4 ELISA检测MapZ抗血清和不同血清型肺炎链球菌表面原位MapZ的结合力 将肺炎链球菌标准菌株D39(2型)、CMCC31436(3型)、TIGR4(4型)、CMCC31207(6B型)、CMCC31614(14型)及CMCC31693(19F型)共6种不同血清型分别接种于30 mL C+Y培养液中,于37 ℃、5% CO2条件下培养,至细菌处于对数生长期[D(600 nm)=0.5]时收集细菌。用无菌抗原包被液将不同血清型肺炎链球菌(1×106CFU/孔)包被于96孔板。以目的蛋白特异性抗血清为一抗(1∶1 000),从第1至11孔按梯度稀释,第12孔作为空白对照;以羊抗鼠IgG-HRP为二抗(1∶5 000),4 ℃过夜孵育,显色后于酶标仪读取光密度[D(540 nm)]值。根据ELISA抗体检测的标准,梯度稀释后对应空白孔2.1倍的抗体浓度即为抗体滴度。具体步骤参考文献[11]。
1.2.5 调理吞噬实验 自小鼠体内分离原代腹膜巨噬细胞,使用标准程序计数细胞;以DMEM重悬,均匀铺于24孔板(5×105个/孔),并于37 ℃、5% CO2条件下培养6 h。荧光染色实验和菌载量实验具体步骤参考文献[11]。调理吞噬实验中使用的肺炎链球菌血清型为肺炎链球菌标准菌株D39(2型)。
1.2.6 抗黏附实验 具体步骤:(1)黏附实验菌载量的测定。于含10%热灭活FCS的DMEM中培养A549细胞,使用标准程序计数细胞并以2×105个/孔均匀铺于24孔板。用MapZ抗血清或正常血清处理肺炎链球菌(2×107CFU/孔),于37 ℃作用30 min。将该悬浮液加入A549细胞培养孔,于37 ℃、5% CO2条件下孵育1 h。经1 mL ddH2O裂解后,接种A549细胞于血琼脂平板。(2)黏附实验荧光染色步骤。按上述条件培养A549细胞,使用标准程序计数细胞并以2×105个/孔均匀铺于24孔板。用MapZ抗血清或正常血清处理FITC标记的肺炎链球菌标准菌株D39(2型)(2×107CFU/孔),于37 ℃作用30 min。将该悬浮液加入A549细胞培养孔,于37 ℃、5% CO2条件下孵育1 h。去除上清液,4%多聚甲醛固定细胞5~10 min,PBS漂洗3次;DAPI染核5~10 min,PBS漂洗3次,封片;于荧光显微镜下观察样本激发的荧光。
1.2.7 目的蛋白皮下注射免疫C57BL/6小鼠 将C57BL/6小鼠随机均分为PBS组、MapZ组和MapZ+铝佐剂组各11只,总共33只。每次分别皮下免疫PBS 100 μL/只、仅MapZ蛋白5.5 μg/只以及MapZ与铝佐剂的混合物(体积比1∶1,MapZ蛋白5.5 μg/只, 铝佐剂0.5 mg/只)。每隔2周免疫1次,共免疫3次。
1.2.8 MapZ对小鼠肺炎链球菌致死性肺炎模型的保护效果评估 小鼠肺炎链球菌致死性肺炎模型的建立: 将肺炎链球菌标准菌株D39(2型)接种于血平板,过夜培养,无菌PBS调整其密度至1×108CFU/20 μL;模型的建立及接种剂量的选择参照文献[11];末次免疫2周后使用10%戊巴比妥麻醉小鼠,经鼻滴注菌液30 μL/只,观察记录实验小鼠生存情况21 d。
1.3 统计学处理数据统计分析和作图采用GraphPad Prism 5软件。多组数据比较先使用方差分析,再使用Dunnett法进行两两比较。对于MapZ抗血清与各肺炎链球菌血清型的结合能力(结合滴度转化为对数),该数据是“配对的”,来自同一实验鼠的抗原接种前后,使用配对样本t检验分析。对于生存率,绘制Kaplan-Meier曲线并进行对数秩检验以评估显著性。检验水准(α)为0.05。
2 结果
2.1 MapZ的表达纯化及分析重组质粒pET-28a(+)-MapZ经PCR 鉴定可呈现特异性条带,而pET-28a(+)空白质粒无特异性条带显示(图1A),且重组质粒双向测序结果与基因库中编码肺炎链球菌MapZ的序列一致。原核表达MapZ重组蛋白,Ni柱纯化并用LPS去除试剂盒清除LPS(LPS<0.1 EU/μg)。10% SDS-PAGE分析所得蛋白,G-250染色后于相对分子质量51 500处见目的条带(图1B),相对分子质量与MapZ相符,纯度达95%以上,满足后续实验使用要求。
皮下免疫小鼠后,获得MapZ抗血清,ELISA分析MapZ抗血清和肺炎链球菌不同血清型的结合能力。实验中选用的肺炎链球菌血清型包括:肺炎链球菌标准菌株D39(2型)、CMCC31436(3型)、TIGR4(4型)、CMCC31207(6B型)、CMCC31614(14型)及CMCC31693(19F型),均为临床常见的肺炎链球菌感染血清型。结果显示,MapZ抗血清能够和多个血清型结合,且相较于正常血清,MapZ抗血清与肺炎链球菌的结合能力更强(均P<0.05,图1C)。为进一步检测MapZ抗血清的特异性,经Western blotting分析,MapZ抗血清能特异性识别不同血清型肺炎链球菌表面MapZ蛋白,且条带明显(图1D)。
2.2 MapZ抗血清对肺炎链球菌的调理吞噬作用为进一步评价MapZ抗血清的功能,研究在细胞模型中进行抗体介导的调理吞噬实验,通过计数100个巨噬细胞计算FITC+巨噬细胞百分比(图2A)。经统计发现,相较于正常血清组,MapZ抗血清组参与肺炎链球菌吞噬的巨噬细胞数显著增多(P<0.01,图2B)。与上述结果一致,细菌铺板计数结果显示,MapZ抗血清能够显著增强巨噬细胞对肺炎链球菌的吞噬能力(P<0.01,图2C)。以上结果表明,MapZ抗血清可显著增强巨噬细胞对肺炎链球菌的吞噬能力。
2.3 MapZ抗血清对肺炎链球菌的黏附作用为进一步评价MapZ抗血清的功能,研究在细胞模型中进行抗体介导的抗黏附实验(图3A)。通过计算黏附指数,研究发现,相较于正常血清组,MapZ抗血清能够显著减少肺炎链球菌对A549的黏附(P<0.01,图3B)。与上述结果一致,细菌铺板计数示MapZ抗血清组A549细胞表面黏附的细菌数显著减少(P<0.05,P<0.01,图3C)。以上结果表明,MapZ抗血清能显著抑制肺炎链球菌对A549的黏附。
2.4 免疫MapZ对肺炎链球菌致死性肺炎模型保护效果的评估末次免疫2周后,用肺炎链球菌标准菌株D39(2型)鼻腔攻毒各组小鼠,连续监测21 d小鼠的生存情况。结果显示,MapZ +铝佐剂免疫组小鼠的半数生存时间显著长于MapZ单独免疫组以及PBS对照组(P<0.05,P<0.01,图4)。

注:A.MapZ重组表达质粒的PCR鉴定,M为DL2000 DNA marker,1为pET-28a(+)-MapZ,2为pET-28a(+)空白质粒;B. 原核表达MapZ的SDS-PAGE分析,M为DL2000 DNA marker,1为MapZ蛋白;C.MapZ抗血清和不同血清型肺炎链球菌表面原位MapZ的结合能力;D.Western blotting分析MapZ蛋白结合抗血清的特异性。与正常血清组比较,*P<0.05,**P<0.01。图1 MapZ的表达纯化及分析

注:A.MapZ抗血清介导的调理吞噬实验荧光图(×40);B.FITC+巨噬细胞百分比;C.调理吞噬实验菌载量。**P<0.01。图2 MapZ抗血清对肺炎链球菌调理吞噬作用的影响
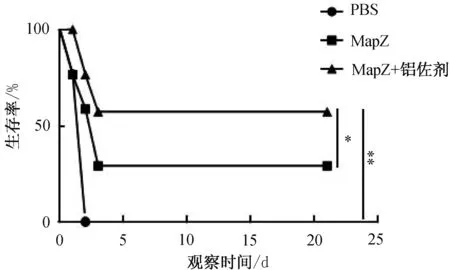
注:*P<0.05, **P<0.01。图4 MapZ对肺炎链球菌致死性肺炎模型保护效果的评估
3 讨论
肺炎链球菌正常定位于人体鼻咽部,但其有90多种血清型,临床常见的有30多种,能导致侵袭性感染如肺炎、脑膜炎和败血症[12-13]。该研究旨在探究MapZ作为肺炎链球菌蛋白疫苗的潜质。
研究制备的是MapZ蛋白全长,而不仅仅是胞外部分。为验证MapZ在不同血清型中的同源性,选择了侵袭能力较强的标准菌株 D39 和在中国普遍流行的CMCC31436(3型)、CMCC31207(6B型)、CMCC31614(14型)及CMCC31693(19F型)等临床分离菌株[14]。Western blotting和ELISA结果显示,MapZ抗血清能够特异性识别不同血清型肺炎链球菌中MapZ蛋白,并具有较强的结合能力。为进一步验证抗血清的功能,使用原代小鼠腹腔巨噬细胞建立调理吞噬及抗黏附实验模型,并用免疫荧光和菌载量2种方法评价MapZ抗血清的调理吞噬能力。结果提示,MapZ抗血清具有调理吞噬作用,能够促进巨噬细胞对肺炎链球菌的吞噬。在抗黏附细胞模型中,MapZ抗血清能够显著抑制肺炎链球菌与A549细胞的黏附。
铝佐剂是人体疫苗接种中使用的主要佐剂[15],因此研究选择明矾作为佐剂以验证MapZ皮下免疫小鼠后抗血清对肺炎链球菌感染模型的作用。研究发现,肺炎链球菌标准菌株D39致死性剂量鼻腔攻毒后,重组蛋白加铝佐剂可显著延长实验小鼠存活时间。
该研究对MapZ进行了多方面的评估,验证了其在不同血清型肺炎链球菌中的同源性。同时,MapZ抗血清具有调理吞噬作用和抗肺炎链球菌黏附能力。MapZ和铝佐剂能够有效提高肺炎链球菌鼻腔致死性攻毒后小鼠模型的生存率,这充分证明了MapZ是一种具有潜力的肺炎链球菌候选蛋白疫苗。

