几种放射孢子虫的形态特征和分子鉴定
高志鹏 杨 坤 陈 凯 习丙文, 谢 骏,
(1.南京农业大学无锡渔业学院, 无锡 214081; 2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室, 无锡 214081)
放射孢子虫是黏孢子虫生活史中寄生在无脊椎动物宿主的发育阶段; 鱼体接触有放射孢子虫水体是黏孢子虫病主要感染途径之一[1]。自1899年Stolc[2]在颤蚓上首次发现放射孢子虫后的很长一段时间, 放射孢子虫一直被认为隶属于黏体动物门独立的放射孢子虫纲[3]。1984年Wolf和Markiw首次证实虹鳟神经系统寄生脑碘泡虫(Myxobolus cerebralis)生活史需要寡毛类(正颤蚓)和鱼类两替换宿主的发育过程[4]。该研究结果开创性的将放射孢子虫和黏孢子虫的物种统一起来。此后, 黏体动物分类系统中放射孢子虫原有分类阶元被废止(Suppress),不作为有效分类类群使用。为了容纳此前报道大量未鉴定出对应黏孢子虫的种类, 建议将原有属名作为集合群(Collective group)区分不同形态的放射孢子虫[5,6]。目前共有20个放射孢子虫的集合类群[3,7—11], 其中以三突放射孢子虫集合类群报道种类最多(约60种)[10]。由于放射孢子虫是鱼类黏孢子虫病的病原感染传播重要途径, 其相关研究受到越来越多关注。
目前, 鱼类寄生黏孢子虫报道有16科62属2500多种[12—14], 其中一些种类会导致严重的养殖或自然水体鱼类疾病: 如洪湖碘泡虫引起的鲫“喉孢子虫病”[15], 脑碘泡虫引起的鲑鳟的“旋转病”[16],吴李碘泡虫引起的鲫“腹孢子虫病”等[17]。其中通过实验室感染或分子生物学方法阐析了约60种黏体动物生活史[18]。王桂堂和姚卫建[19]在2000年首次报道了国内发现的1种三突放射孢子虫(Triactinomyxon); 习丙文等[3,20—22]报道了14种放射孢子虫并鉴定出了其中4种对应的黏孢子虫种类: 武汉单极虫Thelohanellus wuhanensis)、吴李碘泡虫(Myxobolus wulii)、培养碘泡虫(Myxobolus cultus)和汪氏单极虫(Thelohanellus wangi)。赵丹丹等[23—25]报道了吉陶单极虫(Thelohanellus kitauei)、龟壳单极虫(Thelohanellus testudineus)和鲇楚克拉虫(Zschokkella parasiluri)的生活史。
本研究在对江苏地区发病鲫塘口的放射孢子虫调查过程中, 发现了多种放射孢子虫。本文报道和描述了其中新发现的4个集合类群的6种放射孢子虫。
1 材料与方法
1.1 池塘底泥寡毛类采集和暂养
通过自制采泥器采集养殖池塘底泥(10—15 cm),用钢筛(40目)筛除污泥, 收集寡毛类带回实验室在曝气自来水中暂养, 室温(25±2)℃。
1.2 放射孢子虫的检查和鉴定
吸取暂养水样, 用浮游计数框在显微镜下(Olympus CX-31, 10倍物镜)检查是否有放射孢子虫。将由单条寡毛类释放的放射孢子虫在显微镜下拍照, 形态学数据测量采用系统自带软件(TAC-9.0), 单位为微米(μm)。测量后的放射孢子虫水样收集到离心管中, -20℃保存备用。
1.3 SSU rDNA序列扩增
将保存的放射孢子虫水样离心(6000 r/min,5min)富集虫体到1.5 mL离心管中, 用Lysis buffer for microorganism to direct PCR (TaKaRa) 粗提基因组-20℃保存。放射孢子虫SSU rDNA采用巢式PCR方法扩增, 外引物ERIB1和ERIB10[26], 内引物Myxosp-F和Myxosp-R[27]。第一轮PCR扩增程序: 94℃预变性5min; 30个循环, 94℃变性30s, 50℃退火45s, 72℃延伸1min; 最后延伸7min; 第二轮PCR扩增程序:94℃预变性5min; 35个循环, 94℃变性30s, 55℃退火45s, 72℃延伸45s; 最后延伸7min。PCR反应体系: Ex Taq酶0.5 μL, 10×ExTaqbuffer 5 μL, dNTP 4 μL, 正反引物(10 μmol/L)各1 μL, 模板2—5 μL, 加双蒸水至50 μL。PCR扩增产物经1.2%琼脂糖凝胶电泳分离、纯化回收, 送至生工生物工程(上海)测序。
1.4 DNA序列分析
测序获得的SSU rDNA序列使用SeqMan (Lasergen package, DNAStar Inc.) 进行拼接, 通过BLASTN(http://blast.ncbi.nlm.nih.gov/) 在NCBI GenBank数据库中检索同源性较高序列进行比对和系统发育分析。序列多重比对采用Clustal X软件[28]; 序列一致性和碱基替换最佳模型分析使用MEGA 7.0软件[29]。系统发育分析采用MrBayes 3.1.2软件的贝叶斯推论法(Bayesian Inference, BI)和MEGA 7.0软件的最大似然法(Maximum likelihood, ML)。
2 结果
2018年4月至2019年6月在江苏溧阳、江阴、大丰和洪泽4个地区的鲫苗种塘和成鱼塘采集的底栖寡毛类水蚯蚓主要是苏氏尾鳃蚓(Branchiura sowerbyiBeddard, 1892)。在检查的3000多条苏氏尾鳃蚓中共发现10种放射孢子虫, 分别隶属于6个集合类群: 三突放射孢子虫(Triactinomyxon)2种、橘瓣放射孢子虫(Aurantiactinomyxon)2种、棘放射孢子虫(Echinactinomyxon)2种、新型放射孢子虫(Neoactinomyxum)2种、匈牙利放射孢子虫(Hungactinomyxon)1种和雷氏放射孢子虫(Raabeia)1种。其中4种与作者实验室前期报道描述种类一致, 本文主要对其中新发现的6种放射孢子虫进行鉴定和描述。
2.1 三突放射孢子虫DF
该类型放射孢子虫发现于江苏大丰(Dafeng),遵循放射孢子虫命名习惯将其命名为三突放射孢子虫DF(图1和表1)。
形态学特征: 孢子具有长椭圆形孢体, 有孢柄和3个锚状尾突。孢体长(22.62±1.58) μm (19.05—24.79 μm), 孢体宽(9.96±0.91) μm (19.05—12.34 μm);3个等长的梨形极囊位于孢体顶端, 极囊长(4.56±0.48) μm (3.96—5.79 μm), 极囊宽(2.06±052) μm(1.22—2.73 μm); 孢柄长(72.35±1.00) μm (68.87—77.84 μm); 3个几乎等长锚状尾突长(142.99±7.39) μm(132.13—156.66 μm)。
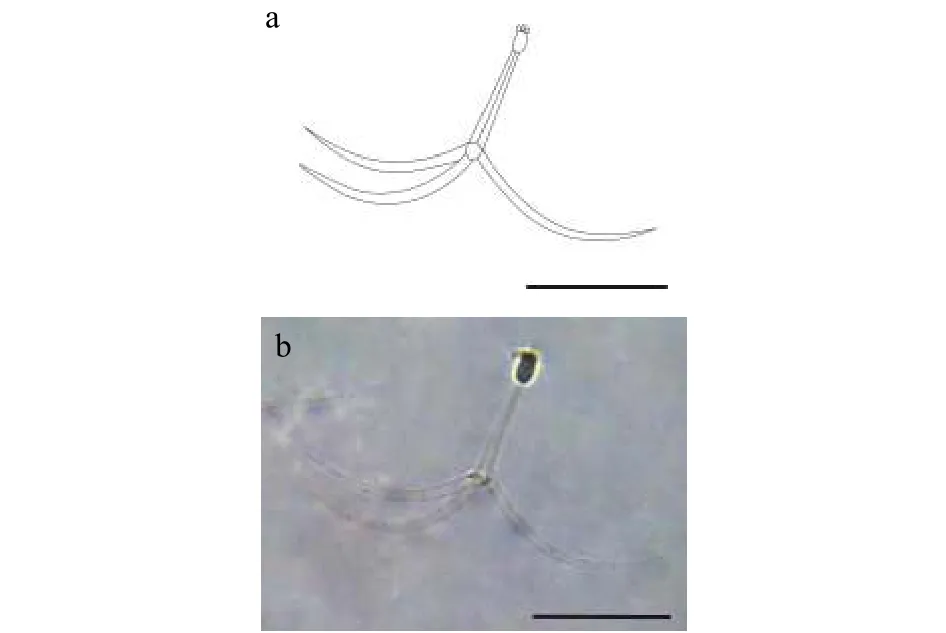
图1 三突放射孢子虫DFFig.1 Triactinomyxon-type DF
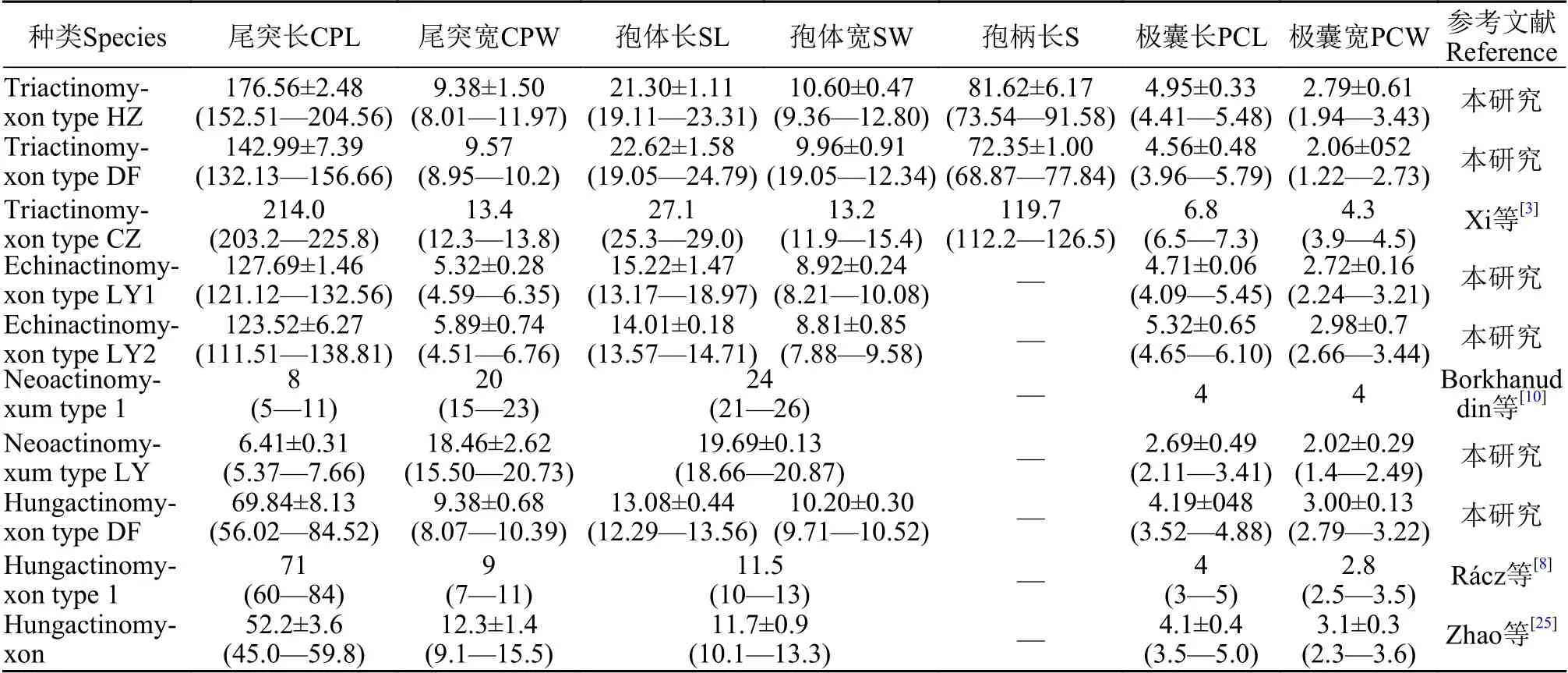
表1 本研究发现放射孢子虫及其相似种类的形态测量数值(均值±标准差, 最小值—最大值)Tab.1 Morphormetric data of freshly actinosporeans released from the oligochaete Branchiura sowerbyi (mean±SD with ranges in parentheses; μm)
宿主: 苏氏尾鳃蚓(Branchiura sowerbyi)
采样地点: 江苏省盐城市大丰区海丰农场
感染率: 0.6%(3/500)
DNA序列: GenBank登录号MN294777
2.2 三突放射孢子虫HZ
该类型放射孢子虫发现于江苏洪泽(Hongze),遵循放射孢子虫命名习惯将其命名为三突放射孢子虫HZ(图2和表1)。

图2 三突放射孢子虫HZFig.2 Triactinomyxon-type HZ
形态学特征: 该放射孢子虫形态与三突放射孢子虫DF较为接近。孢体正面观呈长柱形, 孢体长(21.30±1.11) μm (19.11—23.31 μm), 孢体宽 (10.60±0.47) μm (9.36—12.80 μm); 3个等大极囊均匀分布在孢体顶端, 极囊长(4.95±0.33) μm (4.41—5.48 μm),极囊宽 (2.79±0.61) μm (1.94—3.43 μm); 孢柄长(81.62±6.17) μm (73.54—91.58 μm); 3个等长的锚状尾突长 (176.56±2.48) μm (152.51—204.56 μm)。
宿主: 苏氏尾鳃蚓(Branchiura sowerbyi)
采样地点: 江苏省淮安市洪泽区
感染率: 0.77%(5/650)
DNA序列: GenBank登录号MN294778
2.3 棘放射孢子虫LY1
该类型放射孢子虫发现于江苏溧阳(Liyang),遵循放射孢子虫命名习惯将其命名为棘放射孢子虫LY1(图3和表1)。
形态学特征: 孢子具近卵圆形孢体和3个直棘尾突, 整体呈三角支架状。孢体长 (15.22±1.47) μm(13.17—18.97 μm), 孢体宽 (8.92±0.24) μm (8.21—10.08 μm); 极囊长 (4.71±0.06) μm (4.09—5.45 μm),极囊宽 (2.72±0.16) μm (2.24—3.21 μm); 尾突长(127.69±1.46) μm (121.12—132.56 μm), 尾突宽(5.32±0.28) μm (4.59—6.35 μm)。
宿主: 苏氏尾鳃蚓(Branchiura sowerbyi)
采样地点: 江苏省溧阳前马镇
感染率: 0.15%(1/650)
DNA序列: GenBank登录号MN294775
2.4 棘放射孢子虫LY2
该类型放射孢子虫发现于江苏溧阳(Liyang),遵循放射孢子虫命名习惯将其命名为棘放射孢子虫LY2(图4和表1)。

图3 棘放射孢子虫LY1Fig.3 Echinactinomyxon-type LY1

图4 棘放射孢子虫LY2Fig.4 Echinactinomyxon-type LY2
形态学特征: 孢子形态和测量学数据与棘放射孢子虫LY1相似; 孢体长 (14.01±0.18) μm (13.57—14.71 μm), 孢体宽 (8.81±0.85) μm (7.88—9.58 μm);3个等长的极囊长 (5.32±0.65) μm (4.65—6.10 μm),极囊宽 (2.98±0.7) μm (2.66—3.44 μm); 3个等长尾突长 (123.52±6.27) μm (111.51—138.81 μm), 尾突宽 (5.89±0.74) μm (4.51—6.76 μm)。
宿主: 苏氏尾鳃蚓(Branchiura sowerbyi)
采样地点: 江苏省溧阳前马镇
感染率: 1.5%(10/650)
DNA序列: GenBank登录号MN294776
2.5 新型放射孢子虫LY
该类型放射孢子虫发现于江苏溧阳(Liyang),遵循放射孢子虫命名习惯将其命名为棘放射孢子虫LY(图5和表1)。
形态学特征: 孢子顶面观呈近似三角形, 尾突月牙形, 孢体呈球形, 3个极囊聚集在孢体顶点处凸起。孢体直径长 (19.69±0.13) μm (18.66—20.87 μm);3个极囊长(2.69±0.49) μm (2.11—3.41 μm); 月牙状尾突长约占孢体直径的1/3, 长(6.41±0.31) μm (5.37—7.66 μm), 宽 (18.46±2.62) μm (15.50—20.73 μm)。
宿主: 苏氏尾鳃蚓(Branchiura sowerbyi)
采样地点: 江苏省溧阳市前马镇
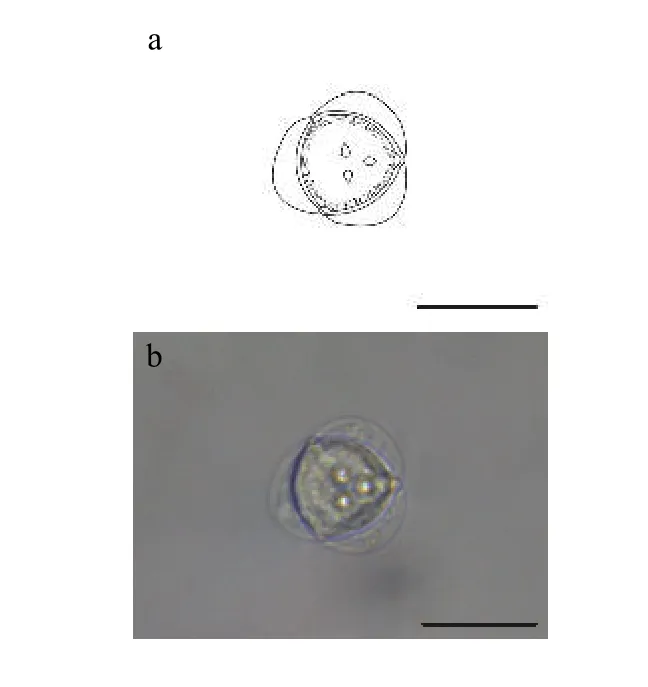
图5 新放射孢子虫LYFig.5 Neoactinomyxum-type LY
感染率: 0.17%(1/600)
DNA序列: GenBank登录号MN294779
2.6 匈牙利放射孢子虫DF
该类型放射孢子虫发现于江苏大丰(Dafeng),遵循放射孢子虫命名习惯将其命名为匈牙利放射孢子虫DF(图6和表1)。

图6 水体悬浮的匈牙利放射孢子虫DF, 比例尺=50 μmFig.6 Fresh floating Hungactinomyxon-type DF released by B.sowerbyi.Scale bars=50 μm
形态学特征: 由4个近似橘瓣放射孢子虫的尾突末端连接组成立方体, 与另一个由4个孢子组成的立方体交织形成网状结构; 孢体近球形, 无孢柄,尾突直棘状。单个孢子的孢体长(13.08±0.44) μm(12.29—13.56 μm), 孢体宽(10.20±0.30) μm (9.71—10.52 μm); 不含有孢柄; 3个等长的尾突(69.84±8.13) μm (56.02—84.52 μm), 尾突宽(9.38±0.68) μm(8.07—10.39 μm); 3个等大的极囊长(4.19±048) μm(3.52—4.88 μm) , 极囊宽(3.00±0.13) μm (2.79—3.22 μm) 。
宿主: 苏氏尾鳃蚓(Branchiura sowerbyi)
采样地点: 江苏省盐城市大丰区海丰农场
感染率: 0.8%(4/500)
DNA序列: GenBank登录号MN334159
2.7 SSU rDNA序列比对和系统发育分析
PCR扩增获得了6种新发现放射孢子虫的SSU rDNA序列片段, 其中三突放射孢子虫DF 845 bp(GenBank登录号MN294777)、三突放射孢子虫HZ 856 bp (GenBank登录号MN294778)、棘放射孢子虫LY1 830 bp (GenBank登录号MN294775)、棘放射孢子虫LY2 842 bp (GenBank登录号MN294776)、新放射孢子虫LY 830 bp (GenBank登录号MN29-4779)、匈牙利放射孢子虫DF 843bp (GenBank登录号MN334159)。序列同源性比对分析发现, 三突放射孢子虫HZ和DF与文献报道的Triactinomyxon type CZ (GenBank登录号JX477771)同源性最高, 分别为93.39%和94.48%; 棘放射孢子虫LY1与Myxobolus lentisuturalis(GenBank登录号AY119688)同源性最高(96.88%); 棘放射孢子虫LY2与Hungactinhomyxon type 1 (GenBank登录号AY779062)相似性最高(97.51%); 新放射孢子虫LY与Thelohanellussp.相似性最高(92.48%)。匈牙利放射孢子虫DF和国外文献报道的Hungactinomyxon序列相似度为99.41%—99.64%, 应被鉴定为同一物种。
系统发育分析显示棘放射孢子虫LY1和棘放射孢子虫LY2位于碘泡虫支, 其中棘放射孢子虫LY1与Myxobolus lentisuturalis亲缘关系最近, 聚为姊妹枝; 三突放射孢子虫DF和三突放射孢子虫HZ位于四极虫属分支; 新放射孢子虫LY聚在单极虫一枝。
3 讨论
黏孢子虫病是当前鱼类养殖中重要的寄生虫病之一, 如异育银鲫洪湖碘泡虫病、鲤吉陶单极虫病等。由于缺乏明确有效治疗药物, 通过切断病原生活史中鱼体外感染传播途径是该类疾病可行的有效防控措施。放射孢子虫作为黏孢子虫在无脊椎动物替换宿主内发育的重要阶段, 受到鱼病学和寄生虫学研究的广泛关注[30]。早期在研究黏孢子虫生活史过程中需要在实验室完成无脊椎动物感染[31]。由于实验复杂和耗时使得进展比较缓慢, 而且对于部分种类存在混合感染的孢子使结果的可靠性显著降低[32—35]。近年来, 分子生物学技术手段, 特别是SSU rDNA序列比对分析, 对黏孢子虫生活史的研究发挥重要促进作用[18], 共计约50多种黏孢子虫在两替换宿主体内发育阶段被准确鉴定。如碘泡虫(Myxobolus)、单极虫(Thelohanellus)、尾孢虫(Henneguya)、拟尾孢虫(Myxobilatus)、球孢虫(Sphaerospora)、新角形虫(Ceratonova)、四极虫(Chloromyxum)、两极虫(Myxidium)、楚克拉虫(Zschokkella)、霍氏虫(Hoferellus)以及微囊虫(Parvicapsula)等属内的不同种类[18]。本研究在对放射孢子虫鉴定中也采用了SSU rDNA序列比对分析,然而并没能确定所新发现的6种类型所对应的鱼体寄生黏孢子虫种类。可能的原有主要有两个方面,一是鱼体寄生黏孢子虫类有2500多种, 目前NCBI数据库中可供参考的序列非常有限; 或者由于黏孢子虫物种多样性非常高, 有些种类在鱼体还没有被发现和报道。随着鱼类黏孢子虫物种多样性研究的深度和广度的不断增加, 本研究所报道放射孢子虫及其DNA序列将提供重要的参考依据。
放射孢子虫的形态鉴定主要依据孢体形状、孢柄有无、尾突发生位置和形状及大小。目前三突放射孢子虫是已报道种类最多的集合类群。本研究所发现的Triactinomyxon HZ与文献中江苏常州养殖池塘发现的Triactinomyxon type CZ形态非常相似, 但在孢子大小上存在差异; 前者尾突和孢柄明显短于后者(176.56 μmvs.214.0 μm, 81.62 μmvs.119.7 μm, 表1)。本研究所报道的Triactinomyxon DF在孢子大小上显著小于Triactinomyxon HZ(表1)。SSU rDNA分析发现序列一致性低于95%,进一步确认这些孢子大小不同的三突放射孢子虫属于不同物种。本研究所发现的Neoactinomyxum LY与该集合类群中其他种类主要区别特征在于月牙状尾突, 但与Borkhanuddin等[10]报道的Neoactinomyxum type 1形态较为相似; 二者主要区别在于孢子尾突长和宽大小(6.41 μmvs.8 μm, 18.46 μmvs.20 μm, 表1)。本研究发现的Echinactinomyxon LY1和LY2的尾突的末端都有明显的分叉结构, 可以与文献中报道的Echinactinomyxon种类明显区分开。Echinactinomyxon LY1和LY2的形态数值非常接近很难区分, 然而SSU rDNA序列(MN294775和MN294776, 96.7%)却存在很大差异, 表明这2种放射孢子虫为不同物种。该结果进一步说明由于放射孢子虫形态结构简单, 仅仅依赖形态特征容易存在错误鉴定, 分子生物学手段是物种鉴定的有力佐证。
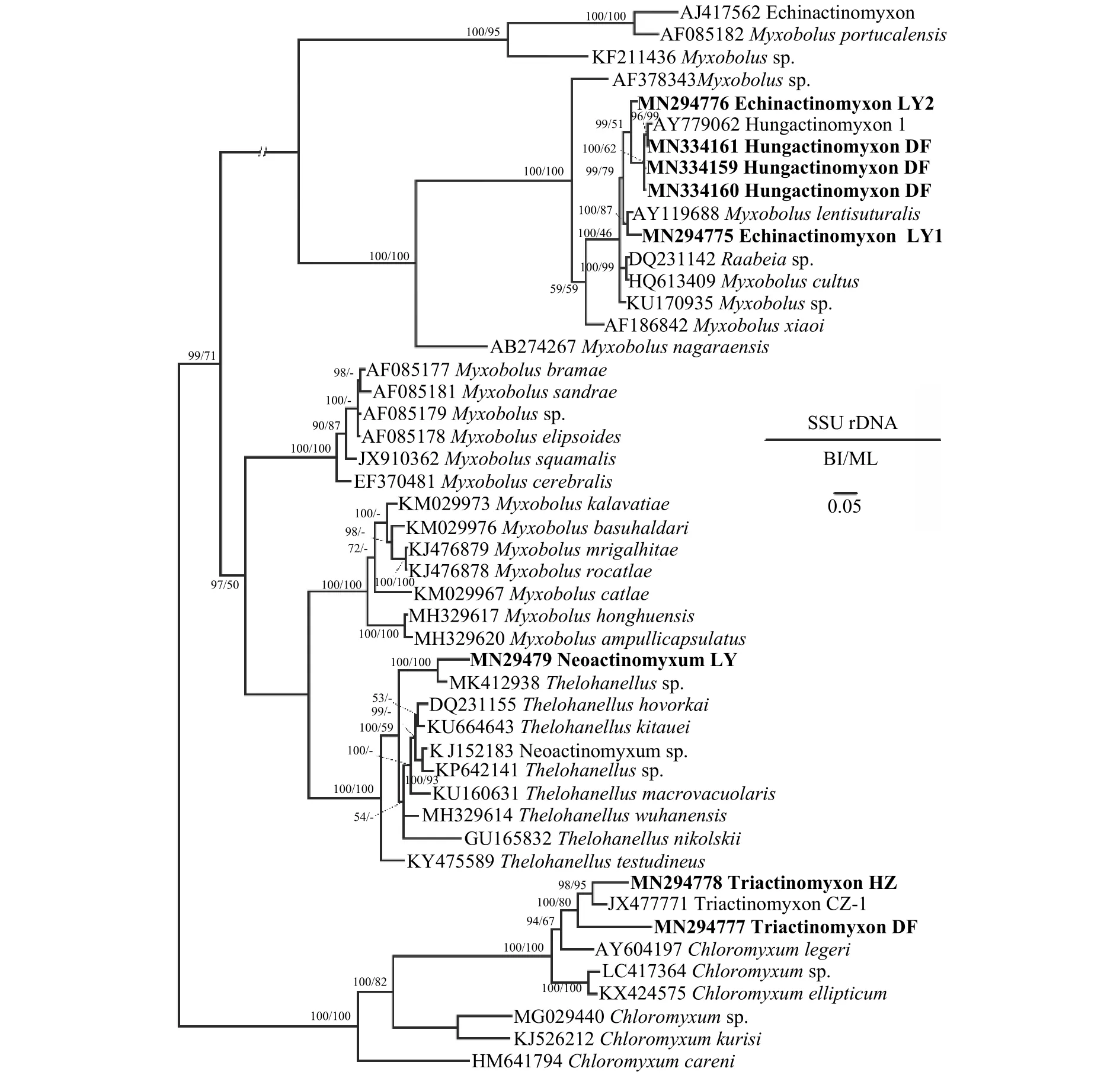
图7 基于黏体动物SSU rDNA序列建立的系统发育树Fig.7 Phylogenetic tree of myxozoans based on the SSU rDNA sequences
本研究发现的Hungactinomyxon DF, 其形态与Ráczdeng等[8]在匈牙利苏氏尾鳃蚓中发现的Hungactinomyxon type 1及赵丹丹等[25]在湖北大同湖和东西湖异育银鲫苗种塘发现的Hungactinomyxon虫体形态上非常相近。本研究发现的Hungactinomyxon虫体与赵丹丹等[25]描述的放射孢子虫在形态上有些不同, 如尾突长比赵丹丹等[25]描述的更长(69.84 μmvs.52 μm), 尾突更细(9.38 μmvs.12.3 μm); 与Rácz描述的匈牙利放射孢子虫形态更接近。此外, 尽管中国和匈牙利地理相隔很远且属于不同动物地理区系, 但SSU rDNA序列分析表明它们具有>99%的序列一致性。因此, 本文报道的Hungactinomyxon和匈牙利报道的Hungactinomyxon type 1应被鉴定为同一物种的不同地理种群。20世纪欧洲曾从亚洲地区引进鲤科鱼类(鲤、鲢、鳙等)用于养殖和水环境调控。Hungactinomyxon type 1[8]在匈牙利的出现极有可能是黏孢子虫随鱼类宿主种群扩散的结果, 同时其生活史中所需的替换宿主苏氏尾鳃蚓也是世界广布种。
系统发育分析表明本研究所发现的Echinactinomyxon和Hungactinomyxon与Raabeia类型放射孢子虫有较近的亲缘关系且都聚集在碘泡虫(Myxobolusspp.)分支中(图7)。此前的研究也发现碘泡虫属种类对应的放射孢子虫集合类群具有很高的多样性[36]。此外, Rocha等[37]认为Raabeia类群的尾突形态具有很高的可塑性, 尾突的直和弯曲不能作为Echinactinomyxon和Raabeia类群的区分特征; 建议将Echinactinomyxon和Raabeia合并。本研究认为目前放射孢子虫集合类群名称不是有效的分类阶元, 不具有实际分类学意义; 为了避免描述上的混乱仍然保留Echinactinomyxon集合类群。
由于本研究所报道的放射孢子虫DNA序列与目前可用于比对分析的鱼体寄生黏孢子虫序列一致性都低于99.0%, 超出普遍认为的种内差异1%;因此, 未能鉴定出对应的黏孢子虫物种。系统发育分析表明三突放射孢子虫Triactinomyxon HZ和DF聚在四极虫属分支、Neoactinomyxum LY聚在单极虫Thelohanellus分支、Echinactinomyxon LY1和LY2及Hungactinomyxon DF聚类在碘泡虫分支;这些放射孢子虫应分别对应了四极虫、单极虫和碘泡虫属的6种不同黏孢子虫种类。四极虫通常为腔寄生, 感染鱼的胆囊和膀胱[38]; 碘泡虫和单极虫可感染鱼几乎所有的组织器官[39]。进一步开展池塘养殖鱼类寄生黏孢子虫多样性调查有助于揭示本研究所发现放射孢子虫感染传播途径。
总之, 本研究基于形态和分子生物学特征描述了6种新发现的放射孢子虫, 进一步丰富了黏孢子虫物种多样性的研究内容, 为揭示鱼类寄生黏孢子虫病原的生活史提供基础数据。

