麸皮中阿魏酸体外抑菌作用及机理
李梦雨,马莹,柴新义,张汆,张微微
(滁州学院 生物与食品工程学院,安徽 滁州,239000)
小麦麸皮是面粉加工中的主要副产物,含有多种人体生长发育必需的成分,对皮肤、脾肺、肠、胃等均有益处,具有很高的医疗保健价值。但其口感粗糙,主要用作动物饲料、食用菌培养基质及高纤维食品等,开发利用率较低。近年来,随着可持续资源充分利用和能源开发广受关注,麸皮及其提取物的相关研究逐渐成为热点[1]。王苗苗[2]等发现,黑小麦麸皮中所提取到的多酚、黄酮和色素类物质含量丰富且具有较好的抗氧化活性。麸皮理化特性和生理功能受条件的影响,水溶性麸皮多酚主要以结合型阿魏酸的形式存在,其含量可以通过微生物发酵提高,以增强抗氧化活性[3-4]。
阿魏酸(Ferulic Acid)化学名称是4 -羟基-3 -甲氧基肉桂酸,是麸皮中含量最高的酚酸[5]。阿魏酸对包括肺炎杆菌、绿脓杆菌等在内的多种致病菌及导致食物变质的细菌具有抑制作用,对机体却几乎没有毒副作用,可被机体吸收从尿中排出[6-7]。近年来阿魏酸的抑菌性不断被证实且丰富。赵利利[8]等发现,阿魏酸对大肠杆菌和蜡状芽孢杆菌有较强的抑菌活性并能降低其组胺的产量。薛林林[9]发现阿魏酸能够显著抑制屎肠球菌和粪肠球菌的生长以及降低其酪胺的产量。因此,阿魏酸具有成为新型抑菌剂的基础,有望解决抗生素耐药等问题[10],但目前关于麸皮阿魏酸提取物的抑菌以及阿魏酸抑菌机理的研究却较少。
由此,本实验以麸皮阿魏酸为对象,开展其对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌抑菌活性及机理研究,以期为麸皮阿魏酸作为天然安全的抑菌剂奠定理论基础。
1 材料与方法
1.1 材料和仪器
1.1.1 材料 大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌,(从微生物工业菌种中心购买,由本实验室保存);麸皮阿魏酸提取物,本实验室自制,浓度为34 μg/ml;考马斯亮蓝G-250(北京索莱宝科技有限公司);碱性磷酸酶试剂盒(南京建成生物科技有限公司);阿魏酸标准品(北京寰宇科创生物科技发展有限公司)。
1.1.2 仪器 T-6紫外可见分光光度计(北京普析通用仪器有限责任公司);SW-CJ-1CU超净工作台(苏州安泰空气技术有限公司);LS-75HG高压蒸汽灭菌锅(滨江医疗);HT-400B电热恒温水浴箱(上海赫田科学仪器有限公司);L550离心机(湖南湘仪集团);DHP-9272B恒温培养箱(上海一恒科技有限公司)。
1.2 实验方法
1.2.1 菌液的培养 从菌管中挑取一环菌种接种于100 mL的牛肉膏蛋白胨液体培养基,振荡培养12 h,稀释至105cfu/mL,备用。
1.2.2 抑菌活性的测定 滤纸片法测定抑菌圈大小判断阿魏酸的抑菌活性[11]。用移液枪将20 μL的麸皮阿魏酸提取物打到6 mm滤纸片上,于超净工作台内风干。吸取0.1 mL已经稀释的菌液接种于固体牛肉膏蛋白胨培养基并涂布均匀,再将风干的带有提取液的滤纸片均匀放置在平板内,静置5 min。将平板在37 ℃培养箱内培养12 h,测定抑菌圈直径大小。最小抑菌浓度(MIC)测定,参照纠敏的方法[12],采用常量肉汤稀释法测定最小抑菌浓度。取菌悬液依次进行梯度稀释,使得阿魏酸最终浓度分别为:100、50、25、12.5、6.25 μg/mL。所有处理组置于37 ℃,220 r/min培养18~24 h,以肉眼不见细菌明显生长时阿魏酸的最低浓度为MIC,实验重复3次。
1.2.3 对指示菌株生长曲线的影响 参照曹少谦的方法并稍作修改,将不同浓度的阿魏酸(0MIC、1MIC、3MIC)加入菌悬液中震荡培养(37 ℃,150 r/min),培养24 h,每隔2 h测定OD 值[13]。平行测定3 次,以时间为横坐标,吸光度为纵坐标绘制生长曲线。
1.2.4 作用前后对胞外蛋白的影响 将菌液处理为阿魏酸含量分别为0MIC、1MIC、3MIC并置于37 ℃、100 r/min摇床培养。于0、3、9、12 h定点采样。取1 mL待测样,加入5 mL考马斯亮蓝显色剂,静置10 min,于595 nm测定吸光值[14]。
1.2.5 阿魏酸对细胞壁完整性的影响 使用试剂盒检测AKP活性以测定细胞壁完整性。将最终浓度阿魏酸含量为0MIC、1MIC、3MIC的菌悬液置于37 ℃、100 r/min摇床培养。在0 h和12 h取样,3000 r/min离心10 min,取上清液,用AKP试剂盒测定上清液中碱性磷酸酶含量实验重复3 次[15]。
2 结果与讨论
2.1 阿魏酸提取物对指示菌株抑菌效果
阿魏酸对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌的抑菌试验结果如图1、2、3,抑菌圈直径如表1所示。阿魏酸对三种受试细菌均具有抑菌活性,对金黄色葡萄球菌作用最明显。其对受试菌的抑菌活性大小为金黄色葡萄球菌>枯草芽孢杆菌>大肠杆菌,与阿来·海拉西等人的研究结果一致[16]。阿魏酸对金黄色葡萄球菌抑制作用最强,与已证实的多酚类化合物对革兰氏阳性菌具有较强的抑制作用结果一致[17]。推断阿魏酸可能有破坏革兰氏阳性菌细胞壁中的肽聚糖或磷壁酸,使其通透性增加的作用。

表1 阿魏酸提取物作用三种指示菌株的抑菌圈直径大小
2.2 阿魏酸对金黄色葡萄球菌的最小抑菌浓度MIC值
鉴于金黄色葡萄球菌明显的抑制效果,选取该受试菌株进行更进一步的研究。从表2中,可以清晰看到当12.5 μg/mL≤阿魏酸质量浓度<25 μg/mL时,金黄色葡萄球菌菌悬液中菌落生长明显减少,阿魏酸质量浓度≥50 μg/mL时,无细菌生长。因此阿魏酸对金黄色葡萄球菌的MIC为25 μg/mL。
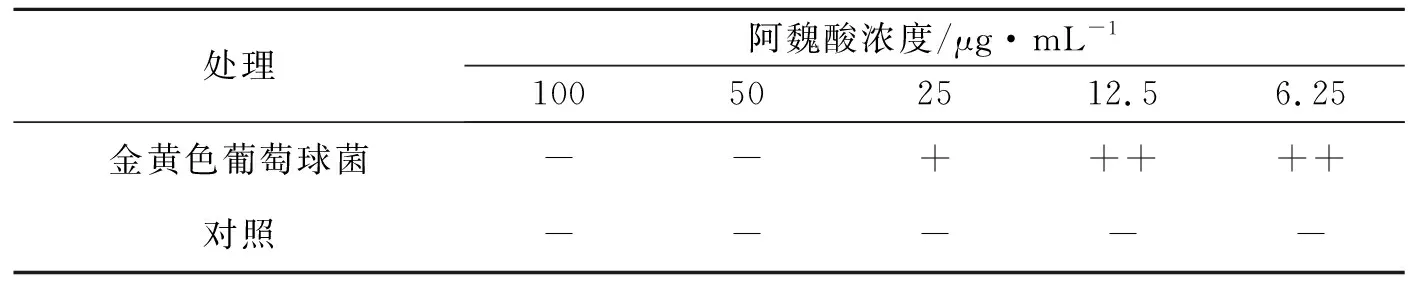
表2 阿魏酸对金黄色葡萄球菌的MIC
2.3 阿魏酸对金黄色葡萄球菌生长性能的影响
生长曲线法测出的抑菌曲线如图4所示,直观地揭示了细菌群体的生长规律与阿魏酸浓度变化的情况。不含阿魏酸的金黄色葡萄球菌对照组接种到培养基后的0 ~6 h,细菌数量增长较少,为它的适应期,6 ~12 h是其生长的对数期,20 ~24 h为平稳期。阿魏酸浓度为3MIC时,0 ~ h为金黄色葡萄球菌生长的适应期,之后进入对数期,其增速相较对照组来说较迟缓。阿魏酸浓度为MIC时,0 ~ 20 h为其适应期,之后开始增长进入对数期,但相比于不加阿魏酸的对照组和含有3MIC阿魏酸的菌液,其增长速度更加低缓。阿魏酸含量为MIC时,对适应期的作用时间较3MIC浓度略长,但都明显延长了金黄色葡萄球菌生长的适应期。阿魏酸作用于金黄色葡萄球菌,延长了其生长的适应期,使其生长减慢。
2.4 阿魏酸对金黄色葡萄球菌胞外蛋白的影响
图5显示,胞外蛋白含量在0 ~3 h之间变化不大,在3 ~9 h处于升高的状态,9 h后开始降低,含有阿魏酸的实验组胞外蛋白的含量在试验时间内均低于对照组。可溶性蛋白是细菌重要的渗透调节物质,其增加和积累能提高细胞的保水能力,对细胞生命物质及细胞膜起到保护作用[18]。胞外蛋白含量实验组相较于对照组有明显降低的结果,说明阿魏酸的作用影响了蛋白质的合成和分泌。目前少有关于多酚类物质对抑制蛋白质生成机制的研究,但贾旭东[19]等发现茶多酚可以抑制人干细胞凋亡蛋白的表达。因此推断实验现象可能与阿魏酸破坏了细胞中核酸,干扰了蛋白质的正常翻译等有关。
2.5 阿魏酸对细胞壁完整性的影响
碱性磷酸酶(AKP)是存在于细菌细胞壁与细胞膜间的一种酶,正常情况下,在胞外不能检测到其活性[20],当细菌细胞的通透性增加时,AKP就会大量泄漏到胞外。从表3可以看出,胞外AKP酶含量在培养12 h后增加,含有阿魏酸的菌液含量变化幅度最大,对照组的变化最不明显。在加入阿魏酸后,菌悬液中的AKP含量明显增加,说明细胞的壁膜完整性遭到破坏。由此可以推断阿魏酸抑菌的原因之一是破坏金黄色葡萄球菌的细胞壁通透性。
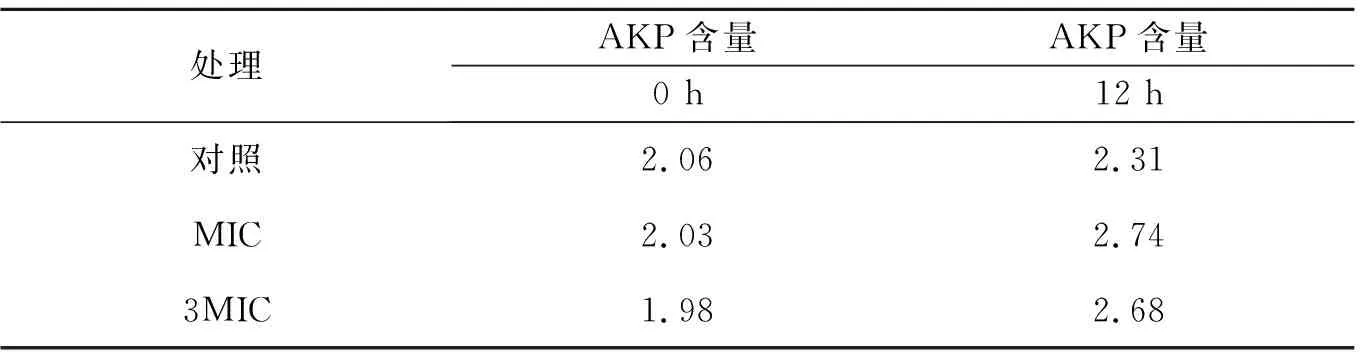
表3 阿魏酸对作用后胞外AKP的影响
3 结论
过滤定容后的阿魏酸提取物浓度为34 μg/mL,这一浓度下的阿魏酸提取物对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌均有抑制作用,其作用效果为金黄色葡萄球菌(12 mm)>枯草芽孢杆菌(9 mm)>大肠杆菌(7.5 mm)。相比于革兰氏阴性菌,阿魏酸提取物对革兰氏阳性菌的抑制作用更为明显。阿魏酸对金黄色葡萄球菌的MIC为25 μg/mL。加入阿魏酸的处理组细菌生长的适应期增长、胞外蛋白含量减少、AKP含量增加,且在MIC条件下变化最为明显。所以其抑菌机制与一定浓度下阿魏酸对细菌蛋白质的正常合成和细胞壁的干扰和破坏的结构导致其通透性增加有关。

