miRNAs与Wnt通路调节食管癌的发生
陈蒙蒙,金玮娜,彭天娇,姚 俊
食管癌(esophageal cancer,EC)是消化道最具侵袭性的恶性肿瘤之一,其发病率在所有恶性肿瘤中排名第七,死亡率位居所有癌症中第六[1]。中国是EC发病率最高的国家之一,2015年我国EC患者预估有47.7万人,同年死亡人数有37.5万人[2]。目前EC的5 a生存率为15%~25%,但早期EC的5 a生存率可高达80%[3],尽管提倡早发现、早诊断、早治疗,然而大多数EC患者在被诊断和治疗时已经是晚期,这是EC预后差的主要原因。虽然内镜检查是检测早期EC的有效方法,并且可以降低死亡率[4],但高昂的成本和侵袭性限制其作为早期广泛筛查工具[5]。因此,寻找无创性早期检测方法无疑是提高EC早期诊断率和改善预后的有效途径。
MicroRNA(miRNA)是一类存在于真核生物体内、短小的、保守的非编码RNA,在基因表达调控和mRNA转录及翻译中起到特定的作用,包括细胞分化、增殖及凋亡等生物学过程[6]。有研究证实,许多miRNAs在肿瘤中异常表达,并以原癌基因或抑癌基因的形式影响肿瘤的启动和进展[7]。临床上,越来越多的miRNAs被用作肿瘤的诊断、监测预后、评价疗效等。因此研究miRNA的下游通路以及作用方式成为热点。
miRNA在食管癌发生发展中的作用与Wnt/β-catenin信号通路密切相关[8]。Wnt信号通路是1982年与原癌基因Int1(也称为Wnt1)共同发现的一种重要的细胞外信号通路[9]。这条信号通路涉及多种发育过程,如细胞生长、分化、凋亡、迁移、个体发育、遗传稳定性、干细胞的自我更新、组织内稳态的维持、组织再生和肿瘤发生等多种生物学过程[10-11]。
Wnt信号通路包括两条不同的细胞内信号通路,经典的(Wnt1、Wnt2、Wnt3、Wnt3a、Wnt7和Wnt8等Wnt蛋白)和非经典的(Wnt4、Wnt5a、Wnt5b和Wnt11等Wnt蛋白)。经典的Wnts通过β-catenin转导信号,从而激活β-catenin/Tcf/Lef靶基因的转录[12-13],非经典Wnts途径又分为Wnt/Ca2+途径和Wnt /平面细胞极性(Pane cell polarity,PCP)途径。而非经典的Wnts与Wnt平面细胞极性通路、Wnt-JNK信号通路、Wnt/Ror受体通路、Wnt-GSK3MT通路、Wnt-aPKC通路、Wnt-Ryk通路和Wnt-mTor通路等的激活有关[14]。Wnt信号通路应保持在正常水平,以发挥正常的生理功能。然而,大量研究表明Wnt通路在许多癌症中被激活[15]。因此,确定遗传因素和生物标记物,对于预测Wnt途径调节剂治疗的疗效、诊断和判断肿瘤的预后,以及开发新的治疗方法具有重要意义。为了探讨miRNAs通过Wnt途径在EC进展中的不同作用,本文综述所有已报道的与Wnt途径相关的miRNAs。
1 miRNAs通过Wnt通路调节食管癌细胞的增殖、侵袭和转移
Ma J的研究表明,miR-4261在食管鳞癌(esophageal squamous cell carcinoma,ESCC)组织中的表达水平明显高于正常组织,且与MEG3在ESCC组织中的表达呈负相关,mRNA MEG3在ESCC组织中表达下调,并与肿瘤进展和预后不良有关。此外,体内外实验表明miR-4261是MEG3的靶点,MEG3可以直接调控miR-4261的表达、上调DKK2和阻断Wnt/β-catenin信号通路,抑制细胞增殖、迁移和侵袭[16]。
Qiao G等用RT-qPCR方法检测50例配对的ESCC组织和非肿瘤组织,证实miR-106b-3p在ESCC组织中表达上调,而ZNRF3在ESCC中下调。ZNRF3是Wnt/β-catenin信号转导的负调控因子,被认为是miR-106b-3p的直接靶标。实验结果表明,miR-106b-3p通过下调ZNRF3和通过Wnt/β-catenin信号通路诱导ESCC细胞的EMT,促进细胞增殖和侵袭[17]。
有研究发现miR-301a在EC细胞中表达上调,荧光素酶报告分析证实Wnt1是miR-301a的靶基因,miR-301a通过靶向Wnt1阻断Wnt/β-catenin信号通路和EMT的逆转,抑制食管癌细胞增殖和迁移,增强放射敏感性[18]。
miRNA let-7a也是与人类恶性肿瘤有关的miRNAs之一[19]。研究表明,与癌旁组织相比,肿瘤中let-7a的抑制与ESCC的侵袭、转移和不良预后密切相关。Lin28是一种RNA结合蛋白,在信号转导中起关键作用,调节Let-7a和Wnt信号通路下游基因的表达[20-21]。Wnt/β-catenin/lin28信号转导诱导EMT,并通过消除let-7a而促进ESCC的侵袭、转移和不良预后[22]。
根据芯片数据的分析和ESCC活检的验证,与匹配的邻近正常组织相比,ESCC组织中miR-30a-3p/5p下调,且与Wnt信号的激活相关。miR-30a-3p/5p直接靶向Wnt2和Fzd2的3’-UTR并分别抑制它们的表达,进而调节了EC细胞增殖[23]。
miR-455-3p在ESCC和多种癌症中上调,根据肿瘤类型的不同而起到促进或抑制肿瘤的作用[24]。Liu A等证明miR-455-3p在ESCC中明显上调,并与患者的总生存期和疾病生存期较短相关,同时证实了miR-455-3p的沉默降低了β-catenin和TGF-β/Smad信号通路下游基因在各自途径中的表达水平,表明miR-455-3p在ESCC中激活Wnt/β-catenin和β-smad途径,并促进EC细胞转移和侵袭[25]。先前的研究表明miR-200b是ESCC的侵袭性抑制因子[26], Zhang HF等验证了miR-200b主要诱导ESCC细胞G2期阻滞、凋亡,抑制细胞生长和克隆形成潜能,介导其在ESCC中的肿瘤抑制作用。CDK2和PAF(一种有效的癌蛋白)被鉴定为miR-200b靶点,并通过抑制Wnt/β-catenin信号转导抑制细胞生长,显示miR-200b是ESCC中的治疗靶点[27]。
Xu Y发现EC标本中β-catenin的水平显著升高,而miR-214的水平显著降低。EC标本中β-catenin和miR-214水平呈负相关。miR-214与β-catenin mRNA的3’-非翻译区结合抑制了β-catenin mRNA的蛋白质翻译,直接促进肿瘤的生长和转移,从而证明miR-214的下调通过激活Wnt/β-catenin通路来促进EC细胞生长和侵袭[28]。
研究表明,HPV-16感染可能是EC的重要危险因素[29]。Zang B等发现HPV E6通过直接下调TLE1、GSK3β和sFRP4在内的多个调节因子而激活Wnt/β-catenin通路,miR-125b的过表达恢复了这些蛋白的表达水平。在HPV-16 E6阳性EC组织中miR-125b的表达较低,并与HPV-16 E6 mRNA水平呈负相关。结果表明,HPV16 E6通过下调miR-125b促进EC发生,这一机制参与了Wnt/β-catenin信号通路的激活[30]。
食管癌细胞的增殖、侵袭和转移是食管癌恶性程度高的原因之一,上述多种miRNA的异常表达激活或抑制Wnt/β-catenin信号转导通路,靶向不同的靶点,不同程度上调控了食管癌细胞的增殖、侵袭和转移。
2 miRNAs通过Wnt通路调节食管癌的放射敏感性
放射治疗是晚期EC的主要治疗方式之一。一项研究表明,局部进展期EC的根治性同步放疗和化疗比单纯放疗具有更大的生存优势,但局部复发率和远处转移率仍然很高[31]。放射治疗耐药一直被认为是局部肿瘤复发或转移的最重要原因。先前的研究表明miR-301a是放射敏感性miRNAs异常分布的候选分子,并与ESCC放射敏感性有关[32]。miR-301a在EC细胞系中下调,而其靶基因Wnt上调,表明Wnt/β-catenin信号通路在食管癌细胞放射抗性中具有重要作用。Su H等研究证明转染miR-301a的放射抗性ESCC细胞KYSE-150R的增殖速率降低,放射敏感性和迁移率增加,双荧光素酶报告分析表明,Wnt1是miR-301a的靶基因,证明miR-301a可能是一种新型的放射敏感性相关miRNA,可用于EC放射抗性治疗策略[18]。
Xie C等在功能上证明了抑制miR-1275的表达促进了EMT,增加ESCC细胞KYSE-150的放射抗性,从机制上证明了miR-1275直接靶向Wnt1,使EC细胞中的Wnt/β-catenin信号通路失活。此外,Wnt1缺失通过抑制EMT,抵消了miR-1275抑制KYSE-150细胞辐射抗性的促进作用。他们的研究结果提示,miR-1275通过靶向Wnt1,抑制Wnt/β-catenin信号通路来抑制EC细胞的放射敏感性,为克服EC患者的放射抵抗提供了新的治疗途径[33]。
3 miRNAs通过Wnt通路调节食管癌细胞的自噬
细胞自噬是真核生物中对细胞内物质进行周转的重要过程,主要通过降解蛋白和受损细胞器来维持细胞内代谢稳态[34-35]。ATP形式的能量可以激活AMP激酶并驱动自噬。自噬可以通过一些抗癌疗法(如化疗、放疗和靶向治疗)来诱导,以促进癌细胞从应激诱导的损伤中存活。越来越多的证据突出了自噬在癌症中的重要作用,因为激活的自噬导致癌细胞的生存或死亡[36];另一方面,也有报道称抗癌治疗可以诱导自噬细胞死亡。因此,自噬对癌症发展的贡献仍然存在争议。
miR-638是一种潜在的癌基因,促进致瘤性,miR-638的过表达促进饥饿和雷帕霉素诱导自噬[37]。DACT3是Wnt/β-catenin信号转导的负调节因子,在多种恶性肿瘤中被转录抑制[38]。Ren Y等证明了在ESCC标本中miR-638表达增强而DACT3表达减弱,miR-638可能负调节DACT3的表达,促进自噬以及恶性肿瘤的发生,自噬相关的miR-638-DACT3-Wnt/β-catenin轴可能是癌症治疗干预的一个有吸引力的靶点[39]。
4 miRNAs通过Wnt通路调节食管癌的化疗耐药
临床上食管癌常用的化疗药物包括顺铂、5-FU和多西他赛等,但研究显示单药在食管癌治疗中效果欠佳[40],所以临床上广泛采用联合用药,肿瘤细胞对化疗药物产生耐药常常最终导致化疗失败[41]。因此,在分子水平上阐明肿瘤细胞的耐药机制对于新药研发及提高化疗效果具有重要意义。
Liu A等通过采用耐化疗的ESCC患者衍生的异种移植模型,成功地富集了耐化疗的ESCC细胞,在耐化疗的食管癌细胞和正常食管癌细胞中进行了miRNA分析,发现miR-455-3p在耐化疗的食管癌细胞中的表达明显高于正常食管癌细胞,抑制miR-455-3p可使ESCC细胞增敏,miR-455-3p作为负调控因子同时激活Wnt/β-catenin和TGF-β/Smad信号通路参与食管癌的化疗耐药[25]。
Wang Y等建立了一系列耐5-FU的EC细胞系,通过RT-qPCR分析它们的miRNAs差异表达。在一组5-FU耐药的EC细胞(OE19、OE33、PT1590和LN1590)中,miR-221在所有耐药变异体中过表达,miR-221的表达增加导致DKK2的表达减少,进一步抑制DKK2介导的Wnt/β-catenin信号通路,表明miR-221诱导的化学耐药是通过Wnt/β-catenin信号通路介导的[42]。
5 miRNAs通过Wnt通路促进食管癌的发生
Wnt/β-catenin信号通路是控制干细胞特征并促进肿瘤发生的主要分子途径[43]。Ge C等将Eca109/miR-942或Eca109/载体细胞皮下移植到小鼠体内,Eca109/miR-942细胞形成的肿瘤在大小和重量上都比载体控制细胞形成的肿瘤大。相反当使用antiagomir-942抑制miR-942的内源性表达时,肿瘤明显比对照细胞形成的肿瘤更小更轻。更重要的是,当植入1×102个细胞时,只有Eca109/miR-942细胞形成肿瘤[44]。而且结果证实miR-942的过度表达可通过抑制sFRP4、GSK3β和TLE1等因子,上调Wnt/β-catenin信号转导活性,通过促进食管肿瘤干细胞样特征进而促进食管癌的发生,并可能与肿瘤不良预后有关。揭示了一种新的分子机制来解释Wnt/β-catenin通路的组成性激活是如何促进肿瘤发生的,并提示miR-942可能作为监测、筛查食管癌发生的潜在标志物。
近年来食管癌发病率仍很高,总体治疗效果仍欠佳,复发转移率仍较高。miRNA通过不同的机制调节基因表达,通过与其他细胞大分子相互作用,激活或抑制Wnt信号通路,从而提供食管癌恶性转化的信号。Wnt通路相关的miRNAs在食管癌中受到不同程度的调控,调节食管癌细胞的增殖、侵袭和转移,调节食管癌细胞的自噬和细胞表型,调节食管癌的化疗耐药,调节食管癌的放射敏感性,促进食管癌细胞干细胞特征从而促进食管癌的发生等(见表1)。Wnt信号通路与miRNA的相互作用,在肿瘤的发生发展中起着重要的作用。这一结果证明miRNA-Wnt信号通路可作为肿瘤治疗的潜在靶点和预测治疗反应的诊断指标。尽管人们在寻找新的治疗方式方面做了大量的努力,但对Wnt通路在食管癌中靶向的分子机制仍存在一些争议,这个潜在机制有待于进一步研究,以提高疗效和开发联合疗法。
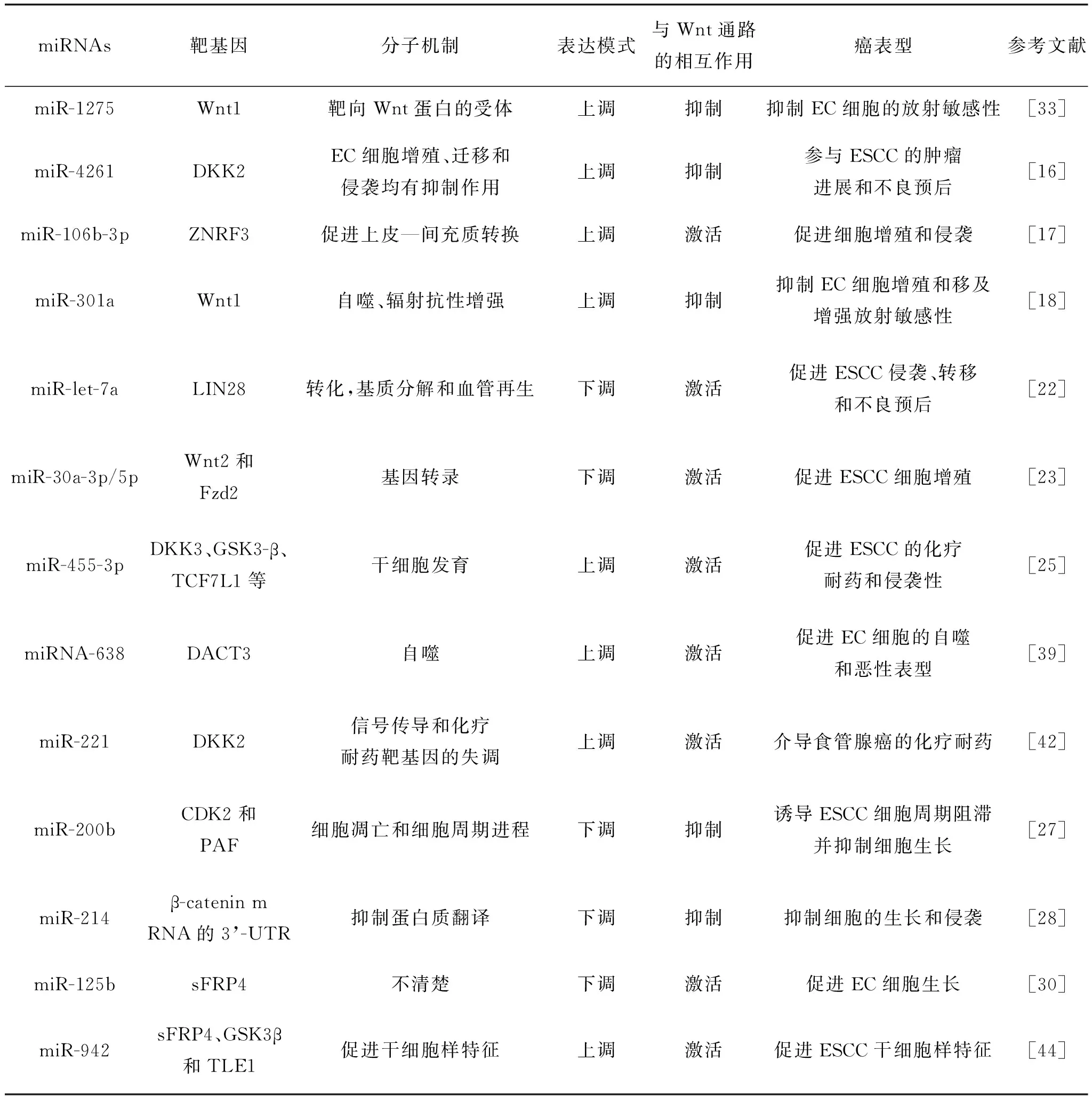
表1 食管癌中与Wnt通路相关的miRNAs

