成纤维细胞生长因子在小鼠胰腺发育中的作用
陈雯,许会静,张金三*,李校堃
(1. 温州大学生命科学研究院,浙江 温州, 325000; 2. 温州医科大学药学院, 浙江 温州, 325000)
成纤维细胞生长因子(fibroblast growth factors,FGFs)广泛存在于生物体中,是一种高度保守的多肽,通过激活成纤维细胞生长因子受体(fibroblast growth factors receptor,FGFR)发挥其生物学功能,如调节细胞信号转导,控制细胞增殖、分化和迁移,参与胚胎发育,组织损伤修复,新生血管形成,干细胞增殖分化,神经再生,钙磷代谢等,成为不同器官中上皮-间质相互作用的介体[1-3]。同时,在创伤修复、心血管系统疾病、神经系统疾病以及软骨再生中均扮演重要角色[4]。目前已发现23个FGFs家族成员和4个FGFR家族成员。FGFR主要由1个胞质酪氨酸激酶结构域、2个或3个Ig样结构域(称为环Ⅰ,Ⅱ和Ⅲ)组成,其中环Ⅲ的C端部分决定了受体的特异性[5]。FGFR1、FGFR2和FGFR3在第3外显子处进行剪接,产生 “b”或“c”亚型[4]。其中“b”亚型主要在上皮细胞表达,“c”亚型主要存在于间充质组织。
胚胎发育过程中,FGFs广泛表达在胰腺前体细胞周围的间充质中,通过旁分泌机制刺激胰腺前体细胞向间质细胞迁移从而启动胰腺发育过程[3],并参与调控内分泌胰腺细胞的精准分化[6-7]。为更好地了解FGFs及其受体调控胰腺发育的研究现状,本文将对FGFs在胰腺发育中的相关研究进展进行综述。
1 小鼠胰腺发育概述
胰腺的器官发生可分为3个阶段。第1阶段为胚胎期(embryo, E)8.5 d—E12.5 d,胰腺以2个独立胰芽的形式出现;E10.5 d—E11.5 d,背芽和腹芽不断延伸,分布在十二指肠两侧;E12.5 d,2个胰芽融合在一起,进行分支和扩张,胰腺祖细胞形成内外分泌簇(见图1a)。第2阶段为E13.5 d—E16.5 d,此时胰腺祖细胞增殖能力降低并开始分化,E14.5 d时,导管和腺泡(即外分泌部分)形成,呈现出独特的分支形态;而内分泌前体细胞则通过分层的方式从分支中脱离,聚集在主干中[8-9](见图1b)。E16.5 d至出生后为第3阶段,此阶段胰腺的内外分泌部得到重塑趋于成熟,E17.5 d,成熟的细胞聚集,形成具有腺泡、导管和胰岛的胰腺雏形(见图1b)。

图1 小鼠胚胎胰腺发育形态演变图Figure 1 Diagram of morphological evolution of pancreatic development in mouse embryo
2 成纤维细胞生长因子在胰腺发育中的作用
根据FGFs家族成员的序列同源性和功能不同可将其分为7个亚家族(见图2)。分别是FGF1、FGF4、FGF7、FGF8、FGF9、FGF11和FGF15/19亚家族。FGF1和FGF2是最早发现的FGF家族成员,它们属于FGF1亚家族。FGF1亚家族通过调控下游信号通路,对组织器官的形成、血管生成等具有重要作用。研究表明,重组FGF1具有胰岛素致敏作用,对于胰岛素抵抗和2型糖尿病的治疗具有重要的指导意义[10]。FGF4、FGF5、FGF6共同组成了FGF4亚家族,FGF4在胚胎和组织干细胞的增殖分化过程中发挥主要的调控作用;FGF5主要作用于毛囊生长周期;FGF6对肌肉修复和心肌保护起主要作用[11]。FGF3、FGF7、FGF10以及FGF22组成了FGF7亚家族,其中,FGF7可以促进骨骼的形成[12];FGF10在多种器官发育中发挥调控作用,并与肿瘤的发生发展以及创面修复和干细胞的增殖分化有关[13]。FGF8亚家族由FGF8、FGF17、FGF18组成,其中FGF17参与神经形成,脑部以及动脉、骨骼的发育,在胚胎发育和肿瘤形成中具有一定的作用;FGF18在骨骼发育中也起着重要作用[14]。FGF9亚家族成员有FGF9、FGF16、FGF20,它 们 主 要 与 受 体FGFR1c、FGFR2c、FGFR3c、FGFR3b以 及FGFR4结 合,FGF9在 多种组织中表达,与人类肥胖相关[15]。FGF11亚家族主要由FGF11、FGF12、FGF13、FGF14组成,属于胞内蛋白,无法分泌到细胞外,因此不能与FGFR结合。FGF15/19亚家族由FGF15/19、FGF21和FGF23组成,这个亚家族成员主要调控机体胆汁酸平衡、调节葡萄糖和脂质代谢等过程。本文重点对小鼠胰腺发育中FGF2、FGF4、FGF7、FGF10、FGF21和FGF23的作用机制进行综述。
2.1 成纤维细胞生长因子2在小鼠胰腺发育中的作用
FGF2主要通过FGFR1、FGFR2和FGFR3的IIIc亚型起作用。同时,它也以较低的亲和力与FGFR1b和FGFR4结合[2-3]。大量证据表明内分泌表型由胰腺前体激活,FGF2是诱导人胰腺前体细胞定向迁移和聚集以形成胰岛细胞聚集体的有效趋化剂,促进肠管形成和胰腺分化过程[4]。在内胚层中,FGF2是胰腺前体细胞启动形成的趋化因子[16-17],通过丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路激活胰腺十二指肠同源盒1(pancreatic and duodenal homeobox 1,Pdx1)的表达(见图3)[18]。此外,FGF2可以激活内分泌、自分泌、旁分泌的甘露聚糖,刺激细胞聚集和细胞簇形成的初始过程,这是内分泌胰腺发育和分化的重要步骤。
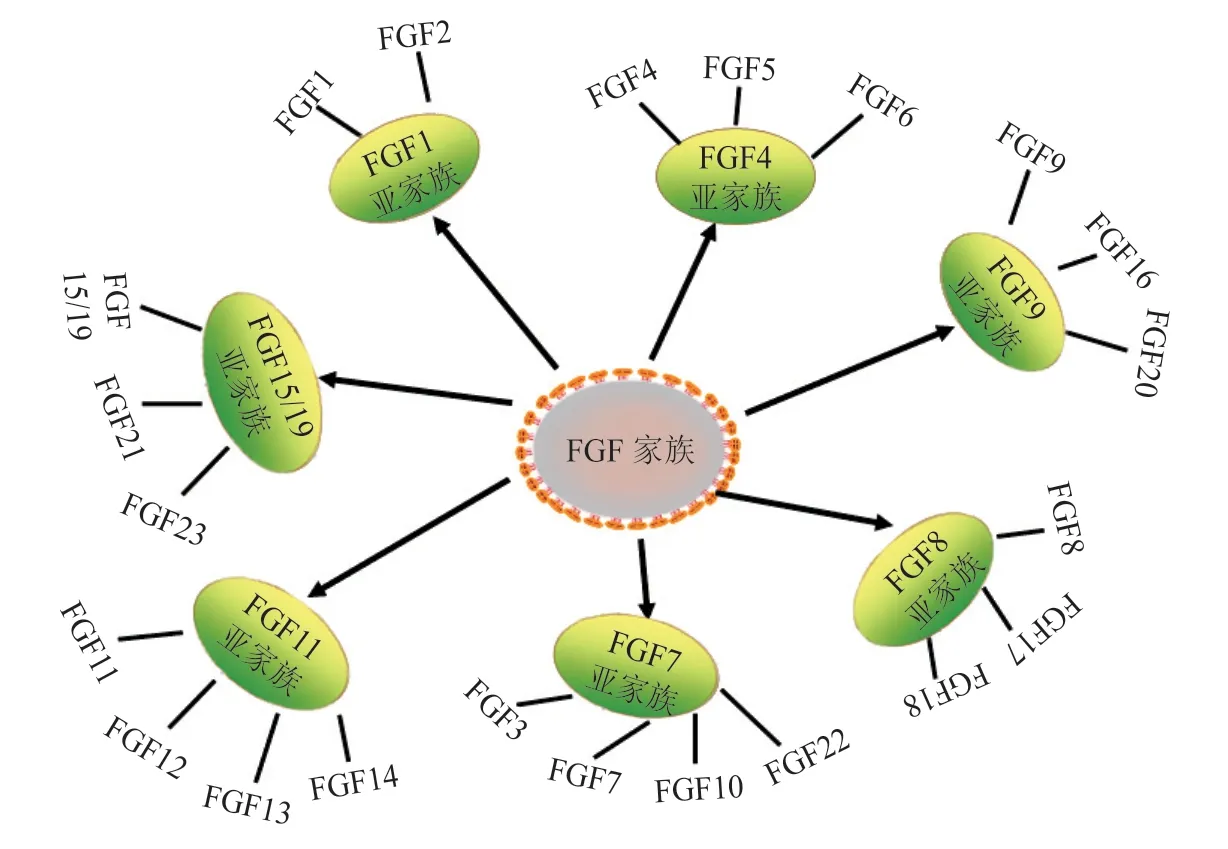
图2 FGFs家族成员分类示意图Figure 2 Diagram of classification of the FGFs

图3 FGFs在小鼠胰腺发育中的调控网络Figure 3 Diagram of FGFs transcriptional regulation network in mouse pancreas development
FGF2将人胚胎干细胞分化形成的定型内胚层以浓度依赖的方式指定为前肠和中肠的特定谱系,例如肝、胰、肺和肠的祖细胞,保留了在前肠内胚层中的功能[19-20]。最近, Dettmer等[21]利用人多能干细胞(human pluripotent stem cells,hPSCs)探究了FGF2、FGF7、FGF10和表皮生长因子(epidermal growth factor,EGF)对人胰腺发育的影响,发现FGF2在人类胰腺中的作用与动物模型不同。人体胰腺早期发育时,FGF2刺激音猥因子(sonic hedgehog,Shh)的表达,同时以剂量依赖的方式抑制Pdx1的表达。然而,小鼠胰腺发育的早期阶段,新生的胰腺内胚层分泌FGF2,抑制脊索Shh的表达[22-23]。因此,FGF2在动物和人体中的具体作用还需要进一步探究。
2.2 成纤维细胞生长因子4在小鼠胰腺发育中的作用
FGF4信号传导在内胚层中对Pdx1+细胞所在区域的前肠内胚层的分化进行调控[24-25],主要通过FGFR1c和FGFR2c发出信号,与维甲酸(retinoic acid,RA)共同促进内胚层的形成和胰腺的扩增(见图3),同时诱导胰腺标志物的表达。此外,FGF4可以主导形成导管样上皮的增生,阻遏外分泌的分化,这可能是由于间充质细胞为适应FGF4信号传导改变特性而引起的间接作用。已有研究表明,FGF4的异常表达导致上皮结构散乱分布于基质组织中,破坏胰腺形态的发生。同时,FGF4对Pdx1的表达调控呈现剂量依赖性,中等水平的FGF4表达量是维持Pdx1表达的重要条件之一,高水平的表达量则会抑制Pdx1的表达。因此,FGF4对内胚层的形成起一定的调控作用,进而影响胰腺早期发育过程[26]。
2.3 成纤维细胞生长因子9在小鼠胰腺发育中的作用
FGF9在胰腺间质中表达,可诱导胰腺间质中潜在的Sprouty相关的酪氨酸激酶结合蛋白1(Sprouty-related enabled/vasodilator-stimulated phosphoprotein homology 1 domain 1,Spred1)的表达。Sylvestersen等[27]在细胞实验中已经证明Spred和受体酪氨酸激酶的胞内负调节器(Sprouty,Spry)家族的一些成员在胚胎小鼠胰腺中表达,并发现Spred1/2以及Spry2/4主要表达于胰腺间质,由多种受体酪氨酸激酶(receptor tyrosine kinase,RTK)途径诱导。利用胚胎胰腺外植体培养,Sylvestersen等[27]证明Spred1/2和Spry2/4在FGF9的下游表达,通过FGF9的调控而增加。同时FGF2和FGF9可以激活FGFR的“c”亚型诱导间质Spred1/2和Spry2/4的表达,这是因为间质可以直接或间接对具有“c”亚型特异性的FGF信号作出反应。上皮-间质相互作用对胰腺的正常发育很重要,然而目前关于FGF向间质发出信号的研究依然很少,包括信号作用靶点、作用方式等,这些问题仍需要继续探索。
2.4 成纤维细胞生长因子7在小鼠胰腺发育中的作用
FGF7和FGF10促进胚胎胰腺上皮细胞的增殖和形态发生并参与胰腺上皮细胞的分化程序。尽管它们不改变从无间充质胰腺残基分化出的内分泌细胞的数量,但仍会诱导外分泌组织的发育。转基因小鼠中,在载脂蛋白启动子的控制下,FGF7的过表达会引起胰岛素表达的增加,这表明FGF7可能诱导内分泌细胞的分化[5,10]。另外,表达FGFR2b的胰腺上皮细胞的生长速度受到FGF7浓度的调控,同时抑制内分泌组织的发育,其中FGF7仅与FGFR2b结合,激活胰腺上皮细胞增殖,抑制内分泌细胞分化(见图3)[7]。
2.5 成纤维细胞生长因子10/FGFR2b/Sox9信号在小鼠胰腺发育中的作用
通过前期研究发现,FGF10-/-的小鼠出生致死,FGF10+/-的小鼠四肢和肺部发育异常,同时还表现出胰岛素表达细胞明显减少,这表明FGF10对胰岛功能具有调控作用。
Sry相关组蛋白9(SRY-related HMG-box gene 9,Sox9)是维持胰腺祖细胞中FGFR2b表达所需的细胞自主因子。FGFR2b通过细胞聚集以及自分泌和旁分泌作用形成簇进而调节内分泌胰腺的发育和分化[28]。Sox9形成了基因调控网络的核心,该基因调控网络对于正常器官生长和维持器官身份至关重要。在胰腺早期发育期间,Sox9+祖细胞特异性消融会引起胰腺到肝细胞命运的转换。Sox9缺乏则会导致FGFR2b+细胞自主丢失,而FGFR2b是转导间充质FGF10信号所必需的[29-30]。同时,又需要FGF10维持上皮祖细胞中Sox9和FGFR2b的表达。这表明Sox9、FGFR2b和FGF10在早期胰腺发育中形成前馈表达环[31]。这种自我促进的Sox9/FGF10/FGFR2b反馈环可在广泛的发育和再生环境中调节细胞身份和器官大小。有研究表明EGF、FGF10是胰腺再生期间的形态发生原,能够在体外刺激MAPK和蛋白激酶B(protein kinase B,PKB或AKT)的表达[32]。胰腺再生时,FGF10可以激活AKT,AKT再激活下游通路(见图3),通过保护导管祖细胞免受程序性死亡促进再生,这对导管细胞体外扩增以及β细胞置换的治疗过程具有一定的指导意义。
目前的研究中发现,早期FGF10缺失会抑制祖细胞的分化,影响内分泌腺的形成和成熟。对FGF10的理解和探究将有助于推动胚胎胰腺发育不良的治疗,但此过程中FGF10影响的具体路径和作用机制还需要深入挖掘。
2.6 成纤维细胞生长因子21在小鼠胰腺发育中的作用
FGF21是葡萄糖稳态的有效调节剂,通过具有酪氨酸激酶活性的细胞表面受体起作用,其合成和分泌可由多种代谢和细胞应激触发,比如饥饿和ER应激等。FGF21在调节β细胞增殖和胰岛素合成中发挥重要作用,主要通过调节生长激素(growth hormone,GH)信号传导来实现[33]。已有研究发现,FGF21抑制了胰岛中GH信号的传导,从而抑制GH诱导的胰岛素表达、β细胞增殖等过程[33],影响胰腺正常发育。
胰岛是FGF21的主要靶标之一,FGF21的缺失将直接影响胰岛功能和细胞的生长。葡萄糖诱导细胞外调节蛋白激酶1 / 2 (extracellular regulated protein kinases1/2,ERK1/2)的活化和核易位刺激胰腺β细胞中胰岛素基因的转录,FGF21通过激活ERK 1/2和AKT信号通路调控胰岛素含量,使胰岛素在2 h内恢复到基础水平[16]。研究表明,FGF21可以通过减少胰岛的糖脂毒性和细胞凋亡,进而保护糖尿病小鼠的β细胞不受损伤,但并不影响胰岛细胞的增殖,仅抑制因过度生长引起的β细胞的扩增[33]。在健康大鼠分离的胰岛中,FGF21增加了胰岛素的mRNA和蛋白质水平,并没有增强葡萄糖诱导的胰岛素分泌,但会增加糖尿病患者胰岛的胰岛素分泌和胰岛素含量,并通过激活ERK1/2保护细胞免于凋亡(见图3)[34]。以上研究表明FGF21是维持胰岛素敏感性、胰岛细胞正常生长、胰岛素合成和胰岛功能的关键因素。此外,FGF21通过与FGFR和抗衰老基因编码蛋白β-Klotho组成的酪氨酸激酶受体复合物刺激腺泡细胞分泌消化酶[6,35],缓解空腹/进食等生理条件下以及胰腺炎等病理条件下产生的内质网应激。
2.7 成纤维细胞生长因子23在小鼠胰腺发育中的作用
FGF10和FGF23是腹侧胰腺正常发育必需的,并通过内胚层发送信号激活P48的起始表达。有研究发现,FGF10和FGF23对胰腺和肝脏这2个器官具有完全相反的作用,二者共同诱导胰腺标志物的表达,同时抑制肝脏标志物表达。当体内缺乏这2种生长因子时,肝脏会向后扩展,损害胰腺中Pdx1+细胞,引起发育畸形。胰腺腹侧中胚层(lateral plate mesoderm,LPM),它可以释放调控信号,控制腹芽的规格和生长,从而形成外分泌腺[14,36-37]。胚胎发育早期,内胚层表达FGF23基因,介导从内胚层到中胚层的信号传导,触发胰腺LPM模式。FGF10与FGF23作用于胰腺外侧LPM,两者共同促进腹胰发育[38]。当FGF23表达缺失,腹芽的发育被推迟但不被阻断,这个过程中背芽的发育基本没有受到影响。因此,FGF23主要在建立胰腺LPM的模式和腹芽的规格中发挥作用[39]。
3 结语和展望
小鼠胰腺发育过程中,存在易受不适条件攻击的关键时期,尤其是体内信号阻断或缺失将会对机体造成不可逆的损伤,包括出生后发育缺陷、器官功能低下,以及成年后潜在疾病的发生发展。本文中,FGFs及其受体参与调控胰腺发育过程,胰腺发育早期,FGF2促进细胞簇形成,FGF4促进内胚层的分化、形成,并主导导管样上皮的增生,为胰腺的形成和成熟奠定基础,但FGF2在人体和动物中的作用机制有差别。FGF7、FGF9、FGF10表达于胰腺间质,FGF9调控间质Spry和Sproud信号传递。而FGF7和FGF10同属于FGF7亚家族,主要激活在上皮细胞表达的FGFR2b受体,FGF10、FGFR2b与SOX9又形成反馈环,调控胰腺祖细胞增殖分化,诱导内外分泌祖细胞准确分化为腺泡、导管和胰岛祖细胞,这是胰腺正常演变的必要条件。FGF21通过β-Klotho激活AKT、ERK信号通路,保护胰岛正常功能。这些结果表明不同的FGF对胰腺内外分泌的调控作用和机制不同,需要对其深入挖掘,明确FGF的作用靶点,为疾病的治疗打下坚实基础。

