PD-1在急性白血病异基因造血干细胞移植后T淋巴细胞的表达
刘建宁, 孙 立, 牛志云, 温树鹏, 王 颖, 张学军, 王福旭
(河北医科大学第二医院血液科;河北省血液病重点实验室, 河北 石家庄 050000)
异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation, allo-HSCT)通过移植物抗白血病效应(graft-versus-leukemia, GVL)实现了对血液系统恶性肿瘤的治愈效果,执行GVL的供者T淋巴细胞经历活化扩增及效应的过程后清除白血病细胞,成为中高危急性白血病(acute leukemia,AL)有效的治疗手段。而移植后复发是allo-HSCT后最常见的死亡原因。一旦复发,预后很差,总体5年生存率仅为5%[1-2]。目前针对复发的治疗手段有:调整免疫抑制剂、补救性放疗化疗、去甲基化药物治疗、细胞治疗、靶向治疗等[3]。这些方案能起到一定程度上的改善效果,但结果仍不理想。白血病复发的可能原因包括白血病细胞的耐药机制,其生物学特性出现改变,对GVL效应不敏感从而实现免疫逃逸;也有研究表明白血病细胞丢失了不相合的HLA单倍体表型,导致主要或次要组织相容性复合体表达降低,不被免疫细胞识别从而复发;而肿瘤通过激活以程序性死亡蛋白1(PD-1)为代表的免疫检查点转导的负调控通路来抑制免疫反应逃避免疫的机制愈受重视。PD-1是表达于T淋巴细胞的免疫抑制性受体,肿瘤细胞浸润的T淋巴细胞PD-1的表达突出明显,活化的T淋巴细胞经抗原识别后表达PD-1,并分泌干扰素,诱导组织中其配体(programmed death ligand-1,PD-L1)的表达,肿瘤细胞表达PD-L1与PD-1结合,抑制T淋巴细胞功能。本研究收集2019年3月至2020年2月于河北医科大学第二医院行allo-HSCT患者40例的临床资料,同期健康者23例,动态比较两组T淋巴细胞PD-1的表达水平,重点分析移植后患者T淋巴细胞表面PD-1表达水平变化及临床意义,以便为后期治疗提供参考,报道如下。
1 资料与方法
1.1研究对象 本研究所观察患者组病例均来自2019年3月至 2020年2月于河北医科大学第二医院行allo-HSCT患者40例,男21例,女19例,平均年龄(33.30±10.67)岁;急性髓细胞白血病(AML)21例,急性淋巴性细胞白血病(ALL)16例,慢性粒细胞白血病(CML)加速期 1例,急性混合细胞白血病(MPAL)2例。同期健康志愿者23例,设为健康对照组,其中男性15例,女性8例,平均年龄(45.65±10.40)岁。所有患者均通过细胞形态学、免疫学、分子生物学及细胞遗传学等检查确诊,符合恶性血液病诊断标准[4]。研究均获得患者的知情同意并签署知情同意书,符合2013年修订的《赫尔辛基宣言》的要求。
1.2移植情况 移植患者移植前原发病危险分层:高危17例,中危16例,低危7例[5-6]。移植均为亲缘供者,其中人类白细胞抗原(HLA)全相合12例,单倍型相合28例。干细胞来源:外周血干细胞(PBSC)10例,因国内外研究表明采用脐带血等第三方细胞辅助allo-HSCT等促进供者造血干细胞植入,降低GVHD发生率,减少复发死亡率,改善allo-HSCT预后[7-9],故研究对象中有30例患者干细胞源于PBSC+脐带血(CB)。血型相合20例,血型不合20例,供受者性别相同22例,不同18例。
1.3预处理方案 均采用清髓预处理方案,剂量均遵从中国allo-HSCT治疗血液系统疾病专家共识(I)[10]。见表1。

表1 移植患者组清髓预处理方案
1.4干细胞动员、采集及回输 动员应用重组人粒细胞集落刺激因子(rhG-CSF)皮下注射,rhG-CSF(5-10 μg/kg·d),4~7天。第4~7天采集外周血干细胞,采集目标为MNC≥5×108/kg受者体重,CD34+细胞≥2×106/kg受者体重。本研究患者回输细胞情况为MNC中位数9.883(7.199, 13.261)×108/kg受者体重,CD34+细胞中位数4.434(3.621, 5.795)×106/kg受者体重。
1.5植入情况 移植效果以造血干细胞回输后连续3天中性粒细胞计数>0.5×109/L的第1天为粒细胞植入;不依赖血小板连续输注7天血小板计数>20×109/L的第1天为血小板植入。
1.6移植物抗宿主病(GVHD)的诊断与治疗 移植后急性、慢性移植物抗宿主病参照NIH 2005[11]、NCI 2011[12]标准进行诊断和评估。GVHD的常规预防采用环孢素A(CsA)+吗替麦考酚酯(MMF)+短疗程甲氨蝶呤(MTX)+芦可替尼,CsA起始剂量1.5 mg/kg每12小时1次,静脉输注,-1天开始,消化道症状消失后改为口服,一般移植后3个月逐渐减量,6个月停用,根据复发风险和GVHD情况酌情缩短或延长其应用时间,MTX于+1、+3、+6天给药,并于用药24小时后给予甲酰四氢叶酸钙解救,个别患者给予预防性供者淋巴细胞输注(DLI)。GVHD的治疗首先根据环孢素浓度适当调整CsA用量,同时给予甲泼尼龙1~2 mg/kg,若病情3天后进展或5~7天后未缓解,考虑给予MTX、注射用重组人II型肿瘤坏死因子受体抗体融合蛋白、抗CD25单克隆抗体等二线药物治疗[13]。
1.7病情监测 分别于移植后1、2、3、4.5、6个月留取患者外周血、骨髓,进行血常规、骨髓细胞形态学、微小残留检测、融合基因、细胞遗传学、分子生物学等检测,骨髓、外周血供受者DNA嵌合、性染色体错配的监测,以评估患者疾病状态。微小残留检测采用荧光素标记的单克隆抗体及流式细胞仪检测细胞抗原的表达及表达量,本研究MRD阳性复发的患者6例,其中,AML 3例、B-ALL 1例、T-ALL 1例、MPAL 1例,分别于移植后0.5、1.5、9、17、2、3个月复发,同时留取外周血标本监测PD-1的表达水平。
1.8PD-1检测 实验所需试剂均购于Biolegend公司,应用流式细胞仪(品牌:美天旎,型号:MACSQuant 10)检测外周血标本PD-1在CD3+CD4+, CD3+CD8+T淋巴细胞的表达水平。各取100 ul抗凝处理后全血加入到2个EP管中,向管1中加入2 ul CD8 Pacific Blue(货号301033)、PD1-FITC(货号329904)、CD4-PE/CY7(货号300512)、CD3-APC/CY7(货号300426)、7AAD(货号420404),管2中加入同型对照CD8 Pacific Blue、IgG1-FITC(货号78080)、CD4-PE/CY7、CD3-APC/CY7、7AAD混匀,于4℃环境下避光孵育10 min;离心后弃上清液,并加入裂解液混匀,室温避光10-15 min以裂解红细胞。裂解后离心弃上清,加入FBS,重悬细胞,上机检测。应用Flowjo软件分析:圈定细胞门P1门后,在P1门内设置CD3/SSC显示CD3占所有有核细胞的比例;在CD3门内,以“十字门”的方式画出CD4+PD1+/CD4-PD1+细胞;另外再在CD4门和CD8门内以画出PD-1+细胞的比例。
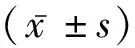
2 结 果
2.1移植后PD-1在CD3+CD4+、CD3+CD8+T淋巴细胞的表达水平变化 移植后1~6个月PD-1在CD3+CD4+、CD3+CD8+T细胞的表达水平差异有统计学意义(P=0.002),且表达水平呈现逐渐下降的变化。见表2、图1。

表2 PD-1在T淋巴细胞的表达水平
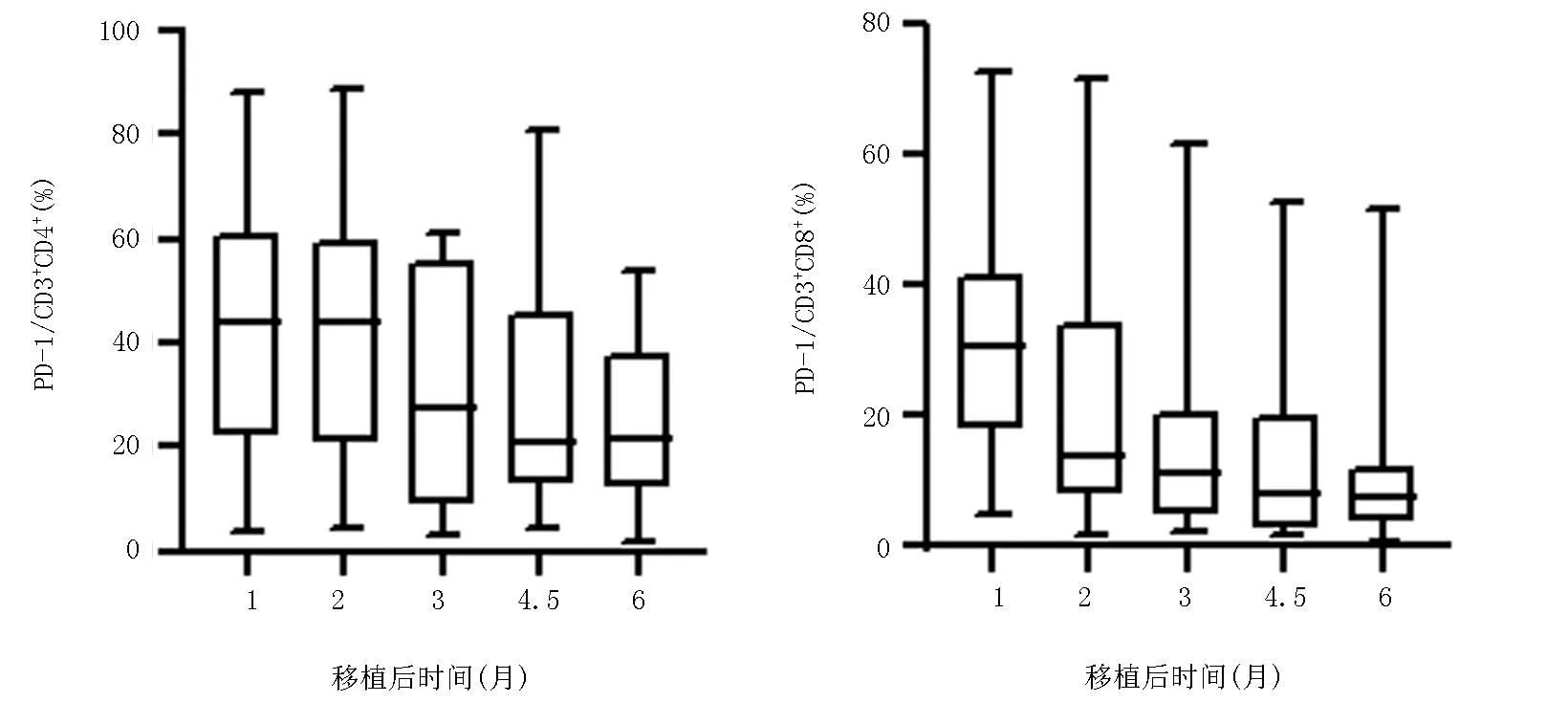
图1 移植组PD-1表达水平随移植后时间的变化
2.2移植组1~6个月与对照组PD-1的表达水平比较 结果发现移植后1~6个月PD-1在CD3+CD4+T细胞的表达水平逐渐下降,但均高于对照组,移植后表达水平最低的第6个月和对照组PD-1的表达水平差异有统计学意义(U=54.000,P=0.003);移植组PD-1在CD3+CD8+T细胞的表达水平在移植后1、2个月高于对照组(U=44.000,P<0.01),移植后3、4.5、6个月CD3+CD8+T细胞和对照组PD-1的表达水平比较差异无统计学意义(U=115.000,125.000,110.000,P=0.267,0.434,0.202)。
2.3PD-1表达水平对MRD阳性复发的提示意义 根据34例MRD阴性组患者T淋巴细胞PD-1的表达数据,分别统计移植后1、2、3、4.5及6个月不同时间点表达水平的均值范围。本研究中MRD阳性复发患者6例,其中4例未于MRD阳性复发前采样检测均不纳入统计,1例复发患者在MRD复发前曾行DLI治疗,PD-1表达水平低于未DLI组,故未纳入MRD阳性组分析,剩余1例患者复发前3个月(移植后6个月)PD-1在CD3+CD4+、CD3+CD8+T细胞的表达水平54.20%;37.30%,高于总体均值范围(29.27±15.08)%;(17.18±17.50)%。
3 讨 论
allo-HSCT作为治愈AL的主要治疗方案,移植物存在抗白血病效应(GVL)是造血干细胞移植能够治愈AL的主要机制。而移植后复发,严重影响着移植后患者的长期生存时间和状态,可能由GVL效应丢失导致。目前研究分析GVL效应丢失的原因:①白血病细胞HLA Ⅱ类分子丢失;②白血病细胞获得新的基因突变;③T淋巴细胞PD-1表达上调;④白血病细胞PD-L1表达升高。
PD-1作为CD28家族的成员之一,表达于T淋巴细胞、单核细胞、树突状细胞等多种免疫细胞,通过与其配体PD-L1相互作用引起T细胞衰竭而发挥负性免疫调控效应[14]。其转导的信号通路干扰T细胞的活化和增殖,使T细胞处于衰竭状态,免疫细胞功能差,抑制性受体持续表达,妨碍免疫系统对感染和肿瘤细胞的最佳控制[15]。Simonetta等[16]分析了105例allo-HSCT受者分离的T细胞亚群上PD-1的表达,结果显示allo-HSCT后表达PD-1的CD3+CD4+和CD3+CD8+T细胞的比例在移植后早期明显增加,且PD-1在CD3+CD8+T细胞表面的表达只呈现了一过性增加,随时间推移逐渐趋于正常化,而在CD3+CD4+T细胞表面的表达呈现早期和长期的增加,虽有下降趋势,但在研究的所有时间点中(包括allo-HSCT后5年以上的患者),其表达比例仍明显高于健康对照水平。本研究显示,allo-HSCT后1个月到6个月PD-1在CD3+CD4+T细胞的表达一直处在高于健康者的水平,但有明显的下降趋势;而在CD3+CD8+T细胞的表达虽然也呈下降趋势,但在3个月开始,与健康者水平差异无明显统计学意义,与之前报道吻合。表明allo-HSCT后PD-1在CD3+CD4+和CD3+CD8+T细胞表面的表达变化过程不同,CD3+CD4+T细胞表面PD-1表达上调持续时间相对长,不除外持续性升高,需延长研究时间证实;而CD3+CD8+T细胞表面PD-1则呈现瞬时过表达的特点。
同时Kong等[17]研究了allo-HSCT的AML患者11例外周血样本并进行流式细胞术检测,其中5例在移植后2~6个月出现白血病复发,余6例在采血点(移植后3~6个月)一直处于缓解状态,结果发现在复发患者中始终检测到高表达PD-1的细胞比例增加,提示PD-1在allo-HSCT后白血病复发中有着预测价值。Noviello等[18]研究了PD-1等抑制性受体在32例AML患者的骨髓浸润T细胞的表达在allo-HSCT后复发或完全缓解后的差异,发现移植后复发的患者PD-1在CD3+CD8+T细胞表达的比例均高于缓解的患者。本研究中分析复发患者复发前PD-1表达水平与对应移植后时间点未复发患者组表达水平的总体均值,发现了复发前PD-1在CD3+CD4+、CD3+CD8+T细胞的表达水平高于未复发总体的现象。如报道所言,PD-1表达上调,其介导的信号通路抑制T淋巴细胞的功能活化,减少T淋巴细胞的增殖,增加T细胞功能缺陷。以此可推测,当移植后患者PD-1检测表达升高时,衰竭T细胞增加,机体免疫下降,从而促进肿瘤细胞逃脱免疫监视,导致疾病复发。
基于以上研究,目前PD-1抑制剂在allo-HSCT后患者的治疗中应用逐渐增多。Berger等[19]在pidilizumab的I期临床试验中,应用于8例AML晚期患者,其中4例曾行allo-HSCT,1例于口服pidilizumab第21天外周幼稚细胞从50%降至5%,提示PD-1抑制剂的抗肿瘤效果。Ravandi等[20]曾在对AML患者的治疗中应用nivolumab,44例患者中有42例AML患者,2例MDS高危患者,给予患者诱导化疗的同时,在第1~3天使用nivolumab,3 mg/kg,应答者接受最多5个巩固周期或行allo-HSCT,结果显示44例患者中34例(78%)患者达到完全缓解(CR)或部分缓解(CRi),其中在应答时有微小残留病的16例患者中9例(56%)给予了nivolumab维持治疗并在1~3个月后微小残留病转为阴性。然而,PD-1抑制剂应用有效的同时,GVHD似乎也有所增加或加重的可能。Ravandi等[20]研究的44例患者中18例行allo-HSCT,其中13例(Ⅰ~Ⅱ级8例,Ⅲ~Ⅳ级5例)发生aGVHD。Haverkos等[21]对接受PD-1抑制剂治疗的31例allo-HSCT后复发的淋巴瘤患者进行了多中心回顾性分析,病例中8例(26%)死亡患者与抗PD-1治疗后新发GVHD有关,17例(55%)在开始使用抗PD-1后出现治疗应急型GVHD(6例急性,4例重叠,7例慢性),9例为Ⅲ~Ⅳ级的急性或重度慢性GVHD,表明PD-1抑制剂治疗可能并发严重和难治的GVHD。虽然也有恶性肿瘤移植后复发的早期临床试验中,未发现ipilimumab治疗会诱发或加剧GVHD[22];Simonetta等[16]在分析T细胞表面PD-1的表达与移植后并发症的关系时,也未检测到aGVHD患者CD4+、CD8+T细胞上PD-1的表达有显著差异,表明GVHD对allo-HSCT后T细胞上PD-1表达的影响很小。但PD-1抑制剂的临床应用在令研究者怀有希望的同时因是否直接影响GVHD的发生而受阻,如何分离GVL效应和GVHD,在加强GVL效应的同时最大程度的减少或减轻GVHD还需进一步研究,如联合其他免疫检查点抑制剂、减少应用剂量等。
综合文献及研究结果,急性白血病患者移植后早期PD-1在CD3+CD4+T淋巴细胞的表达较正常水平升高且随移植时间呈现下降趋势;在CD3+CD8+T淋巴细胞的表达于移植后早期呈现一过性升高。早期应用免疫抑制剂可能会减少复发,但对GVHD的相关性及预防需进一步研究。

