莳萝蒿精油成分分析及抑菌活性机理探究
霍归国,梁婷玉,黄志芸,白增福,陈学林*,张 继,3
(1 西北师范大学 生命科学学院,兰州 730070;2 甘肃省特色植物有效成分制品工程技术研究中心,兰州 730070;3 西北师范大学,新农村发展研究院,兰州 730070)
莳萝蒿(ArtemisiaanethoidesMattf.)为菊科蒿属植物,又名小碱蒿,一或二年生草本,植株具有浓烈香气,花果期为6~10月,产于黑龙江、吉林、辽宁、内蒙古、河北、山西、陕西、宁夏、甘肃、青海、新疆、山东(北部)、河南(北部)和四川(北部)等地。其通常生长在干山坡、河湖边沙地、荒地、路旁等,盐碱地附近尤多,在草原、半荒漠草原与森林草原附近也有所分布,在低湿、盐渍化的局部地区可成为区域性植物群落的优势种或次优势种,常侵入到旱田里,成为田间有害杂草之一[1]。有研究表明,莳萝蒿与茵陈蒿均具有较强的利胆作用,且莳萝蒿毒性小,药效持久,民间常采其基生叶作为中药“茵陈”的代用品,有一定的药用价值[2]。
随着人们对食品安全的关注和环保意识的增强,许多天然植物的活性成分被提取出来并应用于抑菌和保鲜等诸多方面,植物精油就是一种十分良好的天然活性物质。近年来,有研究表明,多种蒿属植物精油均具有良好的抑菌作用[3-7]。时至今日,关于莳萝蒿精油的报道并不是很多,有学者发现,莳萝蒿精油对仓储害虫显示出良好的驱虫活性[8],但目前还没有对于其抑菌活性等方面的研究。因此,本研究对莳萝蒿精油的成分进行分析,并对其抑菌活性和抑菌机理进行初步探究,旨在为莳萝蒿精油的进一步开发利用提供参考和理论依据。
1 材料和方法
1.1 仪 器
DRT-TW型调热电热套、JY2002型电子天平,(力辰科技公司);Thermo PolarisQ GC-MS(美国);YXQ-SG46-280S高压灭菌锅,(北京中西公司);恒温摇床,(上海天呈公司);干燥箱,(厦门海达精密仪器有限公司);紫外可见光分度计,(北京莱伯泰科仪器有限公司);酶标仪,(上海酶联生物科技有限公司);电导率仪,(上海科晓科学仪器有限公司)。
1.2 材料试剂
莳萝蒿采自甘肃省陇南市礼县,经西北师范大学生命科学学院陈学林教授鉴定为菊科蒿属植物莳萝蒿。酵母提取物、蛋白胨、琼脂(北京索莱宝科技有限公司);无水硫酸钠、无水乙醇、氯化钠(国药集团化学试剂有限公司);葡萄糖、磷酸氢二钠、磷酸二氢钠等购自中华试剂网。
金黄色葡萄球菌(Staphylococcusaureus,CMCC 26003)和大肠杆菌(Escherichiacoli,ATCC 25922)由西北师范大学生命科学学院微生物实验室提供,在液体培养基37 ℃条件下培养12 h,接种在LB琼脂培养基中4 ℃保存。
1.3 方 法
1.3.1 精油提取取莳萝蒿地上部分去除灰土并粉碎过筛,称取50 g放入圆底烧瓶中,加入1 000 mL蒸馏水,浸泡5 h,水蒸气蒸馏6 h,获得挥发油后加入适量无水硫酸钠除去其中水分,冷藏备用。
1.3.2 GC-MS分析条件采用石英毛细管柱HP-5MS,30 m × 0.25 mm,膜厚0.25 μm;载气:He;柱流量:1 mL/min;EI 源;电离电压:70 eV;离子源温度:250 ℃;扫描范围:50~650 amu;进样量:1 μL;分流比为10∶1。以40 ℃为初始温度,保留1 min,然后以3 ℃/min升温至200 ℃,保留5 min,再以5 ℃/min升至250 ℃,保留1 min。
1.3.3 抑菌圈直径采用滤纸扩散法测定莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的抑菌圈直径。莳萝蒿精油用0.22 μm的有机相微孔滤膜过滤,将100 μL培养过夜的菌悬液(1×107CFU/mL)涂布在琼脂平板上,取3个直径为6 mm无菌滤纸片放置在涂布完毕的琼脂平板上,其中2张滤纸片上滴加10 μL莳萝蒿精油,另1张滤纸片滴加等量的无菌水作为空白对照,放入37 ℃培养箱培养24 h,测定其抑菌圈直径[9-10],每组试验进行3次重复。
1.3.4 最小抑菌浓度(MIC)和最小杀菌浓度(MBC) 最小抑菌浓度和最小杀菌浓度的测定采用二倍稀释法,参照SAYED和CHIKEZIE等[11-12]方法。取摇菌管6个,分别标号为1~6号,1号加入600 μL莳萝蒿精油和120 μL吐温80,最后加入280 μL培养液,2~6号均加入500 μL培养液。从1号管中吸取500 μL加入2号管,再从2号管中吸取500 μL加入3号管,依次逐级稀释,每次吸取前用振荡器混匀。分别吸取20 μL稀释好的莳萝蒿精油加入微孔板中,并在每个微孔板中加入170 μL培养液和10 μL菌悬液,最终使微孔板中的精油分别达到60、30、15、7.5、3.75和1.625 μL/mL等一系列浓度梯度。将仅加入10 μL菌悬液和190 μL培养液的微孔作为阳性对照,仅加入12 μL吐温80和188 μL培养液的微孔作为阴性对照。将96孔板放入培养箱中在37 ℃下培养24 h,无明显可见细菌生长的最小精油浓度为最小抑菌浓度,涂布后完全不长菌的最小精油浓度为最小杀菌浓度[13],每组试验进行3次重复。
1.3.5 抑菌时间曲线生长曲线的测定依据Zeng等[14]方法。首先将精油与吐温80混匀并加入一定量的培养液,使最终浓度分别为0.5 MIC(最小抑菌浓度)、1 MIC和2 MIC,并将对数生长期的大肠杆菌和金黄色葡萄球菌稀释至1×107CFU/mL,之后取20 μL不同浓度的精油和10 μL菌悬液分别加入96孔板中,最后在每个微孔中加入170 μL培养液,只加菌悬液和培养液的一组作为对照。在37 ℃和120 r/min条件下培养,分别在0、2、4、6、8、10和12 h时测定其在600 nm处的吸光度,每组试验进行3次重复。
1.3.6 电导率经不同浓度精油处理后大肠杆菌和金黄色葡萄球菌细胞膜通透性的测定依据Kong等[15]方法。在37 ℃下,将大肠杆菌和金黄色葡萄球菌在培养液中培养12 h,之后以4 000 r/min离心10 min。将5%的葡萄糖溶液在沸水中加热5 min后的电导率记为L0,不同浓度精油 [0、MIC(最小抑菌浓度)、MBC(最小杀菌浓度)] 加入到5%的葡萄糖溶液中电导率记为L1,将细胞用5%的葡萄糖溶液洗3次,使其电导率与5%的葡萄糖溶液相近,再加入不同浓度的精油(0、MIC、MBC)完全混匀后在37 ℃下培养24 h,电导率记为L2。相对电导率的计算公式为:相对电导率(%)=(L2-L1)/L0×100,每组试验进行3次重复。
1.3.7 扫描电镜制备金黄色葡萄球菌的菌悬液,浓度约为1×107CFU/mL,分别用0、MIC、MBC浓度的精油37 ℃下处理4 h,之后在4 ℃下以4 000 r/min离心10 min,所得细胞用PBS洗涤3次,4 ℃下用2.5%戊二醛固定6 h。再次用PBS洗涤3次后用乙醇(30%、50%、70%、80%、90%和100%)梯度脱水15 min,进行喷金处理,在扫描电镜下观察[16]。
1.4 数据分析
数据统计和绘图采用Excel 2019和Origin 2019,通过SPSS 13.0进行显著性分析。多重比较采用Duncan法,以P<0.05为显著性差异。
2 结果与分析
2.1 莳萝蒿精油得率及成分
经水蒸气蒸馏所提取的莳萝蒿精油颜色为淡黄色,具有浓烈香气,得率为0.011 2 g/100 g。经GC-MS测定后,莳萝蒿精油的总离子流图和化学成分分别如图1和表1所示。其中,含量在0.5%以上的化合物共有34种,占总含量的81.09%,主要包括醇类(47.12%)和萜烯类(19.90%),以及少量酮类(5.04%)和酯类(1.12%)等。在所有成分中,桉油精(12.39%)含量最高,其次为松油醇(8.70%)和匙叶桉油烯醇(7.76%)等。Liang等[8]和张世尧等[17]均有研究表明,莳萝蒿精油的主要化学成分为桉油精,与本研究结果相一致。此外,两项研究发现,莳萝蒿精油中含量较高的成分还有松油醇、松香芹酮、松香芹醇以及石竹烯等,这也与本试验结果相类似。然而,各成分的含量有所差异,这可能与不同采样地的气候以及海拔等地理环境因素有关。该研究中的样品采于甘肃陇南地区,而其余两项研究中的样品分别采自甘肃甘南和山东菏泽地区。

表1 莳萝蒿精油的化学成分

图1 莳萝蒿精油总离子图Fig.1 Total ion figure of Artemisia anethoides Mattf. essential oil
2.2 抑菌活性
2.2.1 抑菌圈精油的抑菌圈直径可反映细菌对精油的敏感程度,通常按照如下划分:抑菌圈直径小于8 mm,为不敏感;抑菌圈直径8~14 mm,为中度敏感;抑菌圈直径14~20 mm,为敏感;抑菌圈直径大于20 mm,为高度敏感[18]。莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的抑菌效果见图2和表2。在图2中,A和B分别为莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的抑菌圈。结果表明,莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为(15.36±0.71) mm和(22.57±1.68) mm,大肠杆菌对莳萝蒿精油敏感,金黄色葡萄球菌对莳萝蒿精油高度敏感。

A. 精油对大肠杆菌的抑菌圈;B.精油对金黄色葡萄球菌的抑菌圈

表2 莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的抑菌圈直径
2.2.2 最小抑菌浓度(MIC)和最小杀菌浓度(MBC) 莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)如表3所示。莳萝蒿精油对金黄色葡萄球菌和大肠杆菌的MIC分别为3.25和7.5 μL/mL,MBC分别为7.5和15 μL/mL,对两种菌均显示出了良好的抑菌活性,而对照组没有表现出任何的抑菌效果。

表3 莳萝蒿精油的最小抑菌浓度和最小杀菌浓度
2.2.3 生长时间曲线为了更进一步研究莳萝蒿精油的抑菌活性,在该项研究中绘制了莳萝蒿精油的抑菌时间曲线。在图3中,A和B分别为莳萝蒿精油对大肠杆菌和金黄色葡萄球菌的抑菌曲线。结果显示,随着时间的延长,经莳萝蒿精油处理后的两种菌的吸光度值均小于对照组。对于大肠杆菌,当莳萝蒿精油浓度为0.5 MIC(3.25 μL/mL)时,其对大肠杆菌的抑制作用不明显,只是能够延缓大肠杆菌的生长,当莳萝蒿精油浓度为1 MIC(7.5 μL/mL)和2 MIC(15 μL/mL)时,其能够完全抑制大肠杆菌的生长。对于金黄色葡萄球菌,当莳萝蒿精油浓度为0.5 MIC(1.625 μL/mL)时,其对金黄色葡萄球菌的生长具有较强的抑制作用,能够延缓金黄色葡萄球菌的生长,当莳萝蒿精油浓度为1 MIC(3.25 μL/mL)和2 MIC(7.5 μL/mL)时,其可以完全抑制金黄色葡萄球菌的生长。该研究结果表明莳萝蒿精油对大肠杆菌和金黄色葡萄球菌均具有明显的抑制作用,且抑制效果随着剂量的增加而加强。
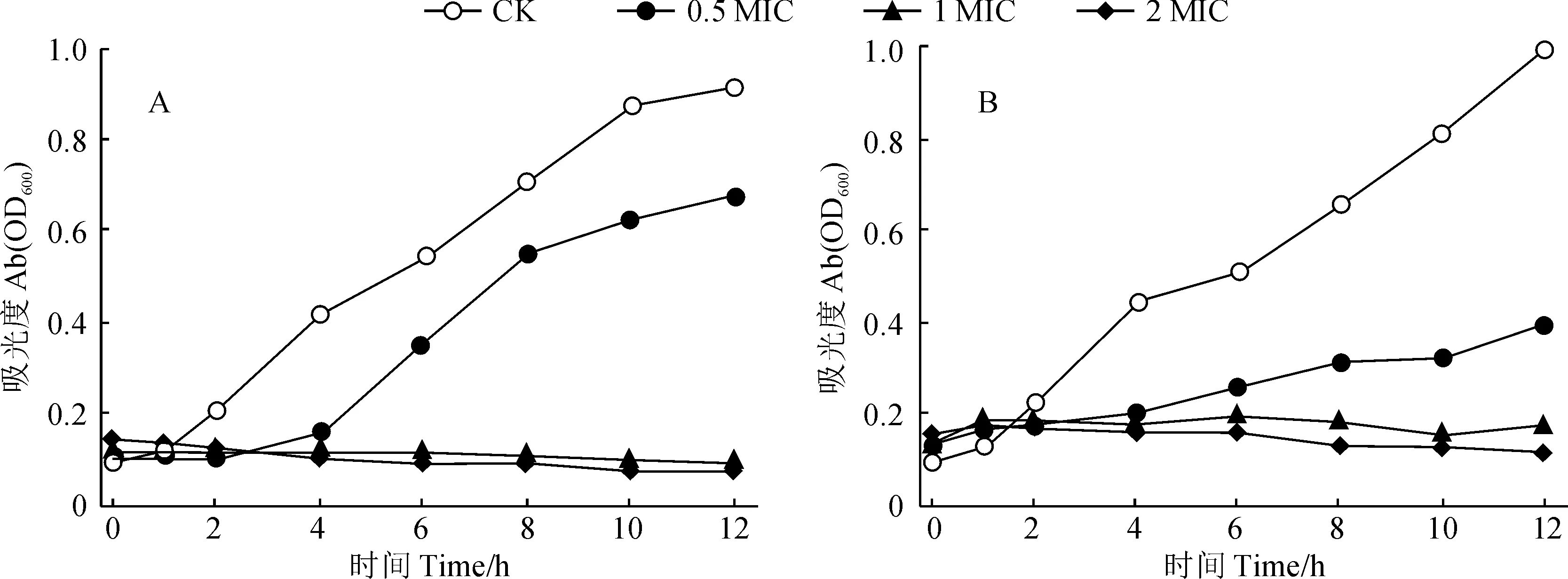
A.精油对大肠杆菌的抑菌曲线;B.精油对金黄色葡萄球菌的抑菌曲线
2.3 抑菌机制
2.3.1 电导率细菌的细胞质膜是细菌的通透性屏障,对调节细胞内外钠、钾、钙等离子的浓度,调节细胞能量代谢、物质运输以及维持细胞内环境的稳定均起着至关重要的作用[16]。本研究用不同浓度的莳萝蒿精油对大肠杆菌和金黄色葡萄球菌进行处理后,测定了其相对电导率,结果如图4所示。经不同浓度莳萝蒿精油处理后,大肠杆菌和金黄色葡萄球菌的相对电导率均显著高于对照组,且相对电导率随着精油浓度的增加而增大。有研究表明,肉桂精油能够使大肠杆菌和金黄色葡萄球菌细胞膜的通透性发生改变,从而导致细胞内大量的电解质外泄,致使细胞死亡[19]。此外,茴香籽油也能够使痢疾杆菌的电解质发生泄漏,导致细胞死亡[10]。因此,在该研究中,莳萝蒿精油也很有可能改变了两种菌细胞膜的通透性,导致大量电解质外泄,从而表现出抑菌的效果。
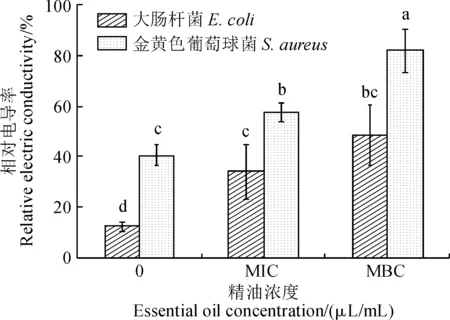
不同小写字母表示处理间在0.05水平差异显著(n=3)
2.3.2 扫描电镜为了更直观地展示莳萝蒿精油对细菌细胞形态结构的损伤,以金黄色葡萄球菌为研究对象,经不同浓度莳萝蒿精油处理之后进行扫描电镜观察,结果如图5所示。图5,A显示,空白组金黄色葡萄球菌呈球形,其表面光滑,形态较为规整,无明显凹陷和破碎;图5,B为经MIC浓度的精油处理之后的金黄色葡萄球菌,可以观察到部分细胞发生了萎缩凹陷;图5,C为经MBC浓度的精油处理之后的金黄色葡萄球菌,部分细胞的形态发生了较为严重的畸变,表面变得崎岖且不规则,并有内溶物的泄漏。该研究结果表明,莳萝蒿精油作用于金黄色葡萄球菌,会导致其细胞膜发生畸变和损伤破裂,并伴有内溶物的泄漏。因此,莳萝蒿精油的抑菌作用模式可能与细胞膜结构的改变直接相关,最终导致了细胞活力的丧失。
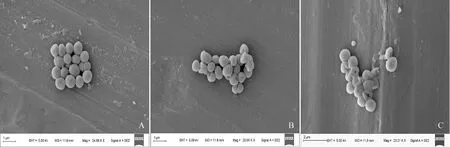
A.处理4 h后的空白组;B.处理4 h后的MIC组;C.处理4 h后的MBC组
3 讨 论
近年来,有关蒿属植物精油抑菌活性和抗氧化等方面的研究逐渐火热起来[20-22]。莳萝蒿作为一种天然的野生植物,精油中富含醇类、萜烯类和酮类等多种活性物质,其中桉油精、松油醇和匙叶桉油烯醇等物质含量较高。近年来有研究发现,桉油精具有催眠镇静和治疗精神紊乱的作用[23],此外,其在驱虫方面也表现出了良好的效果[8,24-25],松油醇在抑郁症治疗等方面具有显著的效果[26],而匙叶桉油烯醇有一定的镇痛作用[27]。由此可以看出,莳萝蒿精油中的桉油精和松油醇等多种成分均显示出了十分良好的生物活性。
截止目前,还没有对莳萝蒿精油抑菌活性的报道,因此无法与其他研究进行直接比较。陈玉梅等[28]研究发现,艾叶精油中也含有较高含量的桉油精和松油醇等物质,桉油精含量高于松油醇,且抑菌结果显示艾叶精油对金黄色葡萄球菌和大肠杆菌均表现出了良好的抑菌活性,对金黄色葡萄球菌的抑菌作用更强,这与本研究结果相类似。艾飞翔等[6]对延安产白蒿精油进行了成分分析并进行了抑菌活性研究,结果发现白蒿精油中桉油精和松油醇含量很低,其对金黄色葡萄球菌没有抑菌活性,对大肠杆菌的抑制作用也十分微弱[6]。因此可以推测,莳萝蒿精油对金黄色葡萄球菌和大肠杆菌表现出良好的抑菌活性在很大程度上可能与其所含桉油精和松油醇等主要成分密切相关。另外,在该研究中,相比大肠杆菌,莳萝蒿精油对金黄色葡萄球菌的抑制作用更明显,这可能是由于两种菌细胞壁结构上的差异所造成的。有研究表明,金黄色葡萄球菌的细胞壁只是单层的肽聚糖结构,对外来入侵分子的抵制能力较弱,而大肠杆菌的细胞壁结构较为复杂,包括外膜蛋白、外膜和肽聚糖层等一系列物质结构,使得精油不容易进入到细胞内[9]。
综上,莳萝蒿精油在驱虫和抑菌等方面均具有良好的活性,其有望被开发成为一种无毒无公害的天然药剂并被应用于医药、化妆品和果蔬保鲜等许多方面。该项研究填补了莳萝蒿精油抑菌作用及其机制等研究方面的空白,对于莳萝蒿精油的进一步研究和开发利用具有十分重要的意义。

