多发性骨髓瘤预后相关基因的鉴定及核心基因CLDN1的机制探讨
龚高明 陈博 舒鹏
随着靶向药物的不断开发,多发性骨髓瘤(multiple myeloma,MM)的预后得到了显著改善,但MM仍是一种不可治愈的疾病[1]。因此寻找MM的治疗靶点,进一步开发靶向治疗药物,从而改善患者的预后成为研究的热点[2]。在患者治疗靶点的分析中,除去对患者本身的临床病理因素进行分析外,近年来通过对患者肿瘤组织样本的测序数据进行分析,明确肿瘤组织中的基因表达与患者预后因素之间的关联,并进一步应用于临床病例的诊断、肿瘤靶点开发的这一流程已得到广泛的认可[3]。目前已有多项研究得出了与MM患者生存率相关的预后基因[4]。尽管如此,有关这些预后基因如何影响MM患者肿瘤细胞生物学特性的研究则相对较少。本研究通过Cox预后模型分析基因表达与MM患者整体生存率之间的相关性,并得到预后相关基因,同时进行相应的机制探讨。
1 材料和方法
1.1 试剂 RPMI 1640(11875-085)培养基、DMEM(11530556)培养基、FBS(10438026)均购自美国Gibico公司;小干扰 RNA(small interfering RNA,siRNA)购自美国Sigma 公司;PMD2.G(12259)、psPAX2(12260)、lenti-CRISPR V2(52961)均购自美国addgene公司;Lipofectamine2000(12566014)、qRT-PCR实验中Trizol(15596026)均购自美国Thermo Fisher公司;反转录试剂盒PrimeScript RTReagent Kit with gDNA Eraser(RR047A)、SYBR检测试剂盒SYBR Premix Ex Taq Ⅱ(TliRNaseHPlus)(RR820A)均购自北京宝日医生物技术有限公司,实验中全部引物均由华大基因合成;在Western blot实验中,RIPA强裂解液(P0013B)购自上海碧云天生物技术有限公司;紧密连接蛋白 1(claudin1,CLDN1)(ab63070)、转化生长因子-β3(transforming growth factor beta 3,TGF-β3)(ab15537)、GAPDH(ab9485)抗体均购自美国 Abcam公司;Transwell小室(BMS500FI-100)购自美国Corning公司;CCK-8(CK04)增殖检测试剂购自日本同仁化学研究所;Annexin V FITC/PI(BMS500FI-100)凋亡检测试剂盒购自美国eBioscience公司;CD138+磁珠分选试剂盒购自美国STEMCELL Technologies公司。
1.2 预后相关基因的确定与验证 MM预后相关基因的确定使用R 3.5.1软件完成,选取GSE2658数据集为训练数据集,GSE57317数据集为测试数据集。训练与测试数据集均使用GEOquery包下载后,log2转换并使用preprocessCore包进行标准化,训练数据集随后进行如下操作:(1)使用randomForest包中的随机森林对基因的重要性进行排序;(2)进一步使用多因素Cox模型,最终得到25个预后相关基因,使用survival包中的多因素Cox模型检测训练数据集与测试数据集中25个基因的表达与MM患者总体生存率的关联,并使用ROC的时间序列分析(timeROC)工具包评估模型对不同时间点生存预测的性能,随后使用qRT-PCR检测25个基因在MM患者CD138+细胞中的表达;(3)在得到候选基因CLDN1后,使用survival包中的单因素Cox模型检测测序数据中CLDN1的表达与MM患者总体生存率的关联;(4)根据CLDN1的表达值,将GSE2658数据集中样本分为高表达组与低表达组,并使用limma包进行差异表达分析,以P<0.001为标准筛选基因,最终得到779个异常表达基因,使用fgsea包进行基因富集分析(gene set enrichment analysis,GSEA),并对富集通路中的基因使用cor.test计算相关系数。
1.3 细胞培养 3例健康志愿者、7例MM患者骨髓样本均来自宁波市北仑区人民医院,样本收集时间为2015年11月至2017年11月,实验过程经医院医学伦理委员会审批通过。健康志愿者、MM患者骨髓在经Ficoll分离出单个核细胞后,MM患者骨髓使用CD138+磁珠分选试剂盒分选出CD138+细胞待用。人MM细胞系RPMI8226细胞(北京协和细胞资源中心)培养于含10% FBS的RPMI 1640培养基中,培养条件为37℃、5% CO2。人胚肾细胞系293t细胞(美国ATCC公司)培养于含10% FBS的DMEM培养基中,培养条件为37℃、5% CO2。
1.4 CLDN1敲除慢病毒包装、单克隆筛选以及TGF-β3 siRNA转染 从addgene human GECKOV2 library库中提取CLDN1单引导核糖核酸(single guide RNA,sgRNA)序列,选取6条sgRNA,按照相应的操作步骤克隆至lentiCRISPR V2载体中[5]。使用第三代慢病毒包装体系将sgRNA包装为慢病毒,主要步骤如下:(1)PMD2.G、psPAX2、lentiCRISPR V2 分别取 3、9、12 μg,转染至293t细胞中。(2)收集36、48 h病毒上清液,混在一起低速离心(3 000 rpm,15 min)后,使用病毒上清液感染RPMI8226,标记为RPMI8226 KO组;RPMI8226细胞同时感染lentiCRISPR V2空载病毒,标记为RPMI8226 CON组。RPMI8226 CON组与RPMI8226 CLDN1 KO组在使用8.5×10-6mol/L浓度的嘌呤霉素筛选48 h后,使用BD FACSARIA III单细胞分选功能筛选单克隆细胞,并使用Sanger测序检测DNA突变变化,使用Western blot检测CLDN1蛋白水平的抑制,最终确定序列为5'-GGCGGTCACGATGTTGTCGC-3'的sgRNA阻断了RPMI8226细胞中CLDN1的表达。(3)在CLDN1与TGF-β3关联的验证中,将RPMI8226细胞分为RPMI8226 CON 组、RPMI8226 CLDN1 KO 组、RPMI8226 TGF-β3 siRNA组、RPMI8226 CLDN1 and TGF-β3 siRNA组,并分别转染lentiCRISPR V2空载体、CLDN1 sgRNA、TGF-β3 siRNA 和 CLDN1 sgRNA+TGF-β3 siRNA,TGF-β3 siRNA转染使用lipofectamine 2000进行,操作步骤按照试剂盒说明书进行。
1.5 健康志愿者骨髓单个核细胞与MM患者CD138+细胞中CLDN1 mRNA表达水平检测 采用qRT-PCR法。健康志愿者骨髓单个核细胞与MM患者CD138+细胞首先使用Trizol裂解,经氯仿分离出苯酚、等体积异丙醇沉淀出细胞总RNA后,使用反转录试剂盒将总mRNA反转录为cDNA。以GAPDH为内参,通过SYBR染料法检测目的基因在mRNA水平的表达。GAPDH上游引物:5'-GTCTCCTCTGACTTCAACAGCG-3',下游引物:5'-ACCACCCTGTTGCTGTAGCCAA-3';CLDN1 上游引物:5'-GTCTTTGACTCCTTGCTGAATCTG-3',下游引物:5'-CACCTCATCGTCTTCCAAGCAC-3'。反应体系为cDNA 1.2 μl,引物 1.2 μl,2×qPCR Mix 7.5 μl,ROX DyeⅡ 0.3 μl,水 4.8 μl,总反应体系为 15 μl;反应条件为50 ℃ 20 s,95℃ 30 s,95 ℃ 3 s,60 ℃ 30 s,后两步40个循环。最终mRNA的相对表达量使用2-ΔΔCT法定量。
1.6 CLDN1、TGF-β3蛋白表达水平检测 采用Western blot法。细胞使用RIPA裂解液冰上裂解30 min后,使用BCA蛋白定量试剂盒定量,加入相应比例的上样缓冲液,沸水浴15 min后,取20μg蛋白加入到Western预制胶中,恒压电泳直至溴酚蓝跑至胶板底部,并使用湿法转膜将蛋白转至PVDF膜,标记相应一抗与二抗,使用ECL发光液检测信号的强度以判定蛋白的表达。
1.7 细胞凋亡检测 采用Annexin V FITC/PI双染法。PBS清洗细胞后,使用Binding buffer重悬,并加入Annexin V FITC与PI,冰上标记10 min后,流式细胞仪检测细胞凋亡的变化。数据使用FLOWjo 7.6.1进行分析。
1.8 细胞迁移检测 采用Transwell法。选用8μm Transwell小室,上室加入无血清培养基重悬的细胞,下室加入含有血清的培养基,12 h后吸取下室培养基,计数得到迁移细胞数目。
1.9 细胞增殖检测 采用CCK-8法。将细胞铺于96孔板中,并设立 4 个副孔,于 0、24、48、72、96 h 分别加入1/10体积的CCK-8试剂,37℃避光孵育4 h后,使用酶标仪检测 450 nm处的吸光度(OD)值(OD450),并以0 h时的OD450为参照,其余时间点OD值均与0 h时相除得到增殖指数。
1.10 统计学处理 采用R 3.5.1统计软件。计量资料以表示,组间比较采用两独立样本t检验。生存分析采用单因素Cox回归分析。样本的相关性分析采用Pearson相关。P<0.05为差异有统计学意义。
2 结果
2.1 MM患者25个基因预后模型的建立及与患者预后的相关性 本研究得到25个与患者整体生存率相关的预后基因,分别为 NNAT、TRAPPC8、IFI27L1、PNOC、HJURP、KRT6B、METTL7A、C16orf45、CENPA、TPT1P8、TYROBP、MSN、RFC4、DSPP、PABPC1、TNFSF12、C3orf52、CLDN1、RPS9、CSTF3、CDKN1A、SLC25A43、HPRT1、VDAC3、FZD3。以25个基因组合得到的预后模型在训练(图1a)与测试数据集(图1b)中均能够很好地预测患者的总体生存率,且在患者1~3年生存率的预测中也有很好的表现(AUC 均>0.7)(图 1c)。
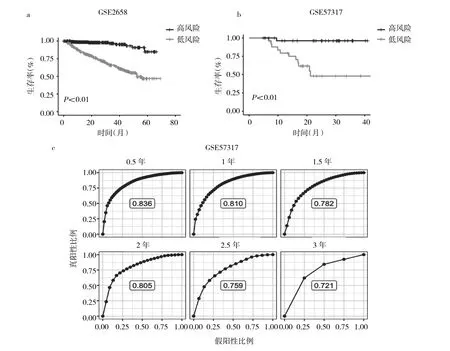
图1 多发性骨髓瘤(MM)患者25个基因预后模型的建立及与患者预后的相关性(a:使用Cox模型得到的25个预后相关基因在GSE2658数据集中与患者总体生存率的相关性;b:在测试数据集中验证25个预后基因与患者总体生存率的相关性;c:在测试数据集中,25个预后基因对患者0.5、1、1.5、2、2.5、3年生存率的预测能力的比较)
2.2 MM患者CD138+细胞中CLDN1的表达情况及与患者预后的相关性 MM患者CD138+细胞中CLDN1 mRNA表达水平为4.89±0.63,高于健康志愿者骨髓单个核细胞的 1.00±0.12,差异有统计学意义(t=3.11,P<0.01)(图2a)。同时MM患者CD138+细胞中CLDN1蛋白水平呈高表达(图2b)。在训练数据集中,CLDN1高表达组患者生存率明显低于CLDN1低表达患者(P<0.01)(图 2c)。
2.3 CLDN1的表达水平与MM细胞系细胞生物学特性的关联 在确定了CLDN1在CD138+细胞中的表达后,随后构建了CLDN1敲除单克隆,结果表明CLDN1 sgRNA抑制了CLDN1蛋白水平的表达(图3a)。而RPMI8226 CON组细胞凋亡比例为2.40±0.23,明显低于RPMI8226 CLDN1 KO组的17.67±2.77,差异有统计学意义(t=8.55,P<0.01)(图 3b)。在细胞增殖中,72 h时RPMI8226 CON组增殖指数为4.87±1.56,明显高于RPMI8226 CLDN1 KO组的 2.51±0.18,差异有统计学意义(t=9.94,P<0.01);96 h时 RPMI8226 CON 组增殖指数为6.86±0.12,明显高于RPMI8226 CLDN1 KO组的 3.06±0.25,差异有统计学意义(t=23.73,P<0.01)(图3c)。在细胞迁移中,12 h时RPMI8226 CON组迁移细胞数为2 063±241.9,明显高于RPMI8226 CLDN1 KO 组的 1 197±166.9,差异有统计学意义(t=2.95,P<0.05)(图 3d)。

图3 紧密连接蛋白1(CLDN1)的表达水平与骨髓瘤细胞系细胞生物学特性之间的关联(a:RPMI8226 CON组与RPMI8226 CLDN1 KO组CLDN1蛋白表达水平比较;b:RPMI8226 CON组与RPMI8226 CLDN1 KO组细胞凋亡比例比较;c:RPMI8226 CON组与RPMI8226 CLDN1 KO组细胞增殖指数比较;d:RPMI8226 CON组与RPMI8226 CLDN1 KO组迁移细胞数比较;与RPMI8226 CON组比较,*P<0.05,**P<0.01)
2.4 CLDN1调控的信号通路探讨 在确定了CLDN1与RPMI8226细胞生物学特性的关联后,在GSE2658数据集中选取CLDN1高表达与低表达样本,使用GSEA方法检测细胞通路的富集,结果表明细胞外基质相关通路在CLDN1高表达样本中富集(图4a),检测CLDN1与细胞外基质分子(GO:0031012)表达相关性后,发现CLDN1与TGF-β3的表达呈正相关(r=0.27,P<0.01)(图 4b和表 1)。RPMI8226随后转染 TGF-β3 siRNA,结果表明CLDN1的表达受限(图4c),使用Transwell小室检测 RPMI8226 CON组、RPMI8226 CLDN1 KO 组、RPMI8226 TGF-β3 siRNA 组、RPMI8226 CLDN1 and TGF-β3 siRNA组细胞迁移的变化后,结果发现CLDN1的敲除、TGF-β3的抑制均能抑制RPMI8226细胞的迁移,而同时抑制CLDN1与TGF-β3能够进一步抑制RPMI8226细胞的迁移能力(图4d)。

表1 细胞外基质分子(GO:0031012)中与CLDN1表达相关的基因

图4 紧密连接蛋白1(CLDN1)调控的信号通路的探讨[a:在GSE2658数据集中,筛选出CLDN1高表达与低表达样本后,使用基因富集分析(GSEA)检测通路的富集;b:GSE2658数据集中CLDN1与转化生长因子-β3(TGF-β3)表达的相关性;c:RPMI8226细胞在转染TGF-β3小干扰 RNA(siRNA)后,CLDN1、TGF-β3 蛋白表达的电泳图;d:RPMI8226 CON 组、RPMI8226 CLDN1 KO 组、RPMI8226 TGF-β3 siRNA组、RPMI8226 CLDN1 and TGF-β3 siRNA组细胞迁移的变化比较,与RPMI8226 CON组比较,*P<0.05,**P<0.01]
3 讨论
MM目前仍为预后较差的一种恶性疾病,我国患者中位生存期仅为3年,仅有少数患者能够存活10年以上[6]。与此同时MM也是最早应用靶向治疗药物的疾病之一,通过对MM发病过程中特异的通路进行靶向治疗能够起到很好的效果,如2014年的一项研究中,在130例成人MM患者中应用蛋白酶体抑制剂硼替佐米,使得1例患者达到完全缓解、49例患者达到部分缓解[7]。然而随着肿瘤细胞的不断演化,多种基因如PSMB5 A49T、C52F等位点突变介导的耐药也备受关注[8],而明确新的预后相关基因,并开发新的靶点成为研究的热点。
本研究通过Cox生存分析与随机森林算法结合的方式,得到了25个与患者总体生存率显著相关的基因,而由该25个预后相关基因构建的预后模型,在对患者 0.5、1、1.5、2、2.5、3 年生存率的预测中,该模型的AUC在0.5年最高,在3年总体生存率的预测中依然具有很好的性能。通过在本院MM样本验证,25个基因中,CLDN1在7例MM患者中的mRNA与蛋白水平均呈现高表达,与此同时CLDN1的表达与患者的总体生存率高度相关,因此笔者选定CLDN1进行进一步的验证。
目前已有的研究中,CLDN1又称Claudin 1,属于跨细胞膜蛋白家族,其主要功能与细胞之间的紧密连接相关[9],因此也被证实与细胞增殖、转移[10]、上皮-间质转化[11]等进程密切相关。MM中CLDN1的具体功能与机制尚未有报道,通过构建CLDN1敲除细胞系,笔者证实了CLDN1的表达与MM细胞系的增殖、凋亡、迁移高度相关,初步证实了CLDN1的表达水平决定了MM细胞系的生物学特性,可能为MM的驱动基因之一。因此笔者随后在测试数据集中调取CLDN1的表达数据并计算细胞通路的富集,结果表明细胞外基质成分相关通路在CLDN1高表达样本中异常富集,随后调取该通路(GO:0031012)中的所有基因,并与CLDN1表达数据进行相关性分析,得出TGF-β3与CLDN1的表达呈正相关。TGF-β3属于TGF-β家族,已被证实与MM的发病相关[12]。同时在结肠上皮细胞系中TGF-β家族的TGF-β1能够诱导CLDN1的表达,因此笔者认为TGF-β3可能通过同样的机制调控CLDN1的表达[13]。笔者向RPMI8226细胞系中转染了TGF-β3 siRNA,通过Western blot确定了敲低效率后,进一步证实了TGF-β3的抑制能够降低CLDN1的表达,初步证实TGF-β3对CLDN1的调控,而在细胞迁移实验中,TGF-β3、CLDN1的抑制均能降低细胞的迁移能力,且两者具有协同作用。
综上所述,本研究确定了25个预后相关基因对患者生存的预测作用,并确定了其中与肿瘤发展密切相关的癌基因CLDN1,同时初步证实了CLDN1与TGF-β3之间的相关性,为进一步开发靶向药物提供了基础。

