血清胃蛋白酶原和胃泌素-17在胃癌前病变筛查中的应用价值
卢曹念,吴健,佘强,邓彬,丁岩冰, 扬州大学附属医院消化内科 江苏省扬州市 225000
0 引言
据中国国家癌症中心统计数据,我国胃癌的发病率为30.00/10万人,死亡率为21.48/10万人,其发病率及死亡率在所有恶性肿瘤中分别排名第2位及第3位[1].胃镜和病理检查是胃癌和胃癌前病变诊断的金标准,但由于其侵入性,部分患者无法耐受,其在人群筛查中的应用有限制.因此,需要寻找简便、经济、可操作的胃癌前病变及胃癌的筛查方法.胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ (PGⅡ)、胃泌素17 (G-17)三者组成了直接反映胃黏膜不同部位分泌功能的特异性标志群,被称为胃黏膜“血清学活检”,在早期胃癌及胃癌前疾病筛查中的作用受到关注,并进行胃癌人群筛查[2].Correa提出肠型胃癌模式,认为其发生经历幽门螺杆菌感染相关性慢性胃炎→萎缩性胃炎→肠上皮化生→异型增生→癌变等阶段[3].胃黏膜出现萎缩、肠化等癌前病变,可导致血清中血清胃蛋白酶原(PG)、G-17水平相应的变化.本研究通过检测血清PG、G-17水平,以胃镜活检及组织病理学为金标准,了解PG和G-17在胃癌前病变各个阶段的变化,并探讨血清PG和G-17在初筛胃癌前病变的应用价值.
1 材料和方法
1.1 材料 选取2019-01/2019-12在扬州市杨寿镇和射阳湖镇以及平山社区进行上消化道肿瘤内镜筛查人群.纳入标准:(1)扬州市杨寿镇和射阳湖镇、平山社区的年龄>35岁常住居民;(2)具有血清胃蛋白酶原、G-17检测、胃镜及相关病理检查结果.排除标准:(1)经胃镜证实有消化道肿瘤、消化性溃疡及食管、十二指肠病变等;(2)曾有过上消化道手术史;(3)近1 mo使用过抗生素、质子泵抑制剂或铋剂;(4)近2 wk服用阿司匹林、华法林等抗凝药;(5)合并严重的心、脑、肺、肝脏、肾功能不全等疾病.同时选择胃镜及病理结果为正常或浅表性胃炎的受检者为对照组.所有受检者均签署知情同意书,本研究经扬州大学附属医院医学伦理委员会审查通过.
1.2 方法
1.2.1 血清PG、G-17检测:抽取受检者空腹血5 mL置于分离胶/促凝剂管内,血标本按3500 r/min的转速离心10 min分离出血清,于-20 ℃环境下保存备用.采用酶联免疫吸附法(ELISA)检测血清PGI、PGII和G17浓度并计算PGI/PGII比值(PGR),严格按照说明书操作.试剂源自必欧瀚生物技术(合肥)有限公司.
1.2.2 胃镜检查:所有胃镜检查均由高年资内镜医师完成,所有胃镜检查者均分别在胃窦、胃体各取2块送病理检查,如有明显病变处再取活检并分开装瓶标注.
1.2.3 病理诊断:所有病理均经2名以上病理医生结合内镜下表现进行诊断.病理分级采用我国慢性胃炎病理诊断标准和新悉尼系统直观模拟评分法,活动性、慢性炎性反应、萎缩和肠化生分成无、轻、中和重度4个级别(0、+、++、+++),病理检查报告注明每块活检标本的组织学变化.观察黏膜炎性反应、萎缩、肠化、异型增生等组织学变化,同一个体多个病变以组织学最高级别的病灶为准.对照组为病理提示正常或黏膜炎性反应,未检出黏膜萎缩、肠化生和异型增生,胃癌前病变组为病理检出黏膜萎缩、肠化生、异型增生中任一组织变化.胃癌前病变组根据病理有无肠化生和异型增生分为萎缩性胃炎组(不伴肠化生和异型增生)、肠化生组(组织病理见肠化生,但未见异型增生)、异型增生组.
统计学处理采用SPSS 23.0软件进行统计学分析,变量分布采用Kolmogorov-Smirnov检验,PG、G-17呈偏态分布,采用中位数(第25百分位数,第75百分位数)[M(P25,P75)]表示,两组间比较采用Mann-WhitneyU检验,多个独立样本组间比较采用Kruskal-Wallis检验.采用ROC曲线分析敏感指标诊断胃癌前病变的诊断效能及最佳临界值.P<0.05为差异有统计学意义.
2 结果
2.1 一般情况 共纳入980例受检者,男性326例,女性654例,年龄37-72岁,平均(57.05±8.71)岁,其中对照组488例,胃癌前病变组492例,两组间性别、年龄比较差异无统计学意义.病例组中根据有无肠化和异型增生分为萎缩性胃炎组314例,肠化组141例,异型增生组37例.
2.2 胃癌前病变组与对照组的PG、G-17水平比较 胃癌前病变组PGⅠ和PGR水平明显低于对照组,G-17、PGⅡ明显高于对照组,差异均具有显著统计学意义(P<0.01),见表1.与萎缩性胃炎组比较,肠化生组和异型增生组PGⅠ、PGR明显降低(P<0.05),而异型增生组G-17明显升高(P<0.01),PGⅡ在肠化生组、异型增生组均降低,但差异均无统计学意义(P>0.05);与肠化生组比较,异型增生组G-17明显升高,PGⅠ、PGR明显降低(P<0.01),两组间PGⅡ水平无明显差异,见表2.
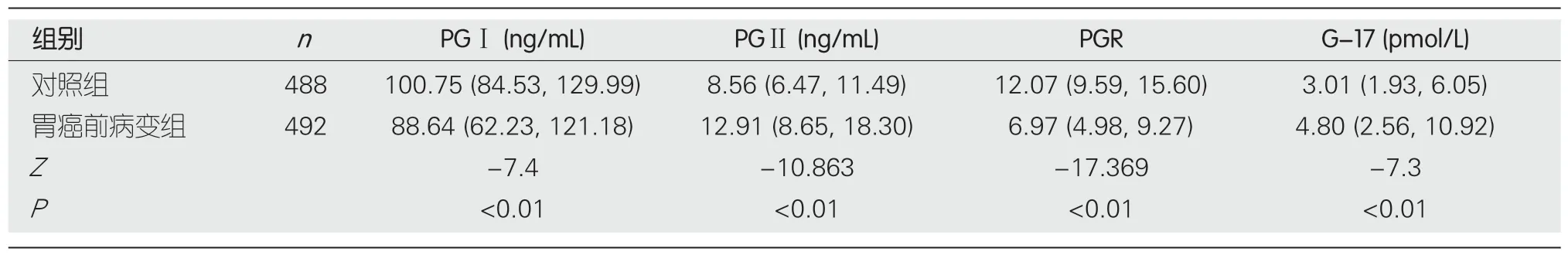
表1 胃癌前病变组与对照组的胃蛋白酶原、胃泌素-17水平比较[M(P25,P75)]
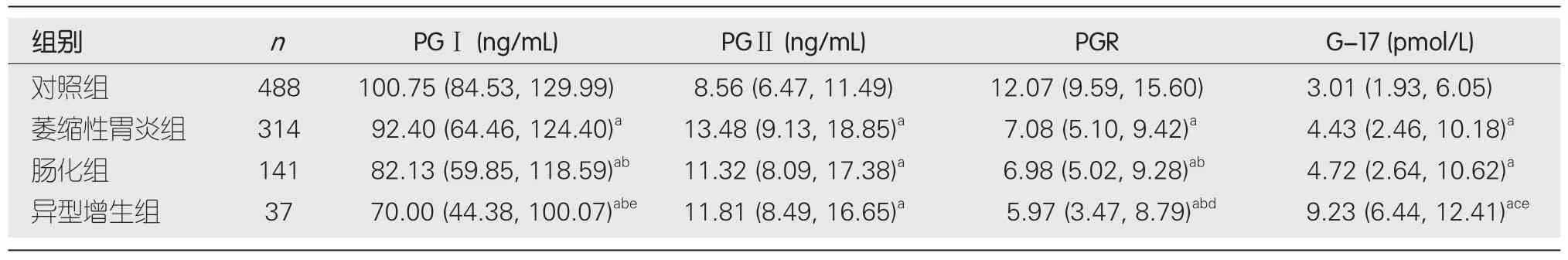
表2 胃癌前病变各组胃蛋白酶原、胃泌素-17水平比较[M(P25,P75)]
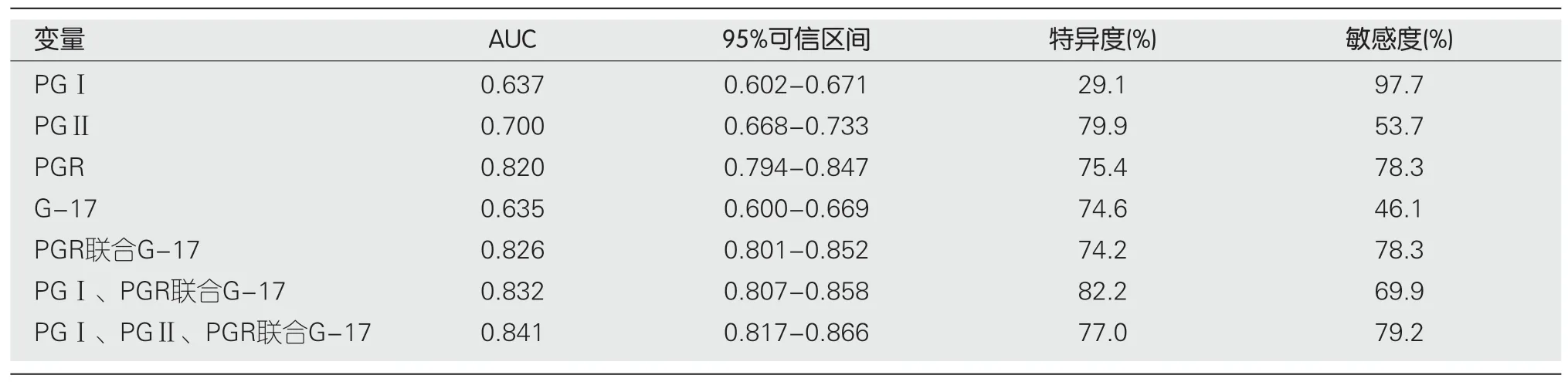
表3 血清胃蛋白酶原Ⅰ、胃蛋白酶原Ⅱ、PGR、胃泌素-17单独及联合检测在胃癌前病变中的诊断价值
2.3 血清PGⅠ、PGⅡ、PGR、G-17单独与联合检测在胃癌前病变中的诊断价值 PGⅠ、PGⅡ、PGR、G-17的ROC曲线下面积分别为0.637、0.700、0.820和0.635.根据ROC曲线分析,PGR为诊断胃癌前病变的敏感指标,最佳临界值为8.46(敏感度78.3%,特异度75.4%),联合检测指标分别绘制ROC曲线结果显示,AUC分别为0.826、0.832、0.842,均高于单一检测指标,联合检测对胃癌前病变诊断有较大意义.见表3、图1、图2.
3 讨论
PG是胃黏膜特异性功能酶,可分为PGⅠ和PGⅡ两种不同生化和免疫活性的亚群.PGⅠ主要由胃底的主细胞和黏液颈细胞分泌;PGⅡ除了由上述两种细胞分泌外,还可由贲门腺、胃窦的幽门腺和十二指肠上段的Brunner腺细胞分泌.血清PG水平反映胃黏膜的形态和分泌功能的动态变化,当胃黏膜出现萎缩时,PGⅠ和PGⅡ水平下降,PGⅠ水平下降更明显,因而PGⅠ/PGⅡ比值随之降低.PG测定有助于判断萎缩的范围[4].本研究中,胃癌前病变组PGⅠ和PGR水平则明显低于对照组(P<0.01).且随着病变的进展,PGⅠ、PGR水平逐渐降低,这与国内相关报道的结果相似[5],提示PG指标一定程度反映胃癌前病变的程度.当胃黏膜萎缩时,主细胞数量减少,血清PGⅠ水平逐渐下降,而PGⅡ分布广泛,其水平保持相对稳定,从而导致PGR下降.随着萎缩加重,出现肠化生、异型增生,致癌因子使胚细胞中PG基因突变,丧失分泌PG的能力,血清PG水平持续降低.因此,检测血清PG有助于评估胃黏膜的功能和状态,对胃癌前病变的诊断具有一定意义.
G-17是主要由胃窦G细胞合成释放的.血清G-17检测可反映胃窦的黏膜功能状态,当黏膜萎缩以胃窦部位为主时G-17水平降低;胃体为主的萎缩时,G-17水平升高;当萎缩累及全胃时,其G-17水平略高于胃窦萎缩,但低于胃体萎缩[5].陈莫耶等[6]研究发现胃癌发生、发展过程中血清G-17逐渐升高,本研究中胃癌前病变组G-17水平高于对照组,且G-17在异型增生组升高明显,胃泌素除了促进胃酸释放,它还可通过G蛋白偶联受体缩胆囊素CCK或者胃泌素受体CCK-BR介导肿瘤细胞生长、促进细胞增殖、抑制细胞凋亡的作用[7].随着病变进展,血清胃泌素水平呈升高趋势.血清G-17在胃癌前病变中起重要作用,因此G-17可用于胃癌前病变的筛查,以便为胃癌早期诊断提供帮助.
为了进一步评估血清PG及G-17对胃癌前病变的诊断效能,绘制ROC曲线分析,结果显示PGR为诊断胃癌前病变的敏感指标,最佳临界值为8.46 (敏感度78.3%,特异度75.4%),国内有研究[8]报道PGR诊断胃癌前病变的最佳临界值为8.75 (敏感度70.0%,特异度58.0%),提示低水平PGR能较好的预测胃癌前病变.而国内较多使用PGⅠ≤70 ug/L且PGI/PGⅡ≤3.0作为诊断萎缩性胃炎的临界值,高发区胃癌筛查采用PGⅠ≤70 ug/L且PGⅠ/PGⅡ≤7.0[9].这可能与不同地区、性别、年龄等有有关,所以在不同地区应建立符合本地区情况最佳cut-off值.另外,多项研究显示[10,11]G-17联合PG诊断胃癌和胃癌前病变优于单项检测,可提高诊断的准确性.本研究通过联合检测指标绘制ROC曲线分析,PGⅠ、PGⅡ、PGR联合G-17检测诊断胃癌前病变的AUC最大,对诊断胃癌前病变要优于单独检测,提示联合检测对胃癌前病变有较高的诊断价值.因此,早期胃癌前病变患者检测血清G-17、胃蛋白酶原水平能一定程度地初筛,对于联合检测结果为阳性时,再进一步行胃镜及病理学检查,以便早期诊断和治疗.
4 结论
综上所述,血清G-17、PGⅠ及PGR对胃癌前病变诊断有一定价值,可以作为胃癌前病变筛查的参考指标,联合检测能提高早期筛查胃癌前病变的准确性.
文章亮点
实验背景
我国胃癌的发病率和病死率均较高,胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ (PGⅡ)、胃泌素17 (G-17)组成的胃黏膜“血清学活检”可应用于胃癌前病变和胃癌的筛查.
实验动机
本研究通过检测血清PG、G-17水平,以胃镜活检及组织病理学为金标准,了解PG和G-17在胃癌前病变各个阶段的变化,并探讨血清PG和G-17在初筛胃癌前病变的应用价值.
实验目标
随着胃癌前病变的进展,血清中血清PG、G-17水平出现相应的变化,可用于胃癌前病变的筛查,联合检测可提高诊断价值,从而早期诊断和治疗.
实验方法
采用酶联免疫吸附法测定受检者血清G-17、PG水平,比较胃癌前病变组与对照组各指标水平变化,建立ROC曲线比较各指标单独及联合检测诊断胃癌前病变的价值.
实验结果
胃癌前病变患者血清G-17、PGⅠ、PGR水平异常,联合检测对胃癌前病变具有较大诊断效能.
实验结论
血清G-17、PGⅠ及PGR对胃癌前病变诊断有一定价值,低水平PGR能较好的预测胃癌前病变,联合检测能提高早期筛查胃癌前病变的准确性.
展望前景
进一步的筛选更多有效的生物标志物来提高对疾病的诊断效能,以及增加样本量确定诊断胃癌前病变的最佳临界值.

