棉铃虫乙醇脱氢酶5的原核表达和活性分析及其抗血清的制备*
古新蓉,罗生慧,魏林昱,姜岩,刘小宁
(新疆大学 新疆生物资源和基因工程重点实验室,新疆 乌鲁木齐830046)
0 引言
棉铃虫严重危害棉花产量,被认为是寄主范围广泛且破坏性强的毁灭性农业害虫,在世界范围内对农业生产造成严重的经济损失[1].在植物和害虫的协同进化中,植物在受到害虫的危害时,不会完全处于被动地位,许多植物已进化出有效自卫的植物次生物质,来抵御害虫的危害[2].而植食性害虫通过增强解毒酶含量或提高解毒酶的活性,来抵抗这种次生物质以保证正常生命活动,如野番茄依赖高浓度的2-十三烷酮(2-TD)来抵抗棉铃虫、棉蚜等害虫的取食[2,3].有文献报道长时间的2-TD胁迫提高了棉铃虫对氨基甲酸酯杀虫剂耐受性[3].在害虫防治措施中,化学杀虫剂被长期且广泛地使用,加之不合理用药,导致棉铃虫的抗药性快速形成,且抗性背景复杂,所以对棉铃虫抗药性的治理迫在眉睫[4].由于2-TD能诱导害虫细胞色素P450超家族中多个基因的过量表达,表现为mRNA或蛋白质水平的增加,导致昆虫对有毒物质代谢能力增强,从而提高昆虫对杀虫剂的耐受力[5].细胞色素P450酶系(P450s)是多功能氧化酶,参与对很多杀虫剂产生抗性[6].目前已经报道的昆虫P450s基因分属于10个家族,发现CYP6家族与昆虫的抗药性密切相关[7].实验研究表明,果蝇(Drosophila melanogaster)P450 CYP6G1和CYP6G2基因的过量表达导致了其对DDT、烯啶虫胺、环虫腈的抗性[8].而棉铃虫体内的P450CYP6B6基因在苯巴比妥的诱导下,有受转录调控的可能[8].棉铃虫CYP6B7、CYP6B6、家蝇(Musca domestica L.)CYP6D1等基因的启动子区存在一些响应元件,可以调控靶基因的转录,以应对外界的胁迫[8,9].
本文基于酵母单杂交筛选出响应2-十三烷酮(2-TD)的P450 CYP6B6启动子的候选调控因子-乙醇脱氢酶ADH5[2,10].花椒毒素会诱导黑尾凤蝶(Palio polyxene)的P450 CYP6B1、CYP6B3过表达,而在果蝇中参与Adh基因表达的元件和参与CYP6B1、CYP6B3过表达的元件有位置及序列上的相似性,因此Adh基因表达的元件如GATA被认为可能参与CYP6B1、CYP6B3过表达,并且也可能存在蜕皮激素反应元件和生长发育转录因子的类似物参与该类P450s的过表达[10].文献[11]指出在果蝇中ADH作为一种转录因子的辅因子参与脂肪体的合成,说明ADH在昆虫体内可能会参与某些代谢通路.ADH5虽然不是典型的转录因子,但是ADH5定位于细胞核并且具有核苷酸结合结构域,实验表明HaADH5能与CYP6B6响应2-TD的核心启动子区HE1结合[2].因此HaADH5可能响应2-TD参与CYP6B6的表达.
为进一步阐明HaADH5在棉铃虫中的作用,本研究同源克隆了棉铃虫乙醇脱氢酶(HaADH5)基因,进行原核表达和分析融合蛋白的酶活特性,免疫小鼠制备His-HaADH5的抗血清,并用酶联免疫吸附(EILSA)实验测定该抗血清中抗体的效价,同时检测此抗血清的免疫特异性,并且应用此抗血清探索HaADH5在棉铃虫不同组织的表达量.此结果为后续深入研究在2-TD胁迫下HaADH5对CYP6B6的调控表达奠定基础.
1 材料与方法
1.1 材料及试剂
本研究中昆明白小鼠购自新疆乌鲁木齐市新市区鲤鱼山路新疆医科大学北校区.pET32a质粒为实验室保存;蛋白Marker购自Thermo Fisher Scientif ic公司;小鼠抗His-tag多克隆抗体、辣根过氧化物酶标记的山羊抗小鼠IgG抗体和大肠杆菌Transetta菌株感受态细胞等购自北京全式金公司;DAB显色试剂盒购自北京中杉金桥公司;ELISA板购自广州洁特生物过滤制品有限公司.
1.2 融合蛋白的诱导表达、鉴定及纯化
将鉴定正确的p ET32a-HaADH5重组质粒转入大肠杆菌Transetta菌株的感受态细胞中,菌液PCR鉴定正确后,将阳性克隆37℃过夜培养,次日以1∶100的比例接种于新鲜的LB液体培养基(含有50 mg/L的Amp).将菌液在37℃、220 r/min的摇床内培养(约4小时)至OD600为0.4~0.6,再加入终浓度为0.5 mmol/L的IPTG培养6 h后离心收集菌体,并用p H 8.0的PBS重悬菌体,超声破碎后离心获得上清(可溶性蛋白)和沉淀(包涵体蛋白),诱导前、后的菌体和上清沉淀用SDS-PAGE电泳分离再转印至硝酸纤维素膜上,转膜成功后用封闭液(5%的脱脂奶粉)于4℃封闭过夜,加入鼠抗His-tag多克隆抗体为一抗(按照1∶3 000稀释一抗后使用),在37℃恒温培养箱中孵育2 h,用洗涤缓冲液PBST在水平摇床上洗膜5次,每次10 min.辣根过氧化物酶(HRP)标记的山羊抗鼠IgG作为二抗(按照1∶5 000稀释二抗后使用),在37℃恒温培养箱中孵育1.5 h,用PBST充分洗涤5次后按照使用说明用DAB显色鉴定.
将鉴定正确的重组菌接种于含Amp的LB培养基中,于37°C、220 r/min的摇床内培养至OD600为0.4~0.6,加入终浓度为0.5 mmol/L的IPTG作为诱导剂,在22℃、220 r/min的摇床内培养6 h.将诱导培养后的菌液离心收集菌体重悬于PBS中并超声破碎,离心后获得的可溶性蛋白溶液与Ni-NTA柱子于4℃结合3 h,然后用低浓度咪唑(10 mmol/L洗2次、20 mmol/L洗2次)洗脱除去大量杂蛋白;再以50 mmol/L,100 mmol/L去除残留的杂蛋白,最终以200 mmol/L咪唑洗脱目的蛋白,分部收集洗脱液,电泳检测洗脱液.将超滤后得到的目的蛋白用Bradford蛋白定量试剂盒测定蛋白含量,立即用2 mL的EP管分装并冻存于-80℃冰箱中备用.
1.3 乙醇脱氢酶的酶活测定
通过酶活定义:一个乙醇脱氢酶的酶活相当于25℃条件下1 min氧化NAD+生成1μmoL NADH所需的酶量.本文对常开霞等人测定乙醇脱氢酶活性的方法进行了一些完善和修改[12-14].在融合蛋白His-HaADH5酶活测定反应体系中含有100 mmol/L Tris-HCl缓冲液(p H 8.3),5.0 mmol/L NAD+,50μL融合蛋白,100 mmol/L底物和总体积为1.0 mL的0.05 mmol/L ZnSO4.在酶活测定试验中用甲醛、乙醇、丙三醇、正丁醇、异戊醇作为底物研究温度和p H对His-HaADH5活性影响.根据上述反应体系在15°C~75°C条件下研究不同温度对His-HaADH5的活性影响.使用100 mmol/L乙酸钠(p H 4.0~6.0),Tris-HCl缓冲液(p H 7.0~8.0)和甘氨酸-氢氧化钠缓冲液(p H 9.0~13.0)在25℃条件下按照上述反应体系测量不同p H对His-HaADH5活性的影响.
1.4 鼠抗His-HaADH5多克隆抗体的制备
将昆明白小鼠在本实验室饲养一周后,眼眶静脉采血得到的血清作为阴性对照,次日开始第一次免疫,用0.2 mol/L咪唑洗脱目的蛋白作为抗原蛋白与等体积完全弗氏佐剂(仅第1次免疫用)超声混合,鉴定超声乳化后,用足垫和肌肉注射法免疫小鼠,一只小鼠用50μg抗原蛋白并且注射总体积不超过150μL.在间隔14 d后第2次、3次免疫使用不完全弗氏佐剂与抗原蛋白充分乳化,第2次、3次免疫时间间隔均14 d.完成第3次免疫后精心照顾小鼠并在第10 d开始采血,眼眶静脉采血法可以连续采血,血样37℃放置0.5 h,4℃放置0.5 h,3 500 r/min离心20 min,所得血清即为抗血清,于-80℃冰箱保存.
1.5 ELISA检测鼠抗His-HaADH5抗体效价
以每孔1μg的His-HaADH5融合蛋白包被ELISA板于4℃过夜,次日在37℃恒温培养箱中用5%的脱脂奶粉封闭2 h后,用PBST缓冲液洗涤3次后加入不同稀释比例的小鼠血清作为一抗,以免疫前的血清做对照,稀释后的血清体积为150μL/孔,于37℃孵育1 h再洗涤3次,加入辣根过氧化物酶标记的山羊抗鼠IgG作为二抗(按照1∶3 000稀释二抗使用后使用),在37℃下孵育1 h.PBST洗涤3次,加TMB底物显色液在室温下孵育5 min后,在37℃恒温培养箱中孵育5 min,加入2 mol/L硫酸终止反应,用酶标仪检测A450,免疫前血清和免疫后血清的A450值分别为N和P,以P/N>2.1判断为阳性.
1.6 Western blot检测His-HaADH5抗血清的特异性
融合蛋白His-HaADH5经SDS-PAGE分离后转印至PVDF膜上,5%的脱脂奶粉作为封闭液4℃过夜,次日用效价检测为阳性的小鼠抗血清作为一抗(按照1∶3 000稀释一抗后使用)于37℃孵育2 h后洗涤3次,加辣根过氧化物酶标记的山羊抗小鼠IgG为二抗(按照1∶5 000稀释二抗后使用)于37℃孵育1 h,充分洗涤后用DAB(中杉金桥公司)显色.提取棉铃虫、黄粉虫全虫的天然总蛋白,以及棉铃虫的体壁、脂肪体、中肠各个组织部位天然总蛋白.将黄粉虫、棉铃虫全虫以及棉铃虫的体壁、脂肪体、中肠各个组织部位用液氮研磨至粉末状后加入适量的蛋白酶抑制剂,充分混匀后,在冰上静置15 min后低温离心10 min(4℃,10 000 r/min),将离心后获得的上清通过12%SDS-PAGE电泳检测.检测结果正确后用Western blot检测鼠抗His-HaADH5抗血清的特异性.不同组织天然总蛋白(45μg)经SDS-PAGE分离后转印至硝酸纤维素膜上,室温封闭2 h,以鼠抗HaADH5抗血清为一抗(按照1∶1 000稀释一抗后使用),室温孵育2 h,洗涤,加入辣根过氧化物酶标记的山羊抗小鼠IgG作为二抗(按照1∶5 000稀释二抗后使用)于室温孵育1 h,充分洗涤后用DAB(中杉金桥公司)显色.
2 结果与分析
2.1 棉铃虫乙醇脱氢酶融合蛋白的诱导表达、纯化及活性测定
重组质粒p ET32a-HaADH 5转化大肠杆菌Transetta菌株的感受态,鉴定得到阳性克隆,进行诱导表达后、在45.0 kDa至66.2 kDa之间有一条带表达量增加,这与His-HaADH5融合蛋白的理论大小(56.67 kDa)相符合(图1A).Western blot结果也显示56.00 kDa处有一条明显的杂交带出现(图1B),表明融合蛋白在宿主菌中稳定表达.可溶性分析发现其存在于上清和沉淀中.离心收集菌体重悬于PBS中并超声破碎,收集上清与Ni-NTA柱子于4°C结合3 h,然后用低浓度咪唑(10 mmol/L洗2次、20 mmol/L洗2次)洗脱除去杂蛋白;再以200 mmol/L咪唑洗脱目的蛋白,分部收集洗脱液(洗脱2次),电泳检测洗脱液(图2).

图1 融合蛋白的诱导表达及Western blot验证Fig 1 Expression and Western blot verif ication of fusion protein(A):SDS电泳;M:蛋白Marker;1~4:未经诱导的Transetta菌体、经诱导的Transetta菌体、经IPTG诱导的融合蛋白上清、经IPTG诱导的融合蛋白沉淀;(B):Western blot:1:经IPTG诱导的融合蛋白.
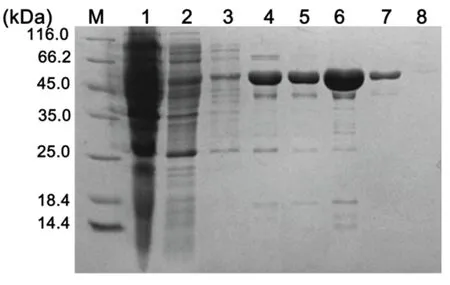
图2 融合蛋白的纯化Fig 2 Purif ication of fusion proteinM:蛋白Marker;1:未结合组分;2:10 mmol/L咪唑第1次;3:10 mmol/L咪唑第2次;4:20 mmol/L咪唑第1次;5:20 mmol/L咪唑第2次;6:50 mmol/L咪唑;7:100 mmol/L咪唑;8:200 mmol/L咪唑.
用融合蛋白His-HaADH5和辅因子NAD+进行酶活测定,分别以甲醛、乙醇、丙三醇、正丁醇、异戊醇为底物.结果表明融合蛋白可以催化这五种反应,其中异戊醇的活性显著高于其他底物(图3A).不同温度和p H值对融合蛋白的活性有明显影响.在15℃、异戊醇底物的条件下,随着外界温度的升高,融合蛋白的活性呈现先升高后降低的趋势,其中在35℃时达到最大值(图3B).在从6到13的宽p H范围内,融合蛋白对异戊醇作为底物的活性随p H的升高而增加,而在p H=10时,活性逐渐下降.融合蛋白的最佳p H为10(图3C).

图3 重组蛋白His-HaADH5的酶学性质Fig 3 Enzyme characterization of recombinant protein His-HaADH5
2.2 ELISA检测鼠抗His-HaADH5多克隆抗体效价
融合蛋白His-HaADH5免疫小鼠3次后,ELISA测定抗血清的效价.从图4中可以看到当阳性血清稀释409 600倍时样本吸收值大于阴性样本吸收值的2.1倍,即抗血清的效价大于409 600,说明抗血清滴度达到预期要求并可用于后续试验.
2.3 Western blot检测His-HaADH5抗血清的特异性及应用
用制备的抗His-HaADH5血清对纯化的融合蛋白、棉铃虫和黄粉虫的天然总蛋白做Western blot,结果显示,融合蛋白能被鼠抗HaADH5多克隆抗体识别,并在预期条带大小处有特异性结合条带(图5),该多克隆抗体也识别棉铃虫总蛋白中的HaADH5,但是不识别黄粉虫总蛋白,说明制备的His-HaADH5多克隆抗体具有较好的特异性,并用此抗体检测了棉铃虫不同组织的天然总蛋白,结果表明在中肠、脂肪体和体壁中均能检测到,条带大小与理论大小(36 kDa)相符合,且在棉铃虫脂肪体中条带颜色更深(图6C),说明HaADH5主要存在于脂肪体中.
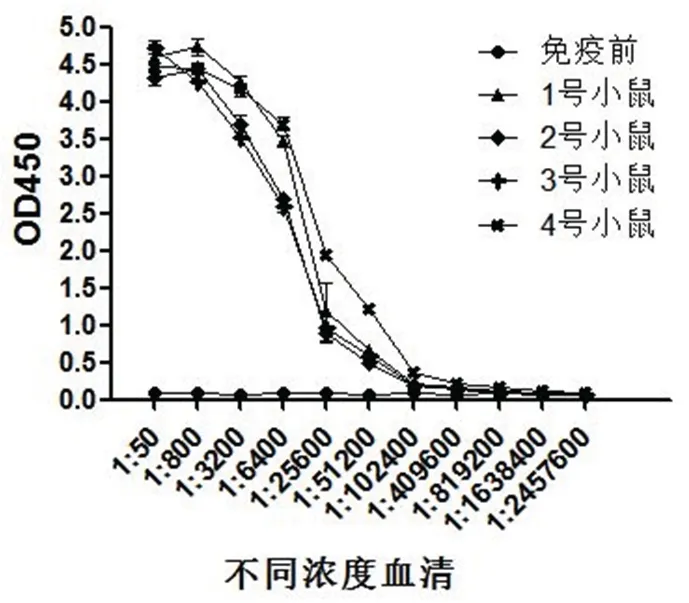
图4 ELISA测定His-HaADH5抗血清效价Fig 4 ELISA assay the titer of His-HaADH5 antiserum

图5 Western blot检测His-HaADH5多克隆抗体免疫学活性Fig 5 Western blot detect immunological activity of His-HaADH5 polyclonal antibody(A)M:蛋白Maker;1:黄粉虫天然总蛋白的Western印记杂;2:棉铃虫天然总蛋白;(B)M:蛋白Marker;3:融合蛋白;4:棉铃虫天然总蛋白.

图6 His-HaADH5多克隆抗血清的应用Fig 6 Application of anti-His-HaADH5 poly clonal antibody(A)棉铃虫不同组织天然总蛋白的SDS-PAGE电泳;M:蛋白Marker;1:体壁;2:脂肪体;3:中肠;(B)多克隆抗体与融合蛋白His-HaADH5的特异性结合检测;M:蛋白Marker;4:His-HaADH5融合蛋白;(C)多克隆抗体与棉铃虫不同组织天然总蛋白的特异性结合检测;M:蛋白Marker;5:体壁;6:脂肪体;7:中肠.
3 讨论
昆虫P450s的表达受顺式调控元件、反式作用因子或顺式作用元件和反式因子的共同调控,调控可能涉及转录活性增强的转录机制[8,15].P450超家族中,CYP6家族被认为与抗药性密切相关,P450 CYP6B6基因的表达与2-TD的代谢具有密切联系[5,16].前期研究表明2-TD会诱导棉铃虫P450 CYP6B6的过量表达,同时获得CYP6B6响应2-TD的核心元件,继而基于酵母单杂交技术通过核心元件筛选出调控因子-HaADH5[2].有文献报道,在花椒毒素的处理下,黑色凤尾蝶P450s的过表达受到参与Adh基因表达的GATA元件的调控,在果蝇幼虫Adh启动子中,GATA元件的功能独立于其他元件,在胚胎和脂肪体的形成过程中有转录激活的功能[10].在果蝇幼虫中,ADH作为转录因子的辅因子参与脂肪体的形成[11],Hataichanoke等人认为至少有一种蛋白质代谢的底物和响应外界毒素的P450s会通过调控级联反应,使宿主适应呋喃香豆素的存在[11].所以昆虫体内的ADH可能参与P450s的代谢通路,但这仍然需要进一步的研究.前期的凝胶阻滞和酵母单杂交的转录激活实验表明,HaADH5与CYP6B6响应2-TD的核心片段HE1结合,而棉铃虫中另一个已发表的ADH(GenBank登录号:AKD01727.1)却不能与HE1结合[2,17].因此说明本文中的HaADH5可能参与CYP6B6的调控表达,但是具体的代谢通路和信号途径尚不明确.
为进一步深入探讨HaADH5的功能,本文对其酶学性质进行研究.ADH5是一个含锌的二聚体酶,需要一种随底物而异的辅酶(NAD+),主要代谢长链醇类[17,18].在动物体内ADH5参与亮氨酸、异亮氨酸和缬氨酸的代谢,并能在此过程中使醛类减少[19].在人体内ADH5可以消除甲醛,对人的免疫调控、神经元发育和癌症的发生都有影响[18].在棉铃虫体内ADH5参与棉铃虫的蜕皮和变态发育过程[16].本实验以甲醛、短链醇类和异戊醇(3-甲基丁醇)为底物,发现His-HaADH5对异戊醇的亲和力高于甲醛和短链醇类,说明His-HaADH5主要功能不是代谢甲醛和短链醇类.有文献报道,重组菌表达的ADH最适温度是25℃或者35℃,当p H=10时,ADH5活性可以达到500至700 U/mg[13,14].我们以异戊醇为底物,发现His-HaADH5在p H=10,温度为35℃时其活性最高,可达到1 333 U/mg.鳞翅目昆虫的幼虫特性之一就是中肠偏碱性[20],His-HaADH5的最适pH=10,这能更好解释棉铃虫的中肠和脂肪体中存在HaADH5.实验表明,His-HaADH5具有广泛的底物特异性,可以催化包括异戊醇在内的五种底物的氧化,此外,His-HaADH5对异戊醇表现出明显的活性,异戊醇相对于其他四种底物而言属于长链醇.据报道,ADH5普遍存在于各组织中,可以使多种底物氧化,ADH5的主要底物是长链醇[21,22].因此本实验为ADH5的研究提供了一个新的参考依据,同时也为棉铃虫中HaADH5的功能研究奠定了基础.
制备抗体是研究基因功能的方法之一,昆虫乙醇脱氢酶的研究不常见,所以利用昆虫乙醇脱氢酶制备抗体的研究很少.本研究在原核表达体系中表达HaADH5,利用6×His纯化获得了单一的融合蛋白,免疫小鼠.继而用蛋白免疫法制备了HaADH5的抗血清,酶联免疫吸附检测该抗体的效价为1∶409 600,该抗血清的滴度达到预期要求,可应用于基于抗体识别的相关实验中,例如超凝胶阻滞(Super-EMSA)、免疫组化、染色质免疫共沉淀(CHIP)等.Western blot结果表明制备的HaADH5抗血清既能与融合蛋白His-HaADH5结合,也能与棉铃虫体内的天然蛋白HaADH5结合,与黄粉虫(Tenebrio molitor)体内的天然蛋白没有结合作用,说明制备的HaADH5抗血清有较好的免疫特异性.HaADH5抗血清在棉铃虫体壁、脂肪体和中肠的Western blot结果显示,HaADH5主要在脂肪体和中肠中存在,而在体壁中少量存在.而脂肪体被认为是昆虫的代谢组织,橘小实蝇(Bactrocera dorsalis)在溴氰菊酯的胁迫下,其脂肪体中的解毒代谢酶系的表达量显著高于对照组[23].以上结果表明在脂肪体和中肠中,HaADH5可能会参与棉铃虫的解毒过程.本文为HaADH5在蛋白水平上的功能研究奠定基础,为后期对HaADH5蛋白水平的鉴定提供了重要的检测工具.
在本实验中,对HaADH5进行原核表达、纯化,分析了在不同底物、不同p H、不同温度下的酶活,并成功制备了HaADH5的抗血清,Western blot不仅验证了抗原HaADH5的免疫活性,也证明了HaADH5主要在棉铃虫脂肪体中存在.以上结果为今后深入研究2-十三烷酮胁迫下棉铃虫HaADH5对细胞色素P450 CYP6B6的调控表达奠定基础.

