冠状病毒的研究进展
李向茸,李 倩,冯若飞
冠状病毒(Coronaviruses, CoVs)是套式病毒目(Nidovirales)冠状病毒科(Coronaviridae)正冠状病毒亚科(Orthocoronavirinae)的一类可引起人兽共患病的RNA病毒[1],因其形似中世纪欧洲帝王的皇冠,故称为冠状病毒[2]。它普遍存在于自然界,其宿主谱广泛,包括人、鼠、猪、猫、狼、鸡,甚至蝙蝠、穿山甲、果子狸、鸟类等[3-4],常引起动物、人呼吸道和肠道感染[5]。由于冠状病毒的遗传物质为单链RNA,稳定性较DNA病毒和双链RNA病毒差,在复制过程中更易发生错配,且因冠状病毒基因组结构是已知RNA病毒中最长的,故其发生遗传变异的风险较大。冠状病毒严重威胁着人兽健康,给我国乃至全球经济造成了不可估量的损失,典型的有2003年严重急性呼吸综合征冠状病毒(Severe Acute Respiratory Syndrome Coronavirus,SARS-CoV)和2012年发现的中东呼吸综合征冠状病毒(Middle East Respiratory Syndrome Coronavirus,MERS-CoV)所引发的两次令全球恐慌的重大疫情[6]。2020年2月11日国际病毒分类学委员会(ICTV)将该病毒命名为严重急性呼吸综合症冠状病毒2(Severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)对人类健康构成新的巨大威胁[7],截止2020年9月21日,全球新冠确诊病例已超过3 100万例,其中死亡约96万例。本综述从冠状病毒的分类、基因组与蛋白质结构、编码的蛋白质功能、致病机制与复制周期、病毒感染引起的免疫反应及检测和防治等方面对冠状病毒的研究进展进行系统介绍。
1 冠状病毒的分类
国际病毒分类委员会根据冠状病毒基因组序列和血清学特征的不同,将其分为α冠状病毒属(Alphacoronavirus)、β冠状病毒属(Betacoronavirus)、γ冠状病毒属(Gammacoronavirus)和δ冠状病毒属(Deltacoronavirus)[8](表1),其中β冠状病毒属又分为Embecovirus、Merbecovirus、Nobecovirus、Sarbecovirus和Hibecovirus5个亚属[9]。
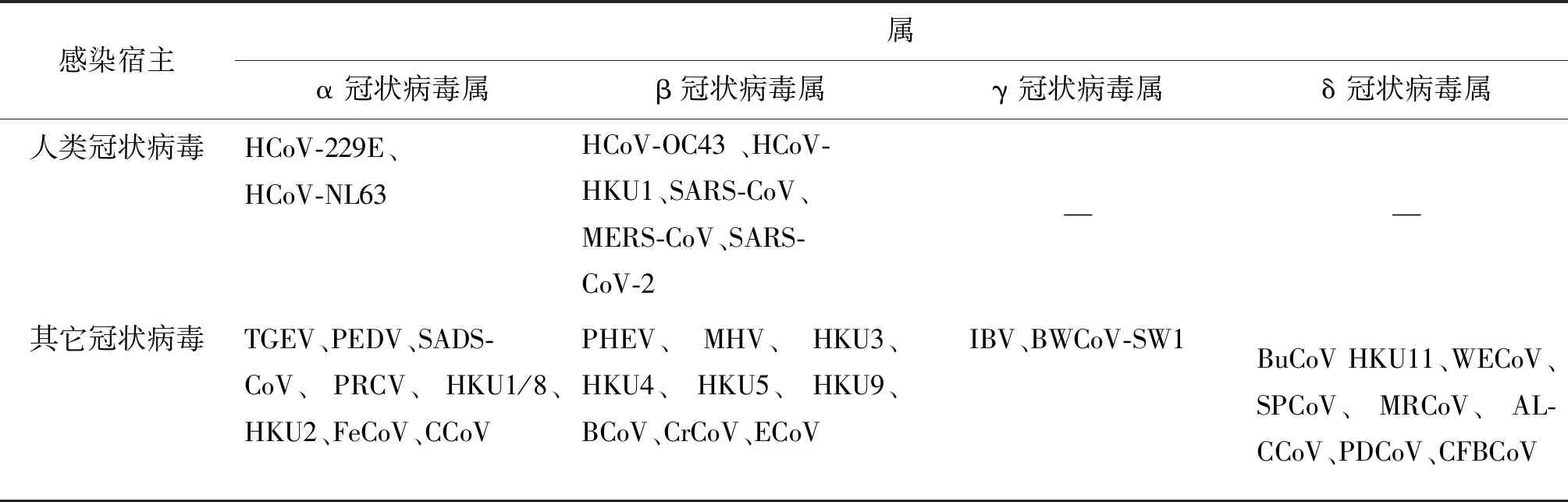
表1 冠状病毒的分类表Tab.1 Classification table of coronaviruses
在α冠状病毒属中,人类冠状病毒(Human coronavirus,HCoVs)有HCoV-229E 和 HCoV-NL63,猪冠状病毒有猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪急性腹泻综合征冠状病毒(swine acute diarrhea syndrome-coronavirus,SADS-CoV)和猪呼吸道冠状病毒(porcine respiratory coronavirus,PRCV)[10],另外还包括一些蝙蝠冠状病毒,如长翼蝠冠状病毒HKU1和HKU8(Miniopterus schreibersi coronavirus HKU1/8)、菊头蝠冠状病毒HKU2(Rhinolophus bat coronavirus HKU2),同时还有犬冠状病毒(Caninecoronavirus,CCoV)和猫肠道冠状病毒(Feline enteric coronavirus, FeCoV)[11]。
在β冠状病毒属中人类冠状病毒有HCoV-OC43 、HCoV-HKU1、SARS-CoV、MERS-CoV以及SARS-CoV-2,其中HCoV-OC43 和HCoV-HKU1属于Embecovirus亚属,SARS-CoV和SARS-CoV-2属于Sarbecovirus亚属,MERS-CoV属于Merbecovirus亚属。猪冠状病毒有猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus,PHEV),鼠冠状病毒有鼠肝炎病毒(Mouse hepatitis virus,MHV),另外蝙蝠冠状病毒包括HKU3、HKU4、HKU5和HKU9,同时还包括牛冠状病毒(Bovine coronavirus,BCoV)、马冠状病毒(Equine coronavirus,ECoV)和犬呼吸道型冠状病毒(Canine respiratory coronavirus,CrCoV)等[9,12-13]。
γ冠状病毒属中不包括人类冠状病毒,主要包括禽冠状病毒,如引起鸡、鸭、鹅、鸽子等感染的冠状病毒,其中最主要的是禽传染性支气管炎病毒,例如鸡传染性支气管炎病毒(Infectious bronchitis virus,IBV),同时还包括白鲸冠状病毒SW1(Beluga whale coronavirus SW1,BWCoV-SW1)[9]。
δ冠状病毒属多为鸟类冠状病毒,如夜莺冠状病毒(Bulbul coronavirus HKU11,BuCoV HKU11)、绣眼鸟冠状病毒(White-eye coronavirus,WECoV)、麻雀冠状病毒(Sparrow coronavirus,SPCoV)、鹊鸲冠状病毒(Magpie robin coronavirus,MRCoV)等,同时也包括亚洲豹猫冠状病毒(Asian leopard cats coronavirus,ALCCoV)、猪δ冠状病毒(Porcine delatcoronavirus,PDCoV)和中国白鼬獾冠状病毒(Chinese ferret-badger coronavirus,CFBCoV)[9-10]。
目前研究发现α 冠状病毒属和β冠状病毒属多感染哺乳动物,而γ冠状病毒属和δ 冠状病毒属中大部分为鸟冠状病毒,极少数也可以感染哺乳动物,因此要研究人冠状病毒首先应从α和β冠状病毒属入手,同时也不排除γ和δ冠状病毒属经变异进化而感染人类的可能性。
2 冠状病毒的基因组及蛋白结构
冠状病毒呈球形且具有多形型,直径约80~160 nm[14],有囊膜,并包含一段不分段的、线性单股正链RNA基因组,其基因组是已知RNA病毒中最长的,约27~32 kb[15],该RNA含有5′帽子结构和3′聚腺苷酸,还包含多个开放阅读框。其中靠近5′端的开放阅读框编码多聚蛋白pp1a和pp1ab,这两个多聚蛋白又可被进一步剪切成15到16种非结构蛋白,靠近3′端的负责编码病毒结构蛋白和数量不等的辅助蛋白,结构及非结构蛋白对于病毒复制来说是必不可少的[12,16]。如图1所示,不同种属冠状病毒的基因组长度不一,结构分布多样,编码的蛋白种类和与之结合的细胞受体也不尽相同。
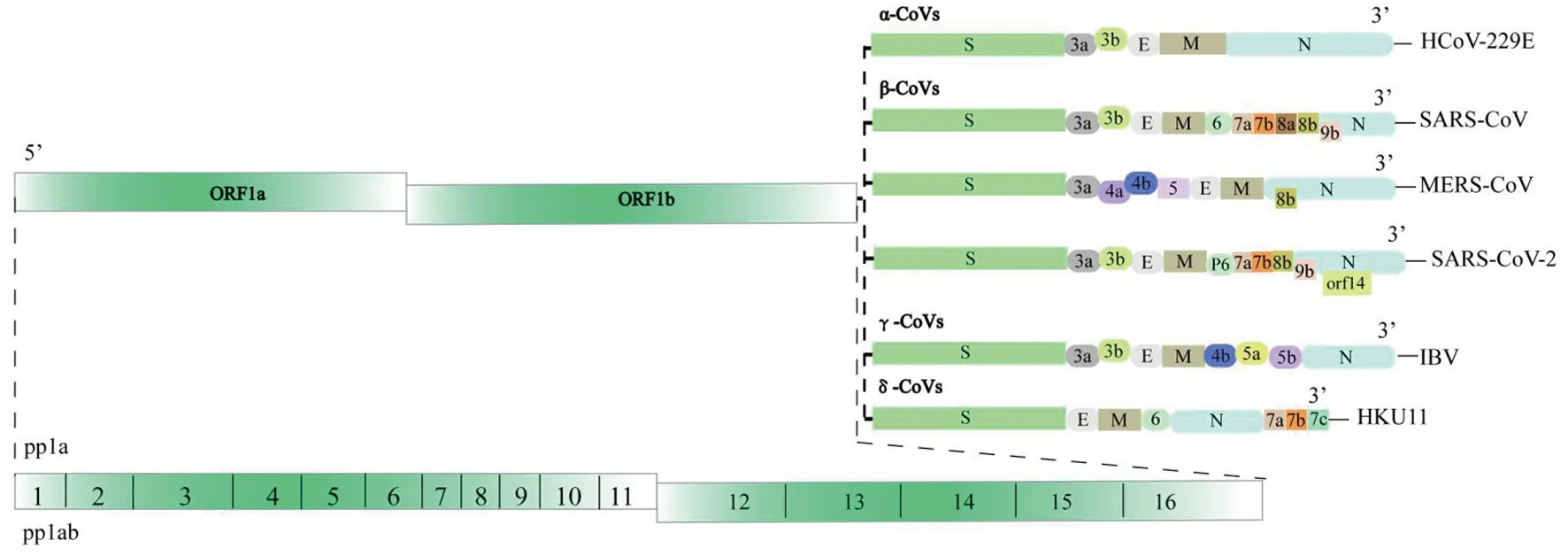
图1 冠状病毒基因组结构示意图[17-19]Fig.1 Schematic diagram of the genome structure of Coronaviruses
3 冠状病毒的蛋白质功能
冠状病毒的非结构蛋白包括nsp1~nsp16,主要与病毒基因组转录、复制相关,进而调控下游基因表达[20](表2);结构蛋白由内而外主要由核衣壳蛋白(nucleocapsid, N)、膜糖蛋白(membrane glycoprotein, M)、包膜蛋白(envelope protein, E)和刺突蛋白(spike protein, S)组成[21],部分冠状病毒表面还含有血凝素酯酶蛋白(Hemagglutinin-esterase protein, HE)。结构蛋白功能各异(表3),均对冠状病毒复制发挥不可替代的作用,在进化过程中易发生变异,不同冠状病毒之间差异较大,而不同冠状病毒的非结构蛋白相对更加保守。

表2 冠状病毒编码非结构蛋白的功能Tab.2 Function of nonstructural protein encoded by coronaviruses

表3 冠状病毒编码结构蛋白的功能[18]Tab.3 Function of structural protein encoded by coronaviruses
除此之外,冠状病毒还可编码一些特有的辅助蛋白,尽管它们对病毒的复制不是必需的,但仍能在病毒感染宿主过程中发挥特定的调控作用,有的辅助蛋白能够拮抗宿主细胞限制因子的抗病毒能力,从而提高病毒的复制能力;有的可以影响病毒的毒力;有的还可以参与病毒粒子的组装,促进病毒粒子的成熟等过程[50]。目前针对冠状病毒的蛋白研究仍然十分有限,还不够深入和系统,各蛋白在病毒感染宿主的整个进程中的作用还不十分明确,核酸检测、药物和疫苗开发的靶点多聚焦在有限的几个基因或蛋白上,故还需要深入解析冠状病毒各蛋白的结构,了解其与宿主相互作用的分子机制,为破解病毒的致病机理和疫病防治助力。
4 冠状病毒的致病机制与复制周期
冠状病毒的致病过程大致分为3个阶段,即病毒侵入、复制阶段、过度免疫应答和急性肺损伤阶段[51],它们首先经由飞沫传播、气溶胶传播和接触传播等途径到达机体,靠静电作用吸附在细胞外表面,随后病毒表面的刺突蛋白(S)或血凝素酯酶蛋白(HE)与敏感细胞膜表面特异性的细胞受体识别并结合(表4),并利用多种方式成功逃逸宿主天然免疫反应,启动病毒的生命周期。与此同时在机体与病毒的这场博弈中会诱发大量的促炎性细胞因子和趋化因子产生,启动“细胞因子风暴”效应,使靶细胞受损或死亡,进而造成局部组织、器官病变或坏死,最后释放出的子代病毒再不断地去感染其他未受感染的细胞,并随着病毒的不断复制,使机体病情不断恶化,病程加剧。冠状病毒感染的主要致病特征是呼吸道感染与宿主免疫系统的过激反应。冠状病毒复制周期主要分为以下几个步骤:吸附与侵入、基因的复制与转录以及病毒颗粒的组装及释放。
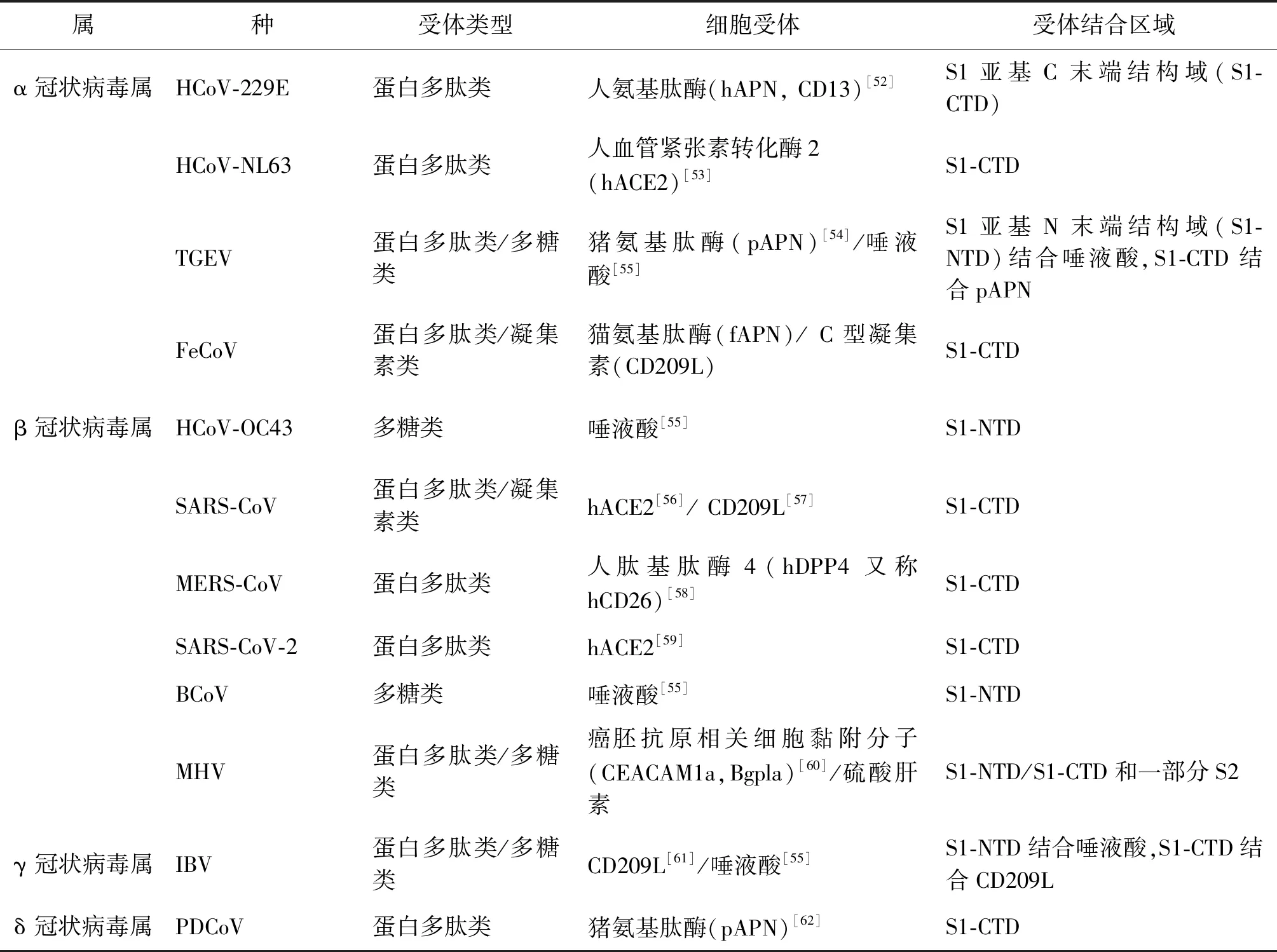
表4 部分冠状病毒的细胞受体Tab.4 Cellular receptors for some coronaviruses
4.1吸附与侵入 冠状病毒的吸附是由S或HE蛋白与细胞表面受体结合而启动的。通常S和E蛋白的激活均需要在宿主分泌的弗林蛋白酶(furin)的作用下将其切割成受体结合亚单位S1和膜融合亚基S2,随后S1亚基中的RBD基序与细胞受体发生特异性的相互作用,触发S2亚基构象变化,诱发病毒囊膜与细胞质膜融合进入宿主细胞内,这种融合可以是两者的直接融合,也可以先由受体介导的内吞作用形成内体,然后内体膜与病毒囊膜融合,并释放核衣壳和基因组RNA至细胞质中。病毒宿主范围和组织嗜性很大程度上取决于细胞受体,目前部分冠状病毒的细胞受体已经得到鉴定,如表4所示,按照化学性质主要分为多糖类、蛋白多肽类和凝集素类受体。同一属冠状病毒的细胞受体也不尽相同,部分冠状病毒还存在不止一个受体,不同属冠状病毒的细胞受体也可能相同。有研究报道多种宿主蛋白与冠状病毒的吸附及进入有关。例如,SARS-CoV S蛋白的激活需要内体半胱氨酸蛋白酶组织蛋白酶L[63]和另一类胰蛋白酶样丝氨酸蛋白酶的顺序切割。此外,Ⅱ型跨膜丝氨酸蛋白酶(TMPRSS2)和TMPRSS11D也参与了SARS-CoV和HCoV-229E的S蛋白激活[64]。同样一些宿主蛋白也会限制部分冠状病毒的吸附及进入。例如,干扰素诱导的跨膜蛋白(IFITMs)对各种冠状病毒均表现出广谱的抗病毒功能[65],SARS-CoV、MERS-CoV、HCoV-229E和HCoV-NL63的进入均受到IFITMs的限制。然而,HCoV-OC43却可以利用IFITM2或IFITM3作为进入因子以促进自身感染。最近的一项研究确定了IFITMs中的几个氨基酸残基,它们控制着对HCoV进入的限制或促进活性[66]。
4.2基因的复制与转录 在病毒进入和脱衣壳后,基因组RNA作为转录本,ORF1a依赖帽子结构进行翻译,产生多聚蛋白pp1a,接着继续在ORF1b上进行翻译产生更长的多聚蛋白pp1ab。pp1a和pp1ab通过自身的水解形成了16个具有不同功能的非结构蛋白。其中NSP12负责编码依赖RNA的RNA聚合酶(RNA-dependent RNA polymerase, RdRP),而NSP3和NSP5分别编码木瓜样蛋白酶(papain-like protease,PLpro)和主要蛋白酶(main protease,MPro)[67-68]。NSP3、4和6可以诱导细胞膜重排进而形成双膜囊泡(double-membrane vesicles,DMV)或小球,同时还可以组装冠状病毒的复制转录复合物(replication transcription complex,RTC)。在DMV形成和RTC组装方面,早期分泌途径中的宿主因子也参与其中,如高尔基抗性鸟嘌呤核苷酸交换因子1(Golgi-specific brefeldin A-resistance guanine nucleotide exchange factor1,GBF1)及其效应因子ADP核糖基化因子1(ADP ribosylation factor 1,ARF1)均是MHV中DMV形成和RTC组装所必需的[69-70]。
基因组的复制与转录主要由病毒复制酶介导,并受RTC的限制,同时也需要多种宿主因子的参与。例如,糖原合成激酶3(glycogen synthase kinase 3,GSK3)可使SARS-CoV的N蛋白磷酸化进而促进模板的转换,抑制GSK3可以抑制感染SARS-CoV的Vero E6细胞中病毒的复制;另一种称为异质核糖核蛋白A1(heterogeneous nuclear ribonucleoprotein A1,hnRNPA1)的RNA结合蛋白也可以与SARS-CoV 的N蛋白紧密结合,并有可能调节病毒RNA的合成[71]。此外,MHV的 N蛋白的磷酸化招募了一个RNA结合蛋白DEAD-BOX螺旋酶1(DEAD-box helicase 1,DDX1),它促进了模板的通读,有利于基因组RNA和更长的小向导RNA(small guide RNA,sgRNA)的合成[72]。冠状病毒的跨膜结构蛋白(S,HE,M和E)和一些膜相关的辅助蛋白在内质网中翻译,而N蛋白由胞质游离至核糖体中进行翻译。大多数冠状病毒结构蛋白都通过翻译后修饰调节其功能。例如,S和M蛋白都通过糖基化修饰,S蛋白的N-连接糖基化参与凝集素介导的病毒粒子的附着,并形成一些中和表位,此外M蛋白的O-连接糖基化影响MHV诱导I型干扰素的能力及其在小鼠体内的复制[73-74]。
4.3病毒颗粒的组装及释放 病毒颗粒的组装发生在内质网与高尔基体的中间隔室(ER-Golgi intermediate compartment,ERGIC),并由M蛋白进行协调。M蛋白与其它结构蛋白相互作用促进了病毒粒子的形态发生,M蛋白与S或N蛋白相互作用促进了结构成分向组装位点的招募。而E蛋白通过与M蛋白的相互作用诱导膜弯曲进而促进病毒颗粒的组装。进入ERGIC的冠状病毒颗粒以光滑的囊泡进行运输,并最终通过分泌途径通过胞吐释放。萌芽进入ERGIC的冠状病毒颗粒在光滑的囊泡中运输,并通过胞吐的分泌途径释放[75-76]。冠状病毒的组装与释放同样也需要多种宿主因子的参与。例如微管蛋白与HCoV-229E、HCoV-NL63和TGEV的S蛋白胞浆结构域之间的相互作用是成功组装和释放感染性病毒颗粒所必需的[77]。此外,IBV的M蛋白与β-肌动蛋白、TGEV的N蛋白与波形蛋白以及TGEV的S蛋白与细丝蛋白A之间的相互作用也被证明可以促进冠状病毒颗粒的聚集及释放[78]。
5 冠状病毒感染引起的免疫反应
机体受到病毒感染后,会引发一系列的免疫应答反应,以抵制病原体的入侵,本文将从细胞因子风暴、自噬、凋亡、内质网应激这4方面对冠状病毒感染引起的免疫反应进行阐述。
5.1细胞因子风暴
细胞因子风暴(Cytokine storm)是指机体免疫功能异常或由于细菌、病毒等微生物感染后引起体液中大量促炎性细胞因子迅速产生,然后不断活化更多的免疫细胞聚集到炎症部位,随之引起组织充血、红肿、损伤的现象。炎症因子大量生成,形成“免疫风暴”,对自身展开“自杀式攻击”,虽然能够消灭病原体,但也会对自身组织造成严重的损伤,所谓免疫系统的“杀敌一千,自损八百”。SARS-CoV、MERS-CoV和SARS-CoV-2等冠状病毒感染引起的细胞因子风暴是致病性炎症的根本原因,同时也是诱导急性呼吸窘迫综合征(ARDS)和多器官衰竭的主要原因之一[79-80]。细胞因子风暴的特点是机体血清中一系列的促炎性细胞因子和趋化因子水平升高,如IFN-α、IL-1β、IL-6、TNF-α和CXCL10 等[80-82]。据报道,MERS-CoV、SARS-CoV-2感染患者血清中细胞因子风暴的强弱程度与疾病的严重程度呈正相关[83-84]。不同的冠状病毒可通过不同的机制触发细胞因子风暴,故会引起不同细胞因子的变化。比如SARS-CoV引起的细胞因子风暴主要与IL-6、IL-1β、IL-12、IFN-γ、MCP-1以及IP10有关[80],而SARS-CoV-2重症患者血液中IL-2、IL-7、IL-10、G-SCF、IP10、 MCP-1、MIP-1A、TNF-α均明显升高[84]。但有研究表明粒细胞-巨噬细胞集落刺激因子(GM-CSF)和白介素6(IL-6)是引发新冠肺炎患者细胞因子风暴中的两个关键炎症因子[85]。
5.2自噬 自噬是一种分解代谢的过程,它对细胞的发育和生存起着重要的作用,除了在生理上的作用外,自噬也被证明在调节病毒复制和抗病毒免疫反应中起着重要作用[86-88]。根据研究显示,冠状病毒可以诱导细胞自噬,MERS的 3C样蛋白酶(3C-like protease,3CLpro)是一种新的细胞自噬诱导蛋白,能诱导宿主细胞自噬,同样在SARS-CoV 和HCoV-NL63中,3CLpro也能诱导宿主细胞自噬[89-90]。冠状病毒的膜相关木瓜蛋白酶PLP2(membrane-associated papain-like protease PLP2,PLP2-TM)也是一种新的自噬诱导蛋白,它可以通过增加自噬小体的积累而阻止自噬小体与溶酶体的融合,从而诱导不完全自噬的发生,为病毒复制提供场所。此外PLP2-TM与关键的自噬调节因子LC3和Beclin1相互作用,并促进Beclin1与抗病毒IFN信号的关键调节因子STING相互作用进而负调控抗病毒天然免疫[91]。此外,IBV、MHV或SARS-CoV的NSP6可以促进自噬小体的形成。自噬对于冠状病毒的影响因细胞系及病毒株的不同而异,例如在感染TGEV SHXB株的猪上皮细胞中激活自噬有利于病毒复制,而在感染TGEV的猪睾丸细胞或感染PEDV的IPEC-J2细胞中,自噬的激活确实抑制了病毒的复制。抑制S期激酶相关蛋白2(S-phase kinase-associated protein 2, SKP2)可以降低其对Beclin1的泛素化,增强自噬,进而抑制MERS的复制[92]。
5.3凋亡 细胞凋亡是细胞程序性死亡的一种形式,是指细胞在生理或病理条件下,为保持内环境的稳定而通过基因调控使细胞主动消亡的过程[93]。冠状病毒诱导的细胞凋亡已被广泛研究,无论是动物模型还是各种体外系统均发现明显的凋亡现象,在SARS-CoV感染的肺、脾和甲状腺组织中观察到细胞凋亡的特征,HCoV-OC43诱导神经细胞凋亡,而MERS-CoV可以诱导原代细胞凋亡。冠状病毒的蛋白参与诱导凋亡的过程中,如SARS-CoV的S蛋白、M蛋白、N蛋白及3CLpro增加了细胞内Ca2+浓度,从而使线粒体膜的通透性增加,促进了细胞凋亡[94-96]。MERS-CoV、PEDV的S1蛋白能通过激活细胞膜的死亡受体Fas/CD95,触发Caspase级联凋亡反应,形成凋亡小体。同样TGEV、IBV、CCoV也是通过膜上的死亡受体,引起Caspase依赖的凋亡。PEDV还能够通过活化p53以及促进ROS的积累诱导细胞凋亡。PDCoV感染通过促使线粒体膜间隙的细胞色素C进入胞浆而启动caspase依赖的线粒体凋亡通路。然而部分冠状病毒也可以抑制凋亡 ,如SARS-CoV 的3a蛋白可以通过与CAML分子结合进而抑制细胞凋亡。PEDV的 E 蛋白通过激活NF-κB上调Bcl-2,Bcl-2可以抑制Bax 的激活,从而抑制细胞凋亡的发生。另外,SARS-CoV 的PLPs 也可以抑制p53 介导的细胞凋亡[97-98]。
5.4内质网应激反应 内质网是合成、折叠和翻译后修饰蛋白的重要细胞器,受细胞外环境和生理的影响,内质网中合成的蛋白量会出现大幅度波动,当内质网折叠能力达到上限时,未折叠蛋白便会在内质网中积累,导致内质网应激反应[99-100]。为了恢复内质网的稳态,未折叠蛋白反应(unfolded protein response ,UPR)将被激活,UPR由PKR样内质网蛋白激酶(protein kinase RNA-activated (PKR)-like ER protein kinase, PERK)、肌醇需求酶1(inositol-requiring enzyme 1,IRE1)和激活转录因子6(activating transcription factor 6,ATF6)3个信号通路组成[100-101]。在冠状病毒感染过程中,病毒结构蛋白大量产生,尤其是S蛋白,它的折叠和成熟很大程度上依赖于内质网伴侣蛋白和修饰酶,因此仅S蛋白的过度表达便会引起内质网应激反应[102]。
PERK通路是3个UPR信号通路中第一个被激活的,它是由伴侣蛋白GRP78结合未折叠蛋白后进行激活。SARS-CoV感染细胞可诱导PERK和eIF2α的磷酸化,磷酸化的eIF2α会上调ATF4,而ATF4进一步诱导它的同源蛋白CHOP,最终诱导凋亡。除此之外,MERS-CoV、MHV和TGEV也可以诱导eIF2α的磷酸化。IRE1除了像PERK一样通过GRP78被激活外,其N端结构域还可以直接与未折叠蛋白结合进而被激活。MHV和IBV的S蛋白可以诱导IRE1的磷酸化,TGEV 感染也能够激活IRE1信号通路,并且通过抑制miR-30a-5p 的表达,使SOCS1/3 的表达增加,进而促进了病毒的感染。关于UPR信号通路中ATF6的研究较少,由文献报道SARS-CoV的辅助蛋白8ab与ATF6存在相互作用,并且ATF6发生核移位,但其具体机制仍不详[103-104]。
6 冠状病毒的检测方法和防治
冠状病毒是一种传染性比较强的病毒,会通过直接、间接接触或气溶胶进行传播,从感染后到疾病发作需要经历一个两周左右的潜伏期,早期症状与感冒类似,还有研究表明SARS-CoV-2感染的患者或无症状感染者在潜伏期就具有传染性,所以及时准确的对疑似病例进行确诊、研发有效的治疗药物和抗体以及开发安全有效的疫苗是防止疫情进一步扩大的重要手段。
6.1实验室检测方法 实验室检测技术是快速确诊病例、监控传染动态和病情发展的首要利器。表5列举了SARS-CoV-2几种常规的实验室检测方法。

表5 SARS-CoV-2的实验室检测技术Tab.5 The detection technique to SARS-CoV-2 in the laboratory
上述这些检测方法均各有其特点和适用范围,在临床诊断和防疫工作中应结合临床特征,通过多次核酸检测或联合使用核酸检测和血清学检测方法尽早对感染者进行确诊,并对密切接触者尽快排查。截止2020年8月5日,中国国家药监局审批的新型冠状病毒检测试剂盒共计44个,其中RT-qPCR法核酸检测试剂盒17个,其他核酸检测试剂盒6个,血清学检测试剂盒21个(https://baijiahao.baidu.com/s?id=1674159865329104240&wfr=spider& for=pc)。
6.2治疗药物和抗体 人类冠状病毒主要包括7种,其中HCoV-HKU1、HCoV-NL63、HCoV-OC43和HCoV-229E这4种病原体致病性较低,引起的病症较轻;而SARS-CoV-2、SARS-CoV及MERS-CoV严重威胁着人类健康、社会公共卫生安全和经济发展,目前,尚无针对这3种冠状病毒感染的特异性疗法,患者多采用支持性治疗为主、多种药物组合为辅的治疗方案[18]。当前抗冠状病毒药物靶点主要集中在S 蛋白、与病毒转录复制相关的RdRp、PLpro、3CLpro、细胞受体以及宿主蛋白酶抑制剂等[111-112]。自SARS-CoV-2暴发以来,世界各研究团队筛选出一系列具有潜在治疗效果的药物,本文借鉴这些研究并参考国家卫生健康委员会印发的《新型冠状病毒肺炎诊疗方案》(试行第八版)列举了具有潜在治疗新型冠状病毒肺炎的一些药物(表6)。

表6 新型冠状病毒肺炎治疗的潜在药物Tab.6 Potential therapeutics for COVID-19
面对突如其来的新冠肺炎疫情,各个科研攻关团队可谓是百花齐放,有老药新用的,有中西医结合的,也有通过组学、虚拟筛选和酶学测试等策略筛选到新药或天然活性物质的。虽然有的药物完全无效,有的单独用药(如洛匹那韦/利托那韦或利巴韦林)无效,但联合应用利巴韦林与干扰素或洛匹那韦/利托那韦对轻中症患者有明显效果[121];有的小规模试验有较好的疗效,但是仍需要大量的临床证据来验证其是否安全有效。
6.3SARS-CoV-2疫苗研究现状 当前领跑的几款SARS-CoV-2疫苗见表7。疫苗从原理和技术工艺上主要分为灭活疫苗、核酸疫苗、腺病毒载体疫苗、重组蛋白疫苗和减毒流感病毒载体疫苗。截止2020年9月21日,全球新冠确诊病例已超过3 100万例,其中死亡超过96万例。据世界卫生组织2020年9月17日的数据显示,目前全球已有182款SARS-CoV-2候选疫苗,其中146个正处于临床前研究阶段,进入临床试验阶段的仅有36款,其中9款疫苗处于Ⅲ期临床试验阶段。基于SARS-CoV 和 MERS-CoV 疫苗的研究经验,发现SARS-CoV-2疫苗的研究主要靶标分子仍是S蛋白。
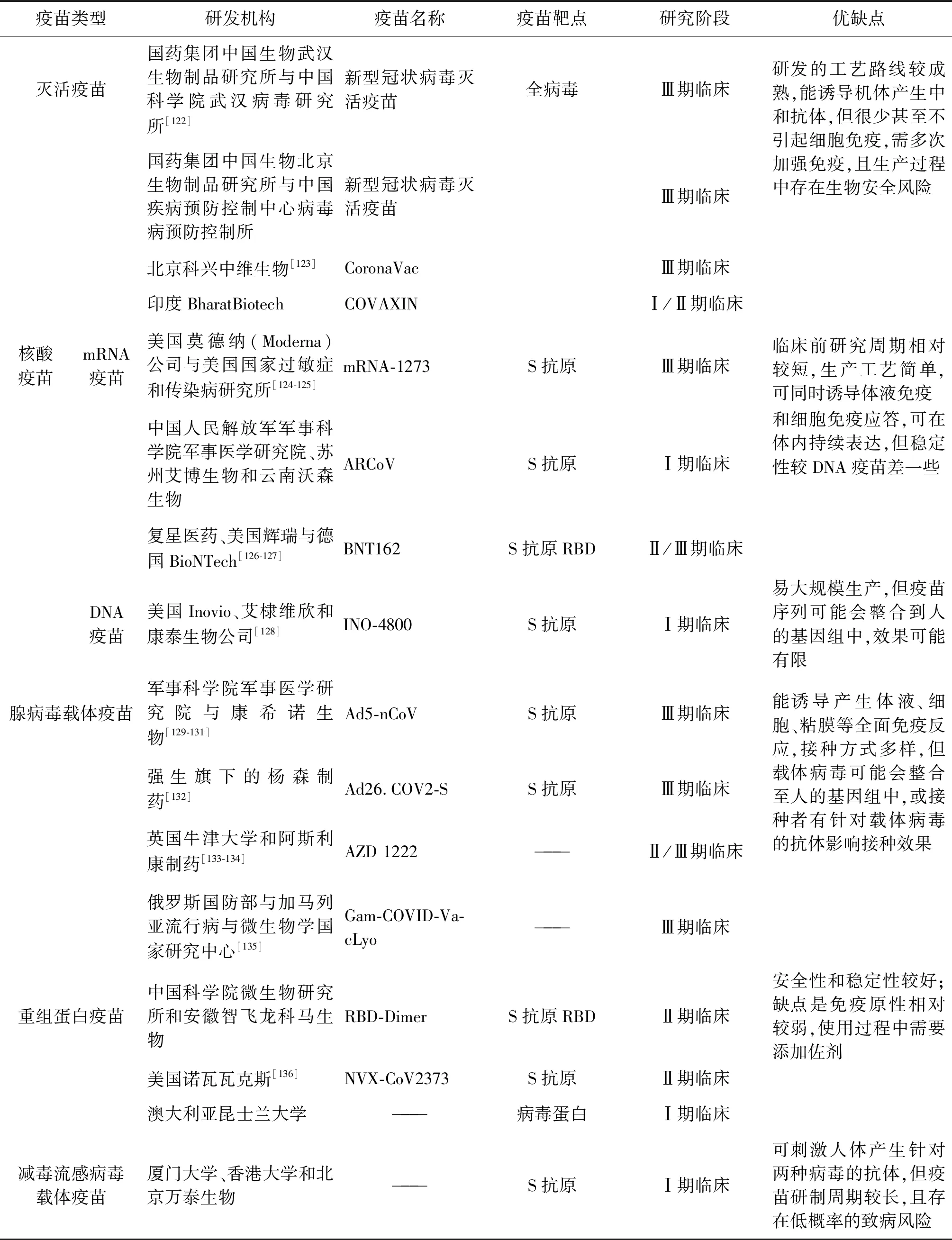
表7 SARS-CoV-2疫苗的研究进展Tab.7 Progress in vaccine research of SARS-CoV-2
7 展 望
目前新型冠状病毒的出现给全世界人类健康带来了巨大危害,并且对全球经济也构成了巨大威胁。冠状病毒的出现迄今已经约80年,2003年SARS-CoV的出现使科研工作者对其投入了大量的研究,也取得了许多可人的成就,成功控制住了疫情,但是由于冠状病毒宿主谱广泛且存在变异的风险,致使SARS-CoV-2卷土重来,因此重新审视冠状病毒非常必要。本文详尽地从冠状病毒的分类、基因与蛋白结构、编码的各蛋白质功能、致病机制与复制周期、参与的免疫反应、检测与防治等方面对冠状病毒加以综述,但冠状病毒容易发生变异、种类繁多且结构复杂,对冠状病毒的认识不应止步于此。随着检测技术的不断发展,人们对冠状病毒的认识也不断深入,并且随着病毒与人类的协同进化,人类终将战胜当前在全球掀起腥风血雨的SARS-CoV-2,消除其对人类健康的威胁。
利益冲突:无

