新型冠状病毒在Vero-E6细胞中的增殖特征分析
张炎华,何文祥,朱 颖,陈 炜,吴冰珊,修文琼,陈宏彬,俞婷婷,鄢育青,吴晶晶,袁 平,张小鸿,骆 婧,翁育伟,郑奎城
新型冠状病毒(2019-nCoV)属于β属冠状病毒,有包膜,颗粒呈圆形或椭圆形,常为多型性,直径60~140 nm。该病毒的传播力可能要高于SARS冠状病毒,不同研究团队计算得到的基本再生指数(R0)有不同,大致在2~4之间[1-2]。病毒通过其表面的刺突蛋白(Spike protein,S蛋白)与宿主细胞表面的血管紧张素转化酶2(ACE2)结合[3]而发生吸附、穿入、脱壳、生物合成与组装、成熟与释放等一系列增殖过程。2019-nCoV的体外培养可在Vero-E6、Huh7及人呼吸道上皮细胞进行。为更好地了解2019-nCoV体外增殖情况,本研究利用一步增殖实验分析病毒在Vero-E6细胞中的增殖特征,并对比了不同实验方法下半数组织培养感染剂量(TCID50)的差异,以期为后续的研究提供一定的基础和依据。
1 材料与方法
1.1 材 料
1.1.1材料来源 2019-nCoV病毒株(hCoV-19/Fujian/13/2020)由福建省疾病预防控制中心分离获得并经全基因组测序(序列号:GISAID No. EPI-ISL-411066)[4],毒株经Vero-E6传代2代,毒株于接种后第6 d收获,-80℃保存。病毒分离及TCID50测定等均在BSL-3实验室内进行。
1.1.2试剂及仪器 Vero-E6细胞(ATCC○RCRL-1586TM)、细胞培养基Minimum Essential Medium(Gibco,Ref. No.41500-034)、胎牛血清(PANSera ES,Cat. No.2602-P130707)、核酸提取试剂盒QIAamp Viral RNA Mini Kit(QIAGEN,Cat. No.52906)、荧光PCR反应体系为AgPath-IDTMOne-step RT-PCR Kit(Life Technologies,Cat. No.AM1005)以及中国疾控中心推荐的引物和探针[5];仪器设备包括二氧化碳培养箱(Innova○Rnco-170)、细胞计数仪(Life,Countess Ⅱ FL)、倒置显微镜(Nikon ECLIPSE TS100)、荧光PCR仪(ABI QuantStudioTMDx)等。
1.2 方 法
1.2.1病毒半数感染剂量(TCID50)的测定 将接种后第6 d(细胞已完全病变)的病毒培养液冻融1次后,离心取上清并分装冻存。取1管冻存的病毒液按半对数稀释法自10-2稀释至10-7,96孔板中长满单层的Vero-E6贴壁细胞用细胞维持液(含2%胎牛血清的MEM)洗涤2遍,加入100 μL稀释好的病毒液,每个稀释度重复4孔,以细胞维持液为阴性对照,置36 ℃、5% CO2的二氧化碳培养箱中孵育90 min,期间每30 min晃动细胞板1次。孵育完成后吸出病毒液,用细胞维持液洗涤细胞1遍后,每孔加入200 μL细胞维持液,置36 ℃、5% CO2的二氧化碳培养箱中孵育,每日观察细胞病变,于接种后第6 d终止实验,根据Reed-Muench方法计算TCID50。为比较不同实验条件对TCID50的影响,本研究还设置了病毒冻融、病毒在贴壁细胞中吸附后是否洗涤以及不同细胞浓度悬液条件下测定TCID50的差异。
1.2.2病毒增殖及滴度测定 将病毒储存液稀释至5 TCID50/100 μL,取病毒液7.8 mL(根据培养容器底面积和测定TCID50时100 μL/孔的量换算)接种至T25(底面积为25 cm2)细胞培养瓶中(细胞贴壁密度在95%~100%,细胞数量约2.42×106/瓶,MOI约为1.74×10-4TCID50/cell),置36 ℃、5% CO2的二氧化碳培养箱中孵育90 min,期间每30 min晃动细胞瓶1次,孵育完成后吸出病毒液,用细胞维持液洗涤细胞1遍,往细胞瓶中加入10 mL细胞维持液,置36 ℃、5% CO2的二氧化碳培养箱中孵育,从孵育后开始,每24 h观察细胞病变并同时吸取0.55 mL增殖产物,离心后上清冻存于-80 ℃备用,至第6 d时终止实验。将每日收集上清从原始浓度开始半对数稀释至10-5,并接种至96孔细胞板,每个稀释度3孔,每日观察细胞病变,测定病毒TCID50。
1.2.3不同时点病毒核酸含量的测定 取50 μL每日吸取的培养上清稀释至500 μL后取140 μL进行核酸提取,核酸洗脱量为50 μL,每个样本重复提取核酸3次后根据中国疾控中心推荐的检测方案进行检测。根据该方案推荐的引物扩增N基因片段,测定扩增产物DNA的吸光度并计算其浓度。将已知浓度的扩增产物系列稀释后作为核酸扩增模板,根据上述检测方案测出不同核酸浓度对应的Ct值(Cycle Threshold)后绘制标准曲线,最后根据标准曲线计算每日增殖的培养上清液核酸浓度。
2 结 果
2.12019-nCoV病毒株TCID50的测定结果 根据细胞病变结果,计算出该毒株的半数感染剂量为10-3.7TCID50/100 μL。对比不同实验条件下的TCID50可以发现:冻融会降低病毒的感染滴度,应尽量避免;细胞悬液为3×104/mL时的TCID50值低于2×105/mL时的TCID50值,但差异不大;病毒在贴壁的Vero-E6细胞中吸附90 min后吸去病毒液并洗涤1次时的TCID50值低于不吸去不洗涤时的TCID50值,但差异不大。不同实验方法下的TCID50结果见表1。
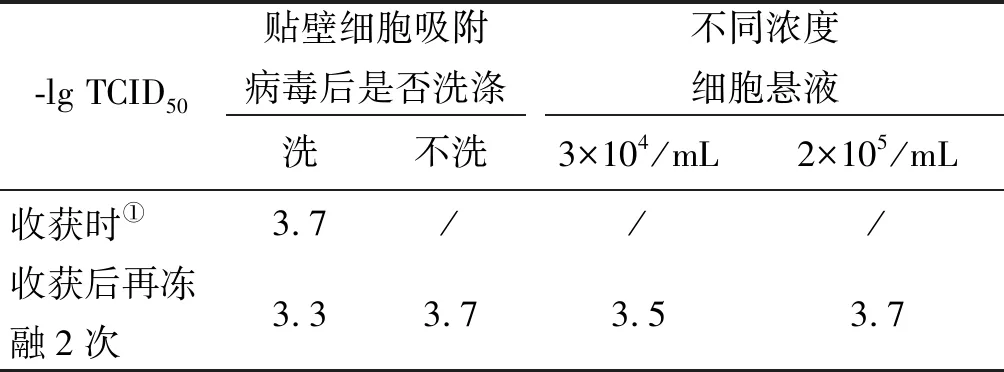
表1 不同实验条件对2019-nCoV TCID50测定的影响Tab.1 Effect of different test conditions on TCID50 determination of 2019-nCoV
2.2新型冠状病毒在Vero-E6细胞中的增殖情况 将浓度为1.74×10-4TCID50/cell的病毒接种至Vero-E6细胞后,第1 d无肉眼可见的细胞病变,第2 d约有25%的细胞发生病变,第3 d有超过50%的细胞发生病变,第4 d绝大部分的细胞已发生病变。测定每日增殖产物的病毒感染滴度,根据N基因定量结果绘制标准曲线并计算上清液核酸浓度。结果显示,2019-nCoV在Vero-E6细胞中的前48 h迅速增殖,平均复制周期约为3.29 h,核酸浓度和感染滴度在48 h左右达到峰值,之后核酸浓度维持在较高水平但感染滴度开始逐渐下降。增殖上清液的病毒滴度和核酸浓度结果见图1和表2。
图1 2019-nCoV在Vero-E6细胞中增殖时其感染滴度和RNA浓度的时间分布曲线Fig.1 Time distribution curve of the viral titer and RNA concentration of 2019-nCoV in Vero-E6 cells
表2 2019-nCoV在Vero-E6细胞中增殖时其感染滴度和RNA浓度的时间分布Tab.2 Time distribution of the viral titer and nucleic acid concentration of 2019-nCoV in Vero-E6 cells
3 讨 论
病毒本身缺乏增殖所需的酶系统,只能在易感的活细胞内进行增殖。病毒增殖过程中的吸附、穿入、脱壳、生物合成与组装、成熟与释放等各个阶段都影响着病毒在宿主细胞中的增殖特征。本文从病毒活性和数量相对时间变化两个方面对2019-nCoV在Vero-E6细胞中的增殖情况进行分析,获得了较为初步的增殖特征。
无论从病毒感染滴度还是核酸扩增结果来看,在起始MOI为1.74×10-4TCID50/cell条件下,2019-nCoV在Vero-E6细胞中的增殖情况均表现为接种后前2 d迅速增殖,并在第2 d左右达到峰值,这与SARS-CoV的增殖特征相近[6-7]。病毒感染滴度在第2 d后开始迅速下降,可能是由于细胞病变后,病毒失去寄生的宿主而无法继续复制,加上培养条件下病毒逐渐失去活性所致。培养上清中的核酸经过快速复制后维持在较高水平,反映了病毒的数量在培养上清中维持稳定,但病毒感染活性逐步下降。从核酸水平来看,核酸浓度在0~24 h(第1 d)内大约上升了126倍,在24~48 h(第2 d)内大约上升了157倍,在48~72 h内大约上升了1.7倍。由于第0 d培养上清中的核酸浓度仅表示吸附阶段未被细胞吸附且未洗涤干净的部分,已经被细胞吸附的活病毒核酸难以估计,也就是说起始核酸浓度难以准确估计,我们以24~48 h内的核酸浓度变化来估算病毒的增殖速度。按照2n的增殖模型,我们可以计算出2019-nCoV病毒在Vero-E6细胞中的平均复制周期约为3.29 h,这比SARS-CoV在Vero-E6细胞中增殖的周期7~10 h[6,8]要短得多。
关于TCID50的测量方法,不同的病毒在不同的文献中有差别,如肠道病毒使用2×105个/mL的细胞悬液来测量[9],而流感病毒使用贴壁细胞来测量[10-11]。本文对不同细胞悬液浓度、病毒吸附贴壁细胞后是否洗涤以及病毒的冻融次数等条件对TCID50的影响做了初步比较,以供更多的研究者参考。本次研究表明,不同细胞悬液浓度、病毒吸附贴壁细胞后是否洗涤对测定TCID50影响不大,但用于TCID50测定的病毒液应避免反复冻融,以免影响病毒感染滴度。
本文初步分析了2019-nCoV在Vero-E6细胞中的增殖情况,研究结果仍可为病毒的分离培养、抗病毒药物研究以及疫苗研制等工作提供一定的参考意义。
利益冲突:无

