基于结构生物学指导的SARS-CoV-2靶向药设计筛选
刘雪晴,严汉池
冠状病毒(CoV)是迄今为止被鉴定出的最大的RNA病毒,属于冠状病毒科,分为α、β、δ和γ冠状病毒4个属[1]。SARS-CoV-2是β冠状病毒属的新成员,与严重急性呼吸综合征冠状病毒(SARS-CoV)和几种以蝙蝠作为宿主的冠状病毒密切相关[2]。相比于SARS冠状病毒和MERS冠状病毒,SARS-CoV-2能够实现更快的人与人之间的传播,使病例数呈指数增长[3]。2020年3月11日,世界卫生组织(WHO)宣布新冠疫情全球大流行。面对如此严重的疫情,SARS-CoV-2靶向药的研发显得十分重要,也是目前科研攻关的重点和热点。在冠状病毒许多生命活动中可以寻找靶向位点:病毒通过膜融合进入宿主细胞、RNA复制和转录、病毒蛋白的翻译和水解加工、病毒组装和释放等。本文主要就结构指导的SARS-CoV-2靶向药研究进展做归纳整理。
1 目前已有结构的靶标
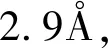
A为SARS-CoV-2 nsp12-nsp7-nsp8电镜结构(PDB ID:7btf);B为A旋转180°;以cartoon形式展示部分为nsp7(绿色)、nsp8(粉色);以surface形式展示部分为nsp12,结构域区分:Finger(蓝色)、Thumb(草绿色)、Palm(红色)、Interface(橙色)、NiRAN(黄色)图1 SARS-CoV-2 nsp12-nsp7-nsp8复合物结构Fig.1 Structure of the SARS-CoV-2 nsp12-nsp7-nsp8 complex
索非布韦是针对HCV ns5b的药物,通过与HCV ns5b聚合酶的催化位点结合起作用[5]。有研究称瑞德西韦可以抑制SARS-CoV-2的增殖[6],瑞德西韦和索非布韦均为核苷酸类似物,和RNA聚合酶竞争性结合。将瑞德西韦二磷酸结合nsp12的模型与索非布韦结合ns5b对比,发现SARS-CoV-2 nsp12与ns5b的Apo状态具有极高的相似性[4]。SARS-CoV-2 nsp12是重要的药物靶标,核苷类似物具有结构相似性,此类药物与聚合酶结合抑制机制可以类推到其他抗病毒药物的研发,或许可以找到抗冠状病毒广谱药物。
1.2MPro做为药物设计的靶标 SARS-CoV-2基因组由约30 000个核苷酸组成,病毒复制和转录需要两个多蛋白pp1a和pp1ab。Mpro由ppla和pplb自动裂解而来,裂解而来的MPro从多个保守位点水解多蛋白,功能性多肽通过多蛋白水解释放[7]。抑制Mpro的活性将阻止病毒复制,而且人类体内不存在与MPro密切相关的同源物,因而可将Mpro作为药物设计的靶标。之前有研究证明,通过抑制Michael受体可以特异性抑制多种冠状病毒的Mpro[8-11]。N3是一种Michael受体抑制剂,CC50>133 μmol/L,它在动物模型中显示出了对传染性支气管炎病毒的有效抗病毒活性。构建SARS-CoV-2 Mpro的同源性模型与N3进行分子对接,发现N3可以与Mpro底物结合部位结合。动力学分析表明它是该酶的时间依赖性不可逆抑制剂[7]。
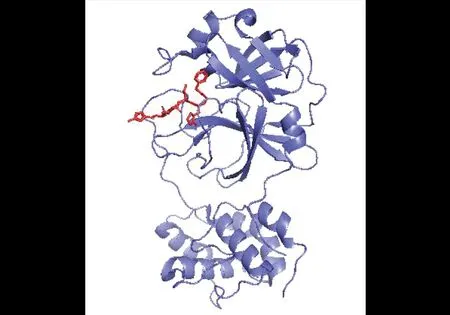
Mpro结合N3晶体结构(PDB ID:6lu7),蓝色部分为Mpro,红色部分为N3图2 SARS-CoV-2 Mpro-N3复合物结构Fig.2 Structure of the SARS-CoV-2 Mpro-N3 complex
通过荧光共振能量转移法筛选出7种化合物:disulfiram、carmofur、ebselen、shikonin、tideglusib、PX-12和TDZD-8。其中ebselen对Mpro活性的抑制作用最强,IC50值为0.67 μmol/L。将ebselen和N3做进一步体外酶促抑制实验:qRT-PCR结果表明,在SARS-CoV-2感染的Vero细胞中,ebselen和N3浓度为10 μmol/L时显示出最强的抗病毒作用;噬斑减少试验显示,ebselen和N3对SARS-CoV-2显示出抑制作用,EC50值分别为4.67 μmol/L和16.77 μmol/L;剂量反应曲线表明,它们两者都能够穿透细胞膜作用于靶标[7]。ebselen是一种具有抗炎、抗氧化和细胞保护特性的有机硒化合物,已经用于治疗躁郁症等多种疾病,具有极低的细胞毒性,许多临床试验中已经通过其安全性[12]。这些数据表明ebselen可能成为抗冠状病毒的有效药物。
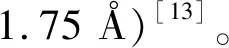
1.3刺突蛋白(S蛋白) 冠状病毒的密集糖基化刺突蛋白(S蛋白)由S1亚基、S2亚基组成,S蛋白在病毒与靶细胞融合过程中发挥非常重要的作用:S蛋白表面的S1亚基包含受体结合结构域(RBD),负责与靶细胞受体结合,使病毒附着于细胞表面,触发融合过程;受体结合破坏了S蛋白融合前三聚体的稳定性,细胞蛋白酶切割S蛋白使S1亚基脱离,S2亚基过渡到稳定的融合后构象,驱动病毒和细胞膜融合[14]。
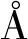

A B A为SARS-CoV-2 S蛋白单体不同构象比较,蓝色为“向下”构象(PDB ID: 6vxx),红色为“向上”构象(PDB ID: 6vsb);B为SARS-CoV-2 RBD与SARS-CoV RBD“向下”构象比较,蓝色为SARS-CoV-2 RBD,红色为SARS-CoV RBD(PDB ID: 6crz)图3 SARS-CoV-2 S蛋白单体结构Fig.3 Structure of a single protomer of SARS-CoV-2 S protein
有研究证明SARS-CoV-2和SARS-CoV的细胞受体均为血管紧张素转化酶2(ACE2)。ACE2以约15 nmol/L的亲和力与SARS-CoV-2 S蛋白结合,比结合SARS-CoV S蛋白的亲和力高约10到20倍。SARS-CoV-2 S蛋白对ACE2的高亲和力可能使SARS-CoV-2更容易在人与人之间传播[15]。在S蛋白的S1亚基RBD与靶细胞ACE2受体结合后,S2亚基 HR1结构域形成一个平行的三聚螺旋线圈中心,HR2结构域以反平行的方式缠绕在一起彼此相互作用形成6个螺旋束(6-HB)融合核心,将病毒和细胞膜紧密融合在一起。将SARS-CoV-2的6-HB结构与其他冠状病毒相比,发现6-HB整体结构高度保守,只是SARS-CoV-2 6-HB中HR2螺旋更长且弯曲程度更大,与HR1结合更紧密[1]。
S蛋白与人体ACE2受体的结合决定了病毒是否能入侵人体细胞,是药物和疫苗设计的重点。有研究表明肽类化合物EK1可以干扰病毒6-HB的形成并有效抑制冠状病毒感染。但是,SARS-CoV-2 6-HB结构变化使其更加稳定,可能降低EK1的抗病毒效力[1]。脂化可有效地提高融合抑制肽的抗病毒活性[16]。为了提高EK1及其衍生物的抑制活性,将胆固醇(Chol)和棕榈酸(Palm)分别共价连接到EK1、EK1C、EK1P的C末端。实验结果表明,C末端脂化(尤其是胆固醇修饰)可以提高抑制剂对SARS-CoV-2的融合抑制活性,其中连接胆固醇的EK1C表现较佳[1],因此做进一步设计修饰。
选用不同的接头将EK1C连接胆固醇,发现接头长度对脂肽的总体活性具有显著影响。EK1C4使用更长的5氨基酸接头“GSGSG”,大大提高了它的抑制能力。EK1C4对SARS-CoV-2 表现出最强的抑制活性,IC50值为15.8 nmol/L,比EK1的抑制活性强149倍。EK1C4和SARS-CoV-2-HR1之间的结合亲和力较单独的EK1肽显著提高,这表明胆固醇基团可能直接参与了与HR1的结合[1]。EK1C4的抑制机制和结构还有待进一步研究。
随着时间推移,SARS-CoV-2分离株在S蛋白残基614产生了天冬氨酸(D)到甘氨酸(G)的突变,残基614位于S1和S2亚基中间,SARS-CoV-2的S蛋白突变限制了S1结构域的脱离,这一变化使S蛋白更加稳定[17]。流行病学数据表明这增强了病毒的传播,也进一步证明了S蛋白对攻克SARS-CoV-2至关重要。
2 具有研究价值的潜在药物靶标
SARS-CoV-2共表达29个蛋白,病毒复制相关的蛋白16个,结构蛋白4个,其余9个蛋白似乎与免疫逃逸相关;共有332个宿主蛋白与该病毒有一定结合力[18]。从这些蛋白中或许可以筛选出更多的抗病毒药物靶点。
丝氨酸蛋白酶TMPRSS2,近期有研究证明SARS-CoV-2与ACE2受体结合进入靶细胞是通过TMPRSS2在S1/S2位点和S2′位点切割S蛋白引发的,TMPRSS2对于病毒进入靶细胞不可或缺。甲磺酸卡莫司他是TMPRSS2的抑制剂,可以显着降低几种冠状病毒包括SARS-CoV-2的感染,并没有对细胞产生任何明显的毒性作用[19]。总之,甲磺酸卡莫司他可以阻止SARS-CoV-2感染肺细胞,然而具体的作用机制还有待阐明。
人类细胞产生抗病毒蛋白,抗病毒蛋白可以识别病毒核酸并将其降解,而SARS-CoV-2编码的两个蛋白nsp10和nsp16可以伪装病毒基因组,进行免疫逃逸[18],也许这是SARS-CoV-2如此难对付的关键因素之一。针对nsp10和nsp16筛选设计靶向药物,抑制病毒免疫逃逸,这或许也是有效治疗方案。此假设需要实验证明其可行性。
从源头阻止病毒复制是有效抑制SARS-CoV-2的思路。在病毒进行翻译或复制之前,需要解开缠绕的RNA链,nsp13则可能是解开RNA缠绕的蛋白[18]。因此,nsp13对靶向药研发也有重要研究价值。
SARS-CoV-2表达的29个蛋白中,有一些蛋白的功能尚未确定,如何挖掘出更多潜在药物靶标,筛选设计靶向药物,还需借助结构生物学手段做进一步研究。
3 总结与展望
从SARS病毒、MERS病毒到最近的SARS-CoV-2,我们经历了3次由冠状病毒引起的严重疫情。此次新型冠状病毒来势汹汹,其传播速度之快,波及地区之广,对人类健康和全球经济造成了极大影响。目前全球的科学家们都在抓紧攻克SARS-CoV-2相关课题,关于SARS-CoV-2疫苗和药物的研究是重点也是热点。而在目前尚未有药物面市的情况下,应对病毒的最有效方法仍然是做好防护、增强自身免疫力、及时发现并隔离。愿疫情能早日被控制!
利益冲突:无

